En Çok Okunanlar
Özet
Amaç: İnflamatuar marker olarak bilinen prokalsitonin (PCT) ve C-reaktif protein (CRP) kan dolaşımı infeksiyonlarında etiyolojiye göre farklı seviyelerde yükseklik gösterebilmektedir. Çalışmamızda kan dolaşımı infeksiyonlarında serum PCT ve CRP seviyelerinin etiyolojiyi tahmin etmedeki rolünü araştırmayı amaçladık.
Yöntem: Ocak 2018- Temmuz 2021 tarihleri arasında hastanemiz mikrobiyoloji laboratuvarına gönderilen kan kültürleri retrospektif olarak tarandı ve kan kültüründe pozitiflik saptanan 501 hasta çalışmaya dahil edildi. Hastalar kan kültürü üremesine göre; Gram-negatif bakteri (GNB), Gram-pozitif bakteri (GPB), mantar, Enterobacterales ve nonfermenter bakteri olarak gruplandırıldı. Prokalsitonin ve CRP değerleri için gruplar arasında anlamlı fark olup olmadığı araştırıldı. Normal dağılan sayısal verilerin karşılaştırılmasında Student t testi, normal dağılmayan sayısal verilerin karşılaştırılmasında Mann-Whitney U testi kullanıldı. Her gruptaki sürekli değişkenler için medyan değer, birinci çeyrek (Q1) ve üçüncü çeyrek (Q3) dilim değerleri verildi. Kategorik verilerin karşılaştırılması χ2 testi ile yapıldı.
Bulgular: Prokalsitonin medyan değeri, GNB-GPB grup karşılaştırılmasında GNB grubunda anlamlı düzeyde daha yüksek bulunmakla birlikte CRP medyan değerleri arasında anlamlı düzeyde fark bulunmadı. Prokalsitoninin 0.5 ng/ml eşik değeri için, GNB-GPB grup karşılaştırmasında çizilen ROC eğrisi altında kalan alan 0.675 (%95 güven aralığı=0.623-0.726; p<0.001) olarak tespit edildi; optimal eşik değeri %75 duyarlılık, %53 özgüllük ile 1.45 ng/ml idi.
Sonuç: Kan dolaşımı infeksiyonlarında PCT, Gram-negatif bakteriyemiyi Gram-pozitif bakteriyemiden ayırmada kullanılabilecek bir marker olarak bulundu. Ancak CRP’nin bakteriyemide etiyolojiyi tahmin etmede kullanılamayacağı sonucuna varıldı.
GİRİŞ
Kan dolaşımı infeksiyonları gibi hayatı tehdit eden infeksiyonların tanısında duyarlılığı ve özgüllüğü yüksek, güvenilir bir belirteç son derece önemlidir. Mikrobiyal kültür, kan dolaşımı infeksiyonlarının tanısında kabul edilen bir yöntemdir. Bununla birlikte, geleneksel mikrobiyolojik yöntemlerin bazı kısıtlılıkları vardır; uzun inkübasyon süreleri, kontaminasyon nedeniyle özgüllüğün düşük olması, konvansiyonel kan kültürü ortam ve sistemlerinde bazı mikroorganizmaların yetersiz üremesi veya hiç ürememesi bunların en önemlileridir. Potansiyel kan dolaşımı patojenlerinin tamamını saptamak için kullanılan ve en iyi olan tek bir kültür ortamı veya sistemi gösterilmemiştir. Bütün bunlar tanıda gecikmelere neden olabilmekte ve klinisyenler ampirik antibiyotik tedavisine başvurmaktadır. Kan dolaşımı infeksiyonlarının hızlı tanısında kullanılan ana serolojik parametreler; C-reaktif protein (CRP) ve prokalsitonin (PCT)’dir (1).
C-reaktif protein, infeksiyöz ve infeksiyöz olmayan inflamatuar süreçlerde spesifik olmayan bir şekilde yükselen bir akut faz proteinidir. Bakteriyel infeksiyonlarda viral infeksiyonlara göre daha fazla artar (2). Ancak sistemik bakteriyel infeksiyonlara özgü değildir (1).
Prokalsitonin, kalsitoninin öncüsü olan ve kalsiyum hemostazı sağlayan bir prohormondur; normalde vücutta çok düşük konsantrasyonda bulunur ve sadece tiroid bezi ve akciğerdeki nöroendokrin hücrelerden salınır (3). Bununla birlikte PCT, bakteriyel infeksiyonlarda salınan endotoksin ve mediatörlere yanıt olarak vücutta daha yüksek konsantrasyonlarda salgılanır. Aynı zamanda infeksiyonun ciddiyeti ve yaygınlığı ile de oldukça ilişkilidir (4). Ayrıca yanık, travma ve cerrahi müdahaleler gibi durumlarda PCT’nin yükseldiği bilinmektedir. Prokalsitonin düzeylerinin cerrahi müdahale sonrası herhangi bir infeksiyon olmaksızın beşinci güne kadar yükselebileceği ancak normal sınırları aşmadığı çeşitli çalışmalarda gösterilmiştir (5-7).
Gram-pozitif bakteri (GPB)’ler, Gram-negatif bakteri (GNB)’ler veya mantarların farklı Toll-benzeri reseptör (TLR) sinyal yollarını aktive ettiği ve sonuçta PCT salınımını uyaran farklı proinflamatuar sitokinlerin üretimine neden olduğu bilinmektedir (8). Bu da farklı patojenlerin farklı seviyelerde PCT salınımına neden olabileceğini göstermektedir (9).
Çalışmamızda, kan dolaşımından izole edilen GNB, GPB ve mantarların CRP ve PCT değerlerini yükseltme seviyeleri karşılaştırılarak aralarında anlamlı fark olup olmadığının araştırılması amaçlandı.
YÖNTEMLER
Ocak 2018-Temmuz 2021 tarihleri arasında hastanemizin mikrobiyoloji laboratuvarına gönderilen kan kültürleri retrospektif olarak tarandı. Bir veya daha fazla sette saf kültür üremesi olan hastalar, eş zamanlı başka kültür üremesi olmayan hastalar, eş zamanlı başka kültür üremesi olan hastalardan kan kültürü ile aynı patojen üreyen hastalar, kan kültürü alındıktan ±24 saat içerisinde CRP ve PCT bakılmış olan hastalar, 18 yaşından büyük hastalar çalışmaya dahil edildi. Polimikrobiyal üreme olan hastalar, Corynebacterium spp., koagülaz-negatif stafilokok, Micrococcus spp. gibi cilt flora bakteri üremesi olan hastalar, travma ve yanık hastaları ve ameliyattan sonraki beş gün içinde üreme olan hastalar ve eş zamanlı başka kültür üremesi olan hastalardan kan kültürü ile farklı patojen üreyen hastalar çalışma dışı bırakıldı. Aynı hastaya ait aynı patojen ile tekrarlayan kan kültürü üremelerinde hastanın ilk kültür üremesi çalışmaya dâhil edilmiş olup tekrarlayan üremeler çalışma dışı bırakıldı.
Kültür için BacT/Alert® 3D (bioMérieux, Marcy l’Etoile, Fransa) tam otomatik kan kültürü cihazı kullanıldı ve bakteri identifikasyonları VITEK® 2 (bioMérieux, Marcy l’Etoile, Fransa) otomatize sistemiyle ile yapıldı. C-reaktif protein değerleri Cobas® 6000 (Roche Diagnostics, ABD) cihazında immünoturbidometrik yöntemle çalışıldı ve 0.3-5 mg/lt normal sınır değer aralığı olarak, 5 mg/dl’den büyük ve eşit değerler ise yüksek değer olarak kabul edildi. Prokalsitonin değerleri Cobas® 6000 (Roche Diagnostics, ABD) cihazında elektrokemolüminesans sandviç yöntemi ile çalışıldı ve 0.02-0.5 ng/ml normal sınır değer aralığı olarak, 0.5 ng/ml’ye eşit ve daha büyük değerler ise yüksek değer olarak kabul edildi. Hastalar kan kültürü üremesine göre GNB, GPB, mantar, Enterobacterales ve nonfermenter bakteriler olarak gruplandırıldı.
Çalışma için Amasya Üniversitesi Tıp Fakültesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 12 Mayıs 2022 tarih ve 52 karar numarasıyla onay alınmıştır.
İstatistiksel Analiz
Verilerin analizi, SPSS (“Statistical Package for the Social Sciences”) versiyon 20.0 programı (IBM Corp., Armonk, NY, ABD) kullanılarak yapıldı. Sayısal verilerin normal dağılıma uygunluğu Shaphiro-Wilk testi ile değerlendirildi. Normal dağılan sayısal verilerin karşılaştırılmasında Student t testi, normal dağılmayan sayısal verilerin karşılaştırılmasında Mann-Whitney U testi kullanıldı. Her gruptaki sürekli değişkenler için medyan değer, birinci çeyrek (Q1) ve üçüncü çeyrek (Q3) dilim değerleri verildi. Kategorik verilerin karşılaştırılması χ2 testi ile, üç veya daha fazla grubun karşılaştırılması ise Kruskal-Wallis testi ile yapıldı. Farklı eşik değerlerinde, PCT ve CRP’nin tanısal değerini belirlemek için “receiver operating characteristic” (ROC) eğrisi analizi kullanıldı; PCT ve CRP için optimal eşik değerleri Youden indeksi kullanılarak belirlendi; p değeri için <0.05 anlamlı düzey olarak kabul edildi.
BULGULAR
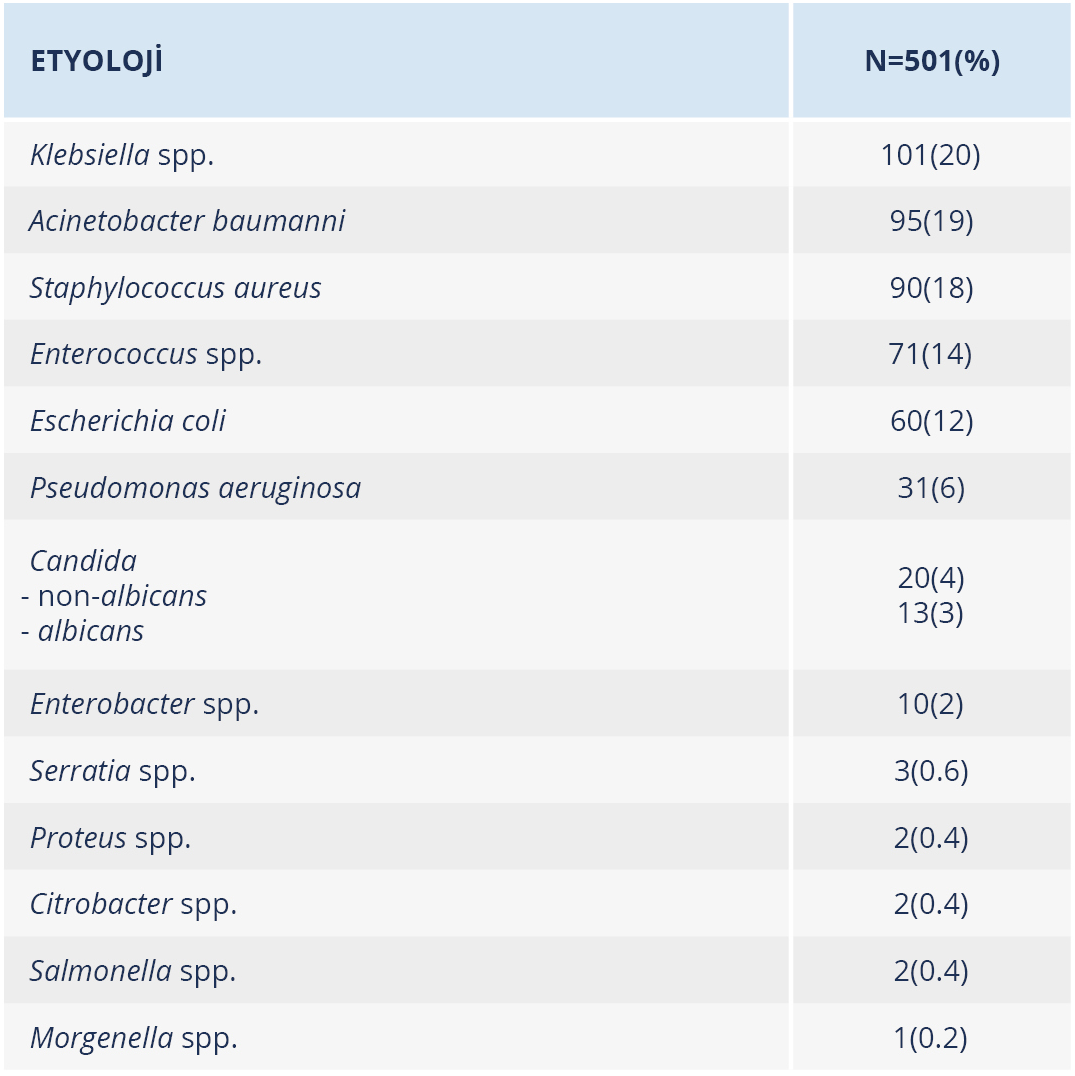
Çalışma kapsamında, Ocak 2018-Temmuz 2021 tarihleri arasında laboratuvarımıza gönderilen kan kültürü örnekleri incelendi. Çalışmaya dâhil edilme kriterlerini karşılayan 501 hastanın 291 (%58)’i erkek, 210 (%42)’u kadındı. Hastaların 397 (%79)’si yoğun bakımda, 77 (%15)’si dahili servislerde, 23 (%5)’ü cerrahi servislerde ve 3 (%1)’ü ayaktan takip ediliyordu. Kan kültüründe GNB tespit edilen hasta sayısı 307 (%61) ve GPB tespit edilen hasta sayısı 161 (%32) olup 33 (%7) hastada maya üremesi tespit edildi. Gram-negatif bakteriler arasında Klebsiella spp. (n=101, %20) ve GPB’ler arasında ise Staphylococcus aureus (n=90, %18) en sık izole edilen etkenlerdi (Tablo 1).
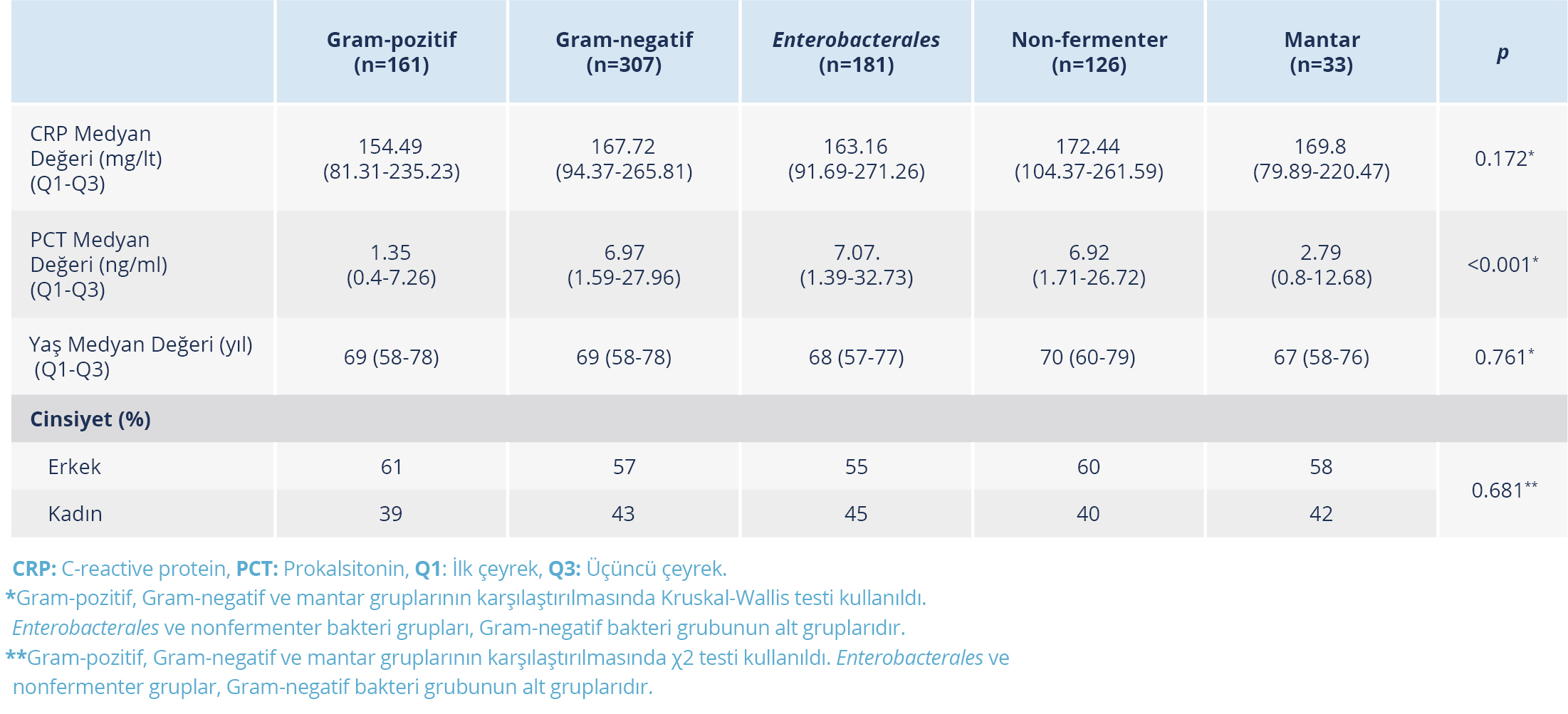
Tablo 2. İzole Edilen Mikroorganizma Gruplarına Göre Hastaların Yaş, Cinsiyet, Serum Prokalsitonin ve C-reaktif Protein Değerlerinin Dağılımları
Prokalsitonin medyan değeri; GNB grubunda 6.97 (1.59-27.96) ng/ml, GPB grubunda 1.35 (0.4-7.26) ng/ml, mantar grubunda 2.79 (0.8-12.68) ng/ml, Enterobacterales grubunda 7.07 (1.39-31.73) ng/ml ve nonfermenter bakteri grubunda 6.92 (1.71-26.72) ng/ml olarak tespit edildi (Tablo 2). Gram-negatif bakteri grubu, GPB grubuna göre anlamlı düzeyde daha yüksek PCT medyan değerine sahipti (p<0.001). GPB grubu-mantar grubu (p=0.101), GNB grubu-mantar grubu (p=0.051) ve Enterobacterales-nonfermenter bakteri grubu (p=0.589) arasında PCT medyan değeri açısından anlamlı düzeyde bir fark bulunmadı.
C-reaktif protein medyan değeri; GNB grubunda 167.72 (94.37-265.81) mg/lt, GPB grubunda 145.49 (81.31-235.23) mg/lt, mantar grubunda 169.8 (79.89-220.47) mg/lt, Enterobactareles grubunda 163.16 (91.69-271.26) mg/lt ve nonfermenter bakteri grubunda 172.44 (104.37-261.59) mg/lt olarak tespit edildi (Tablo 2). C-reaktif protein değerleri tüm gruplarda benzer bulundu.
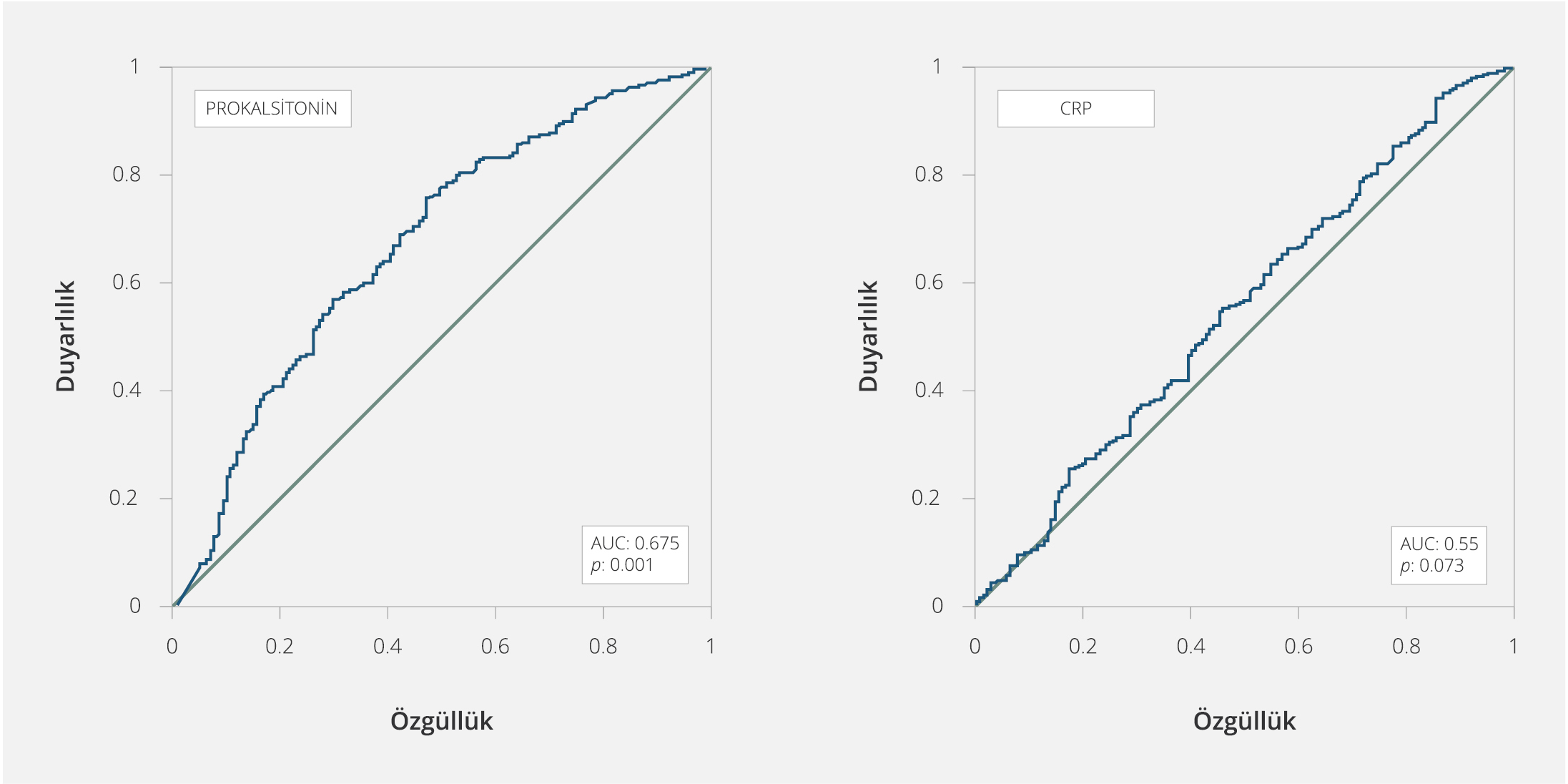
Şekil 1. Gram-negatif Bakteri ve Gram-pozitif Bakteri Gruplarının Karşılaştırılmasında PCT ve CRP Değerleri İçin ROC Eğrisi
Gram-negatif bakteri ve GPB gruplarının ayrımında; PCT ve CRP için farklı eşik değerlerinde duyarlılık ve özgüllük hesaplandı. Prokalsitonin için optimal eşik değeri %75 duyarlılık ve %53 özgüllük ile 1.45 ng/ml olarak bulundu; ROC eğrisi altında kalan alan 0.675 (%95 güven aralığı (GA)=0.623-0.726; p<0.001) olarak belirlendi (Şekil 1). C-reaktif protein için %54 duyarlılık ve %55 özgüllük ile optimal eşik değeri 153.6 mg/lt olarak bulundu; ROC eğrisi altında kalan alan 0.550 (%95 GA=0.495-0.606; p=0.073) olarak belirlendi (Şekil 1).
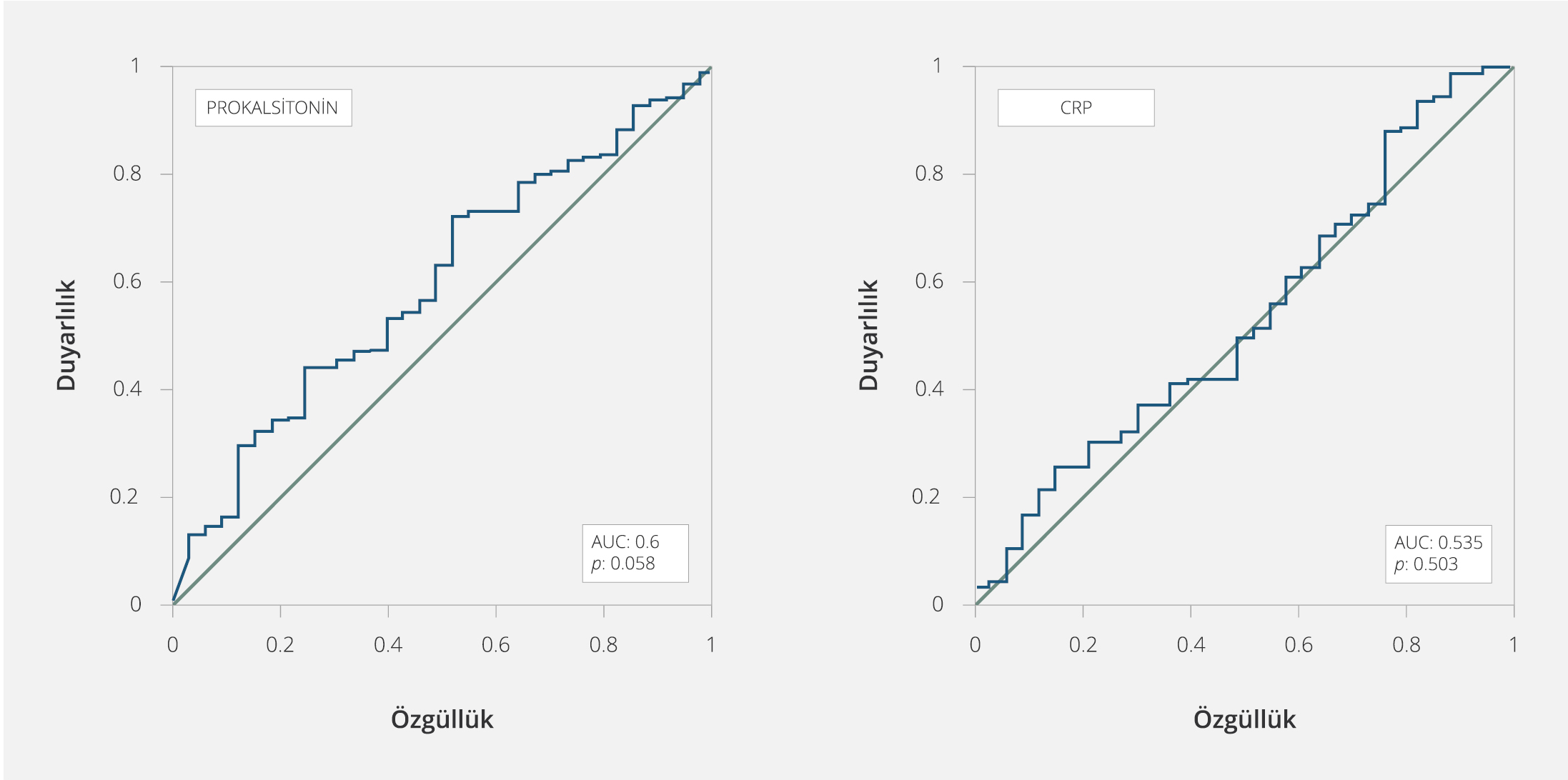
Şekil 2. Gram-negatif Bakteri ve Mantar Gruplarının Karşılaştırılmasında PCT ve CRP Değerleri İçin ROC Eğrisi
Gram-negatif bakteri ve mantar gruplarının ayrımında; PCT için %72 duyarlılık ve %49 özgüllük ile optimal eşik değer 1.81 ng/ml olarak bulundu; ROC eğrisi altında kalan alan 0.600 (%95 GA=0.502-0.699; p=0.058) olarak belirlendi (Şekil 2). C-reaktif protein için optimal eşik değeri %87 duyarlılık ve %25 özgüllük ile 62.58 mg/lt olarak bulundu; ROC eğrisi altında kalan alan 0.535 (%95 GA=0.430-0.641; p=0.503) olarak belirlendi (Şekil 2).
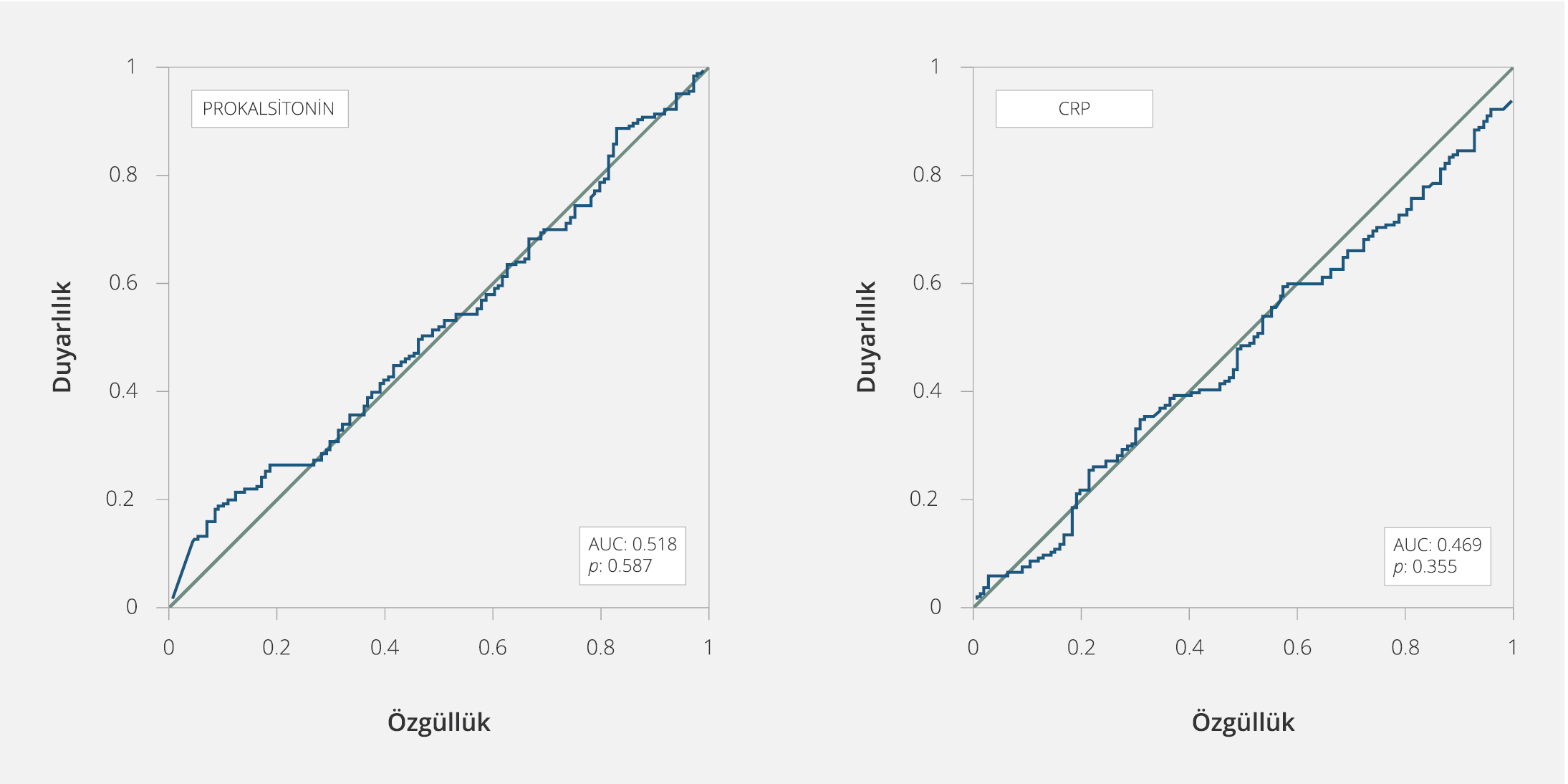
Şekil 3. Enterobacterales ve Nonfermenter Bakteri Gruplarının Karşılaştırılmasında PCT ve CRP Değerleri İçin ROC Eğrisi
Nonfermenter bakteri ile Enterobacterales gruplarının ayrımında PCT için %17 duyarlılık ve %93 özgüllük ile optimal eşik değer 56.09 ng/ml olarak bulundu; ROC eğrisi altında kalan alan 0.518 (%95 GA=0.453-0.583; p=0.587) olarak belirlendi (Şekil 3). C-reaktif protein için optimal eşik değeri %24 duyarlılık ve %79 özgüllük ile 271.32 mg/lt olarak bulundu; ROC eğrisi altında kalan alan 0.469 (%95 GA=0.404-0.534; p=0.355) olarak belirlendi (Şekil 3).
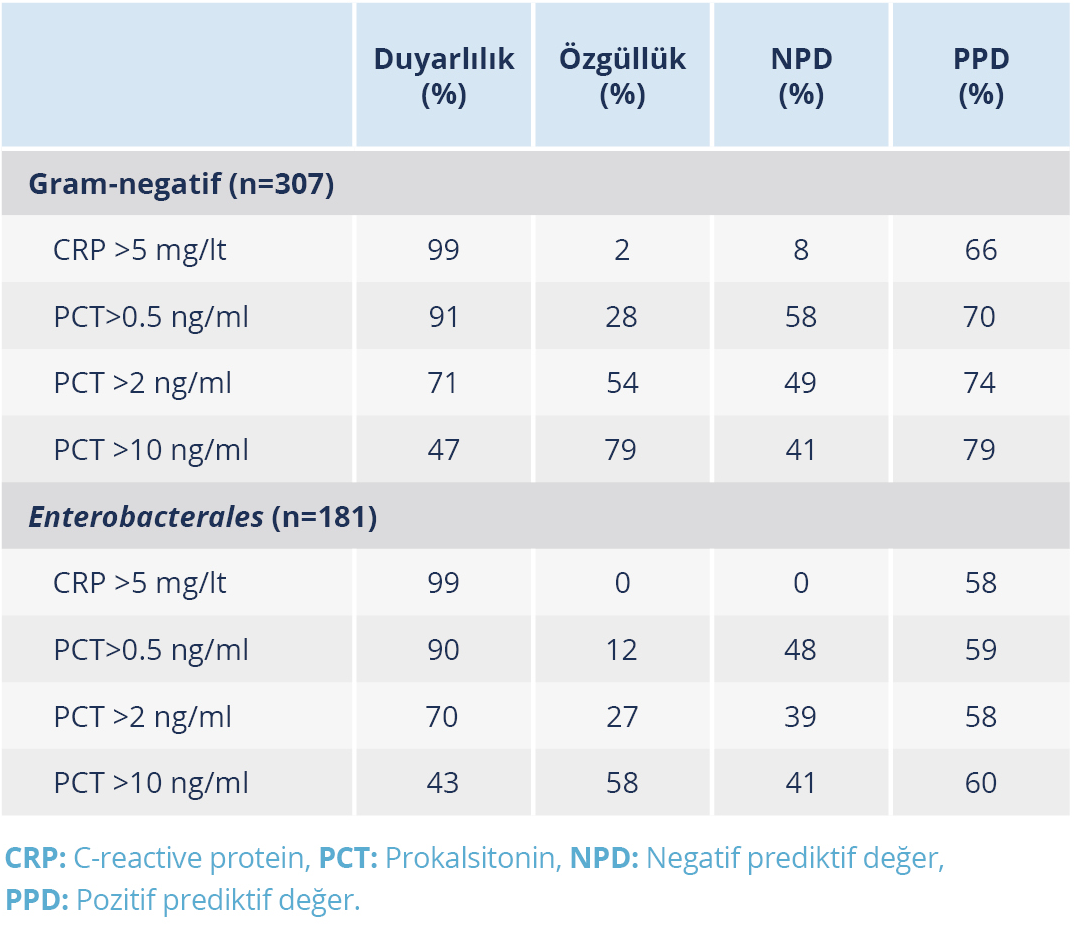
Tablo 3. Gram-negatif Bakteri ve Enterobacterales Nedenli Bakteriyemiyi Tahmin Etmede CRP ve PCT’nin Duyarlılık, Özgüllük, Negatif ve Pozitif Prediktif Değerleri
C-reaktif protein ve PCT’nin GNB ve Enterobacterales gruplarına ait bakterilerin neden olduğu pozitif kan kültürünü tahmin etmedeki duyarlılığı, özgüllüğü, negatif prediktif ve pozitif prediktif değerleri Tablo 3’te özetlendi ve PCT’nin >0.5 ng/ml, >2 ng/ml ve >10 ng/ml değerleri ve CRP’nin >5 mg/lt değeri için analiz yapıldı.
İRDELEME
Konak immün sistemi farklı patojenlere farklı yanıtlar verir. İmmün cevap ilk olarak TLR tarafından tanınan “pathojen-associated moleculer patterns” (PAMPs)’ların konak tarafından tanınmasıyla başlar. Gram-pozitif bakterilerin lipoteikoik asidi TLR2 tarafından tanınırken, GNB’lerin lipopolisakaritleri TLR4 tarafından tanınır. Toll-benzeri reseptörlerin aktivasyonu ile inflamatuar sitokinlerin ve akut faz reaktanlarının salınımını tetikleyen nükleer faktör kB ve diğer interferon düzenleyici faktörler, lökositlerde farklı gen ekspresyonlarını indükler (10). Gram-negatif bakteriler, GPB’lerden daha fazla proinflamatuar sitokin salınımına neden olur (11). Bu farklı sitokin yanıtı, farklı PCT düzeylerinin görülmesine yol açar.
Çalışmamızın en önemli bulgusu, GNB’lerin neden olduğu kan dolaşımı infeksiyonlarında GPB’lere göre PCT’nin anlamlı düzeyde daha yüksek konsantrasyonlarda bulunması olup GNB, GPB ve mantar gruplarının PCT medyan değerleri sırasıyla 6.97 (1.59-27.96) ng/ml, 1.35 (0.4-7.26) ng/ml ve 2.79 (0.8-12.68) ng/ml olarak tespit edildi; PCT medyan değeri GNB grubunda GPB grubuna göre anlamlı düzeyde daha yüksek bulundu (p<0.001). Ancak GPB-mantar grubu (p=0.101) ve GNB-mantar grubu (p=0.051), PCT medyan değerleri açısından istatistiksel olarak benzer bulundu. Varela-Patiño ve ark.’nın (12) 653 hastayı inceledikleri çalışmalarında, PCT medyan değeri GNB grubunda 6.02 (1.39-39.40) ng/ml, GPB grubunda ise 1.74 (0.22-15.61) ng/ml olarak bildirilmiştir. Söz konusu çalışmada, iki grup PCT değerleri karşılaştırıldığında, GNB grubunun anlamlı düzeyde daha yüksek PCT değerine sahip olduğu belirtilmiştir (p<0.05). Ülkemizde yapılan ve 410 hastanın dahil edildiği başka bir çalışmada ise PCT medyan değeri GNB grubunda 7.31 (2.12-20.72) ng/ml, GPB grubunda 0.46 (0.25-2.30) ng/ml olarak bildirilmiş ve GNB grubunun PCT değerinin anlamlı düzeyde daha yüksek olduğu belirtilmiştir (p<0.001) (13). Brodská ve ark. (14), Leli ve ark. (9), Li ve ark. (15) çalışmalarında, GNB grubunun GPB grubundan anlamlı düzeyde daha yüksek PCT değerlerine sahip olduğunu bildirmiştir. Ayrıca bizim araştırmamızdan farklı olarak GNB grubunun mantar grubundan anlamlı düzeyde daha yüksek PCT değerlerine sahip olduğunu da bildirmişlerdir. Ogasawara ve ark. (16) PCT değerinin GNB grubunda GPB grubuna göre anlamlı düzeyde daha yüksek olduğunu bildirmiştir. Bulgularımızla benzer şekilde, Leng ve ark. (17), GNB grubunun GPB grubundan anlamlı düzeyde daha yüksek PCT değerlerine sahip olduğunu tespit etmiştir; ancak GNB ve mantar grubu PCT değerlerini istatistiksel olarak benzer bulmuşlardır. Lin ve ark. (18) 119 yanık hastasını inceledikleri çalışmalarında, PCT medyan değerinin GNB grubunda [2.67 (1.58-6.08) ng/ml] GPB grubuna [1.04 (0.35-1.60) ng/ml; p=0.01] ve mantar grubuna [1.09 (0.82-2.30) ng/ml; p=0.05] göre anlamlı düzeyde daha yüksek olduğunu bildirmiştir. Bu sonuçlar bize PCT’nin GNB-GPB etiyolojisinin ayrımında kullanılabileceğini göstermekle birlikte PCT’nin GNB-mantar etiyolojisinin ayrımında kullanılması konusunda tam bir fikir birliği yoktur. Mantarların üremesi ve kültürde saptanması zor olduğundan sayıları diğer patojenlere göre nispeten daha az bulundu. Bu nedenle mantar grubunun diğer gruplarla karşılaştırılmasında anlamlı düzeyde bir fark bulunamadı. Bu sorunu çözmek için mantarların daha kolay tespit edilebildiği PCR tabanlı testler ile ileri çalışmalara ihtiyaç vardır.
Çalışmamızda GNB, GPB ve mantar gruplarının CRP medyan değerleri sırasıyla 167.72 (94.37-265.81) mg/lt, 145.49 (81.31-235.23) mg/lt ve 169.8 (79.89-220.47) mg/lt olarak tespit edildi; GNB-GPB grubu (p=0.73) ile GNB-mantar grubunun (p=0.384) CRP medyan değerleri istatistiksel olarak benzer bulundu. Varela-Patiño ve ark. (12) ve Li ve ark.’nın (15) bulguları çalışmamızla benzer olmakla birlikte Bilgili ve ark.’nın (13) yoğun bakımda yatan 136 sepsis hastasını inceledikleri çalışmalarında, GNB grubunun GPB grubuna göre anlamlı düzeyde daha yüksek CRP değerlerine sahip olduğu bildirilmiştir. İncelenen hasta sayısının bu çalışmadan daha az olması ve daha spesifik bir hasta grubunun incelenmiş olması bu farklı sonuca neden olmuş olabilir. Bulgularımıza benzer şekilde, 636 hastayı kapsayan bir çalışmada, GNB grubunun GPB grubuna göre anlamlı düzeyde daha yüksek PCT değerlerine sahip olduğu ancak CRP değerlerinin istatistiksel olarak benzer olduğu bildirilmiştir (19). Koizumi ve ark. (20) 207 hastayı kapsayan araştırmalarında, GNB grubunun GPB grubuna göre anlamlı düzeyde daha yüksek PCT ve CRP değerlerine sahip olduğunu tespit etmiştir.
Çalışmamızda Enterobacterales ve nonfermenter grubun PCT (p=0.589) ve CRP (p=0.357) medyan değerleri istatiksel olarak karşılaştırıldığında iki grup benzer bulundu. Leng ve ark. (17) Enterobacterales ve nonfermenter grubun PCT medyan değerlerini sırasıyla 1.51 (0.28-10.48) ng/ml ve 0.99 (0.24-4.14) ng/ml olarak bildirmiş ve çalışmamızla benzer şekilde, iki grubu PCT değerleri açısından benzer bulmuşlardır.
ROC eğrisine göre GNB ve GPB grupları karşılaştırıldığında, PCT optimal eşik değeri %75 duyarlılık ve %53 özgüllük ile 1.45 ng/ml olarak bulundu; ROC eğrisi altında kalan alan 0.675 (%95 GA=0.623-0.726; p<0.001) olarak hesaplandı. Ayrıca, GNB grubunun PCT medyan değeri anlamlı düzeyde daha yüksek bulundu. Li ve ark. (15) GNB ve GPB gruplarının karşılaştırılmasında PCT için ROC eğrisi altında kalan alanı 0.786 (%95 GA=0.731–0.841; p<0.001) olarak bildirmiştir. Lai ve ark. (21) 25 çalışmanın incelendiği meta-analiz çalışmasında, GNB kaynaklı kan dolaşımı infeksiyonlarında ROC eğrisi altında kalan alan PCT için 0.85 (%95 GA=0.81-0.87) ve CRP için 0.78 (%95 GA=0.74-0.81) olarak tespit edilmiş ve kan dolaşımı infeksiyonlarında etiyolojiyi tahmin etmede PCT’nin CRP’den daha iyi performans gösterdiği bildirilmiştir. Koizumi ve ark.’nın (20) bulguları da çalışmamızla benzerdir.
Ayrıca Enterobacterales ve nonfermenter bakteri gruplarının karşılaştırılmasında PCT optimal eşik değeri %17 duyarlılık ve %93 özgüllük ile 56.09 ng/ml olarak bulundu; PCT değeri için ROC eğrisi altında kalan alan 0.518 (%95 GA=0.453-0.583; p=0.587) idi. Olmuşçelik ve ark. (19) ise bu iki grubun karşılaştırılmasında ROC eğrisi altında kalan alanı 0.609 (%95 GA=0.542-0.676; p=0.003) olarak bildirmiştir.
Çalışmamızda ROC eğrilerine göre tüm grup karşılaştırmalarında CRP değerleri benzer bulundu. Li ve ark. (15) da çalışmamızla benzer bir şekilde ROC eğrilerine göre GNB ve GPB gruplarının CRP değerlerinin benzer olduğunu bildirmiştir.
Hasta verilerinin hastane bilgi sisteminden alındığı retrospektif bir çalışma olması araştırmamızın en önemli kısıtlılığıdır. Bu nedenle hastaların klinik durumları hakkında çok az bilgi edinebildik. Ayrıca, kan kültüründe bakteri ve mantar üremesi olan hastalar çalışmaya alındığı için kan dolaşımı infeksiyonunun hangi odaktan kaynaklandığı bilinmemektedir.
Sonuç olarak; GNB’lerin neden olduğu kan dolaşımı infeksiyonlarında PCT medyan değerleri GNB’ye göre anlamlı düzeyde daha yüksek bulundu ve PCT’nin optimal eşik değerinin, GNB ve GPB grup ayrımında kullanılabileceği sonucuna varıldı. Tüm grup karşılaştırmalarında CRP düzeylerinin benzer bulunması nedeniyle de CRP’nin kan dolaşımı infeksiyonlarının etiyolojisini tahmin etmede kullanılamayacağı anlaşıldı.
Hasta Onamı
Veriler retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Amasya Üniversitesi Tıp Fakültesi Girişimsel Olmayan Klinik Araştırmalar Etik Kurulu’ndan 12 Mayıs 2022 tarihinde 52 karar numarası ile onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – A.A., M.Ç.; Tasarım – M.Ç.; Denetleme – A.A., M.Ç.; Kaynak ve Fon Sağlama – Ş.Ç., H.D.; Malzemeler/Hastalar – A.A., H.D.; Veri Toplama ve/veya İşleme – A.A., H.D.; Analiz ve/veya Yorum – Ş.Ç.; Literatür Taraması – A.A., M.Ç.; Makale Yazımı – A.A.; Eleştirel İnceleme – M.Ç., Ş.Ç.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Referanslar
- Schuetz P, Albrich W, Mueller B. Procalcitonin for diagnosis of infection and guide to antibiotic decisions: past, present and future. BMC Med. 2011;9:107. [CrossRef]
- Hengst JM. The role of C-reactive protein in the evaluation and management of infants with suspected sepsis. Adv Neonatal Care. 2003;3(1):3-13. [CrossRef]
- Becker KL, Snider R, Nylen ES. Procalcitonin in sepsis and systemic inflammation: a harmful biomarker and a therapeutic target. Br J Pharmacol. 2010;159(2):253-64. [CrossRef]
- Gogos CA, Drosou E, Bassaris HP, Skoutelis A. Pro- versus anti-inflammatory cytokine profile in patients with severe sepsis: a marker for prognosis and future therapeutic options. J Infect Dis. 2000;181(1):176-80. [CrossRef]
- Jebali MA, Hausfater P, Abbes Z, Aouni Z, Riou B, Ferjani M. Assessment of the accuracy of procalcitonin to diagnose postoperative infection after cardiac surgery. Anesthesiology. 2007;107(2):232-8. [CrossRef]
- Yasmin D, Bulut G, Yildiz M. [Can procalcitonin be used for the diagnosis and follow-up of postoperative complications after fracture surgery?]. Acta Orthop Traumatol Turc. 2006;40(1):15-21. Turkish.
- Yağlı G. Kalp cerrahisi sonrası enfeksiyon gelişiminde prokalsitoninin; sedimentasyon, CRP ve lökosit ile birlikte diagnostik önemi [Tıpta uzmanlık tezi]. Kocaeli Üniversitesi Tıp Fakültesi; 2021.
- Kumar S, Ingle H, Prasad DV, Kumar H. Recognition of bacterial infection by innate immune sensors. Crit Rev Microbiol. 2013;39(3):229-46. [CrossRef]
- Leli C, Ferranti M, Moretti A, Al Dhahab ZS, Cenci E, Mencacci A. Procalcitonin levels in Gram-positive, Gram-negative, and fungal bloodstream infections. Dis Markers. 2015;2015:701480. [CrossRef]
- Abbas AK, Lichtman AH. Temel İmmunoloji: İmmün Sistemin İşlev ve Bozuklukları. İstanbul: İstanbul Medikal Yayıncılık, 2007.
- Mohamed MA, Cunningham-Rundles S, Dean CR, Hammad TA, Nesin M. Levels of pro-inflammatory cytokines produced from cord blood in-vitro are pathogen dependent and increased in comparison to adult controls. Cytokine. 2007;39(3):171-7. [CrossRef]
- Varela-Patiño M, Lopez-Izquierdo R, Velayos-Garcia P, Alvarez-Manzanares J, Ramos-Sanchez C, Carbajosa-Rodriguez V, et al. Usefulness of infection biomarkers for diagnosing bacteremia in patients with a sepsis code in the emergency department. Infez Med. 2020;28(1):29-36.
- Bilgili B, Haliloğlu M, Aslan MS, Sayan İ, Kasapoğlu US, Cinel İ. Diagnostic accuracy of procalcitonin for differentiating bacteraemic Gram-negative sepsis from Gram-positive sepsis. Turk J Anaesthesiol Reanim. 2018;46(1):38-43. [CrossRef]
- Brodská H, Malíčková K, Adámková V, Benáková H, Šťastná MM, Zima T. Significantly higher procalcitonin levels could differentiate Gram-negative sepsis from Gram-positive and fungal sepsis. Clin Exp Med. 2013;13(3):165-70. [CrossRef]
- Li S, Gu J, Nan W, et al. Procalcitonin and C-reactive protein predict infection in hematopoietic stem cell transplantation patients. Leuk Res. 2021;105:106574. [CrossRef]
- Ogasawara S, Saito N, Hirano R, Minakawa S, Kimura M, Kayaba H. Clinical relevance of procalcitonin values in bacteremia. J Infect Chemother. 2020;26(10):1048-53. [CrossRef]
- Leng Y, Chen C, Zhang Y, Luo C, Liu B. Ability of serum procalcitonin to distinguish focus of infection and pathogen types in patients with bloodstream infection. Ann Transl Med. 2019;7(7):135. [CrossRef]
- Lin JC, Chen ZH, Chen XD. Elevated serum procalcitonin predicts Gram-negative bloodstream infections in patients with burns. Burns. 2020;46(1):182-9. [CrossRef]
- Olmuşçelik O, Yılmaz M, Sevindik ÖG, et al. Can procalcitonin levels differentiate Gram-negative bacteremia from Gram-positive bacteremia? F Ü Med J Health Sci. 2019;33(2):83-7.
- Koizumi Y, Sakanashi D, Ohno T, et al. Plasma procalcitonin levels remain low at the onset of gram-positive bacteremia regardless of severity or the presence of shock: A retrospective analysis of patients with detailed clinical characteristics. J Microbiol Immunol Infect. 2021;54(6):1028-37. [CrossRef]
- Lai L, Lai Y, Wang H, et. al. Diagnostic accuracy of procalcitonin compared to C-reactive protein and interleukin 6 in recognizing Gram-negative bloodstream infection: A meta-analytic study. Dis Markers. 2020;2020:4873074. [CrossRef]
- Bassetti M, Russo A, Righi E, et al. Role of procalcitonin in predicting etiology in bacteremic patients: Report from a large single-center experience. J Infect Public Health. 2020;13(1):40-5. [CrossRef]