En Çok Okunanlar
Özet
Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu, kronik hepatit B(KHB)’nin özel konaklarda ve özel durumlarda yönetimine ilişkin uzlaşı raporunu güncelledi. İlgili literatür ve uluslararası kılavuzlar gözden geçirildi ve üzerinde anlaşmaya varılan tavsiyeler her bölümün sonunda sunuldu. Raporda, hepatit B virusu (HBV) ve insan immün yetmezlik virusu (HIV) koinfeksiyonunun tedavisi, HBV ve hepatit C virusu (HCV) koinfeksiyonunun yönetimi, şiddetli COVID-19 hastalarında KHB’nin yönetimi, nakil yapılmayan bağışıklığı baskılanmış hastalarda KHB, kompanse ve dekompanse sirozu olan hastalarda KHB tedavisi başta olmak üzere tüm özel grup hepatit B hastalarının takibi irdelendi.
HBV/HCV KOİNFEKSİYONUNUN YÖNETİMİ
Hepatit B virusu (HBV) ve hepatit C virusu (HCV), benzer bulaş yolları ile infeksiyona neden olmaktadır. Bu nedenle, HBV/HCV koinfeksiyonu seroprevalansının yüksek olduğu düşünülmektedir. Toplum temelli epidemiyolojik çalışmalar yapılmadığı için sıklığı tam olarak bilinmemekle birlikte, bölgelere göre %1 ile %15 arasında değişmektedir (1-4). Ülkemizde yapılan çalışmalarda, HBV/HCV koinfeksiyonu oranı %0.9 ile %4.3 arasında bildirilmiştir (5-8).
HBV/HCV koinfeksiyonunda; her iki virusun da baskın, HBV baskın, HCV baskın ya da her iki virusun da inaktif olma ihtimali bulunmakla birlikte en sık görülen formu HCV’nin baskın olduğu şeklidir. Yapılan in vitro çalışmalarda, HBV nükleusta, HCV ise sitoplazmada çoğaldığı için birbirleri ile etkileşim içerisinde olmadan, aynı hepatosit içerisinde çoğaldıkları gösterilmiştir. Fakat, hayvan modellerinde viral etkileşimin söz konusu olduğu ve nedeni tam olarak anlaşılamasa da birkaç farklı mekanizma ile HCV’nin HBV’yi baskıladığı gösterilmiştir. HCV’nin interferon salınımını ve mikroRNA (miRNA) sentezini artırırken, HBV DNA polimerazı baskılaması sonucu HBV’nin çoğalmasını engellediği düşünülmektedir (1,2,4).
HBV/HCV koinfeksiyonu; akut HBV/HCV koinfeksiyonu, HBV süperinfeksiyonu, HCV süperinfeksiyonu ya da okült HBV infeksiyonu klinik tablolarıyla karşımıza çıkabilmektedir. Bu durum, hastanın yaşı, immünite durumu ve bulaşma yoluna bağlıdır.
Akut HBV/HCV Koinfeksiyonu
Akut HBV/HCV koinfeksiyonu nadir görülen bir tablo olmakla birlikte sıklığı intravenöz ilaç kullananlarda, uygunsuz kan transfüzyonu ve steril olmayan koşullarda yapılan cerrahi girişimlerin varlığında artmaktadır. HBV/HCV koinfeksiyonunda, genellikle, viral etkileşim sonucu HCV tarafından HBV replikasyonu baskılanır. Hastalarda bifazik alanin aminotransferaz (ALT) yükseklikleri görülebilir. Kronikleşme ihtimali, monoinfekte hastalardaki gibiyken fülminan hepatit gelişme ihtimali artacağı için HBV açısından oral antiviral tedavi başlanması gerekebilmektedir. Akut koinfeksiyon sonrası her iki virusun ya da birinin spontan klirensinin olabileceği gösterilmiştir (3,9,10).
HCV Süperinfeksiyonu
HBsAg pozitif olduğu bilinen bir kişide yeni gelişen akut HCV infeksiyonu olarak tanımlanmaktadır. HCV süperinfeksiyonu, Asya, Güney Amerika ve Sahra Altı Afrika gibi HBV’nin endemik görüldüğü bölgelerde sıklıkla karşımıza çıkmaktadır. HCV süperinfeksiyonu sonucunda HBeAg serokonversiyonu ve/veya HBsAg serokonversiyonu görülebilmektedir. Bununla birlikte fülminan hepatit görülme ihtimali artmaktadır. Kronikleşen hastalarda ise siroz ve hepatoselüler kanser (HSK) görülme sıklığı artmaktadır (1,3,4,11).
HBV Süperinfeksiyonu
Kronik HCV infeksiyonu olduğu bilinen bir kişide yeni gelişen akut HBV infeksiyonu olarak tanımlanmaktadır. HCV süperinfeksiyonuna oranla daha az sıklıkta görülmektedir. Bununla birlikte, yapılan çalışmalarda HCV seroklirensine neden olabileceği bildirilmiştir. Aynı zamanda, HCV süperinfeksiyonundaki gibi fülminan hepatit gelişme riskinin arttığı bildirilmiştir (12,13).
Okült HBV İnfeksiyonu
HBsAg ’nin negatif olduğu durumlarda serumda ya da karaciğer dokusunda HBV DNA pozitifliği olarak tanımlanmaktadır. Kronik HCV infeksiyonu olan hastalarda okült hepatit B infeksiyonu sıklığı, %15 ile %33 arasında değişmekte olup HSK gelişen hastalarda bu oran %50’ye çıkmaktadır. Okült HBV infeksiyonu varlığında hem siroz hem de HSK gelişme ihtimali artmaktadır (14,15).
HBV/HCV koinfeksiyonu, asemptomatikten, fülminan hepatit tablosuna kadar farklı klinik tablolarla karşımıza çıkabilmektedir (1,3). Semptomatik akut hepatit kliniği ile gelen hastaların, mutlaka tüm viral hepatit nedenleri açısından tetkik edilmesi önerilmektedir. Kronik HCV infeksiyonu olan bütün hastalarda, HBsAg ve anti-HBc IgG bakılmalıdır. HBV’ye duyarlı olan hastaların mutlaka aşılanmaları sağlanmalıdır (16). Aynı zamanda, kronik HBV infeksiyonu nedeniyle takibe alınan hastaların HCV açısından tetkik edilmesi önerilmektedir. Bununla birlikte, HCV saptanmayıp riskli davranışları devam eden kronik hepatit B (KHB) tanılı hastaların dönem dönem HCV açısından tetkik edilmesi gerekmektedir. Takipte ALT yükseklikleri olan hastaların, HCV açısından tetkik edilmesi önerilmektedir (17-19).
Kronik HBV/HCV koinfeksiyonunda tedavi, monoinfekte hastalardaki gibidir. Öncelikle, baskın virusun hangisinin olduğu tespit edilmelidir. Çoğu zaman baskın virus HCV olduğu için tedavide doğrudan etkili antiviral (DEA)’ler kullanılır (17-19). Tedavi başarısı monoinfekte hastalardaki gibidir. Doğrudan etkili antiviraller ile tedavi edilen hastalarda, HBV reaktivasyonu riski bulunmaktadır. HBsAg pozitif olan kişilerde reaktivasyon riski yüksek iken, izole anti-HBc IgG pozitif olan kişilerde bu oran daha düşüktür. HBV reaktivasyonunun, özellikle DEA tedavisi esnasında ve tedavi sonrasındaki ilk 12 haftada görülme ihtimali yüksektir (20-23). Bu nedenle, HBsAg pozitif olan ve kronik HBV infeksiyonu açısından tedavi endikasyonu olmayan bütün kronik HCV infeksiyonu tanılı hastaların, DEA tedavisi süresince ve sonraki 12 hafta boyunca HBV için profilaksi alması önerilmektedir (18). İzole anti-HBc IgG pozitifliği olan kişilerde ise ALT yüksekliği olması durumunda, reaktivasyon açısından HBV DNA bakılmalıdır. HBV reaktivasyonu gelişmesi halinde nükleoz(t)id analoğu ile tedavi edilmesi önerilmektedir (18,19). HBV’nin baskın olduğu durumlar daha nadir olmakla birlikte, nükleoz(t)id analoğu ile tedavi edilen hastaların HCV reaktivasyonu açısından takip edilmesi, reaktivasyon varlığında DEA ile tedavi edilmesi önerilmektedir (24).
Öneriler
- HBV/HCV koinfeksiyonu, baskın virus belirlenerek monoinfekte hastalarda olduğu gibi tedavi edilmelidir.
- DEA tedavisi alacak ve HBsAg test sonucu pozitif olan tüm hastalara HBV için tedavi süresince ve tedavi sonrasında 12 hafta boyunca potent nükleoz(t)id analoğu ile profilaksi verilmelidir.
- DEA tedavisi alacak tüm HCV tanılı hastalarda HBsAg test sonucunun negatif olması durumunda anti-HBc IgG bakılmalıdır.
- Anti-HBc IgG pozitifliği saptanan HCV tanılı hastalarda okült hepatit B varlığı araştırılmalı ve hastalar reaktivasyon açısından yakından takip edilmelidir.
HIV/HBV KOİNFEKSİYONU YÖNETİMİ
Benzer bulaşma yolları nedeniyle, dünya genelinde insan immün yetmezlik virusu (HIV) ile yaşayan yaklaşık 38.5 milyon HIV pozitif bireyin %5-20’si HBV ile infekte durumdadır (25). Koinfeksiyon oranları, HBV infeksiyonu prevalansının düşük olduğu bölgelerde %5-14, prevalansın yüksek olduğu yerlerde %5-73 arasında değişmektedir. Koinfekte hastalarda, karaciğer kaynaklı morbidite ve mortalite monoinfekte bireylere göre daha fazladır (26).
Klinik Gidiş
HBV/HIV koinfekte bireylerde, HBV monoinfekte hastalara göre persistan viral replikasyon daha fazla olup siroza ilerleme riski, son dönem karaciğer hastalığı ve HSK daha fazla gözlenir (27).
Eşzamanlı HIV ve HBV Doğal Seyrinin Kliniğe Yansıması
HIV’in Etkisi
HIV tarafından CD4+ T hücrelerinin yok edilmesiyle bağışıklık sistemi zayıflar ve HBV infeksiyonunun doğal seyri de değişir. HBV bulaştıktan sonra KHB gelişme riski, HIV negatif bireylere oranla HIV pozitif bireylerde altı kat daha fazladır (28). Anti-HBs ve HBsAg kaybı ve/veya serokonversiyon oranları HIV/HBV koinfekte hastalarda HBV monoinfekte hastalardan daha yüksek olabilir. HIV virolojik başarısızlığı durumunda, okült hepatit B infeksiyonu, kronik HBV infeksiyonunun reaktivasyonu (ters serokonversiyon) ve fülminan hepatit gözlenebilir (29).
HBV’nin Etkisi
HBV ile kronik olarak infekte hastalarda bağışıklık sisteminin kalıcı inaktivasyonu, HIV viral replikasyonunda artışla sonuçlanır. Mekanizma net olarak bilinmemekle birlikte, HBV CD4+ T hücre düzeyini düşürmektedir. Çalışmalar, kazanılmış immün yetmezlik sendromu (AIDS)’na ilerleme ve/veya ölüm riskinin, koinfeksiyonda (HIV/HBV) HIV mono-infeksiyonuna göre 3-6 kat daha yüksek olduğunu göstermektedir (30).
HIV/HBV Koinfeksiyonu Olan Hastaların Değerlendirilmesi
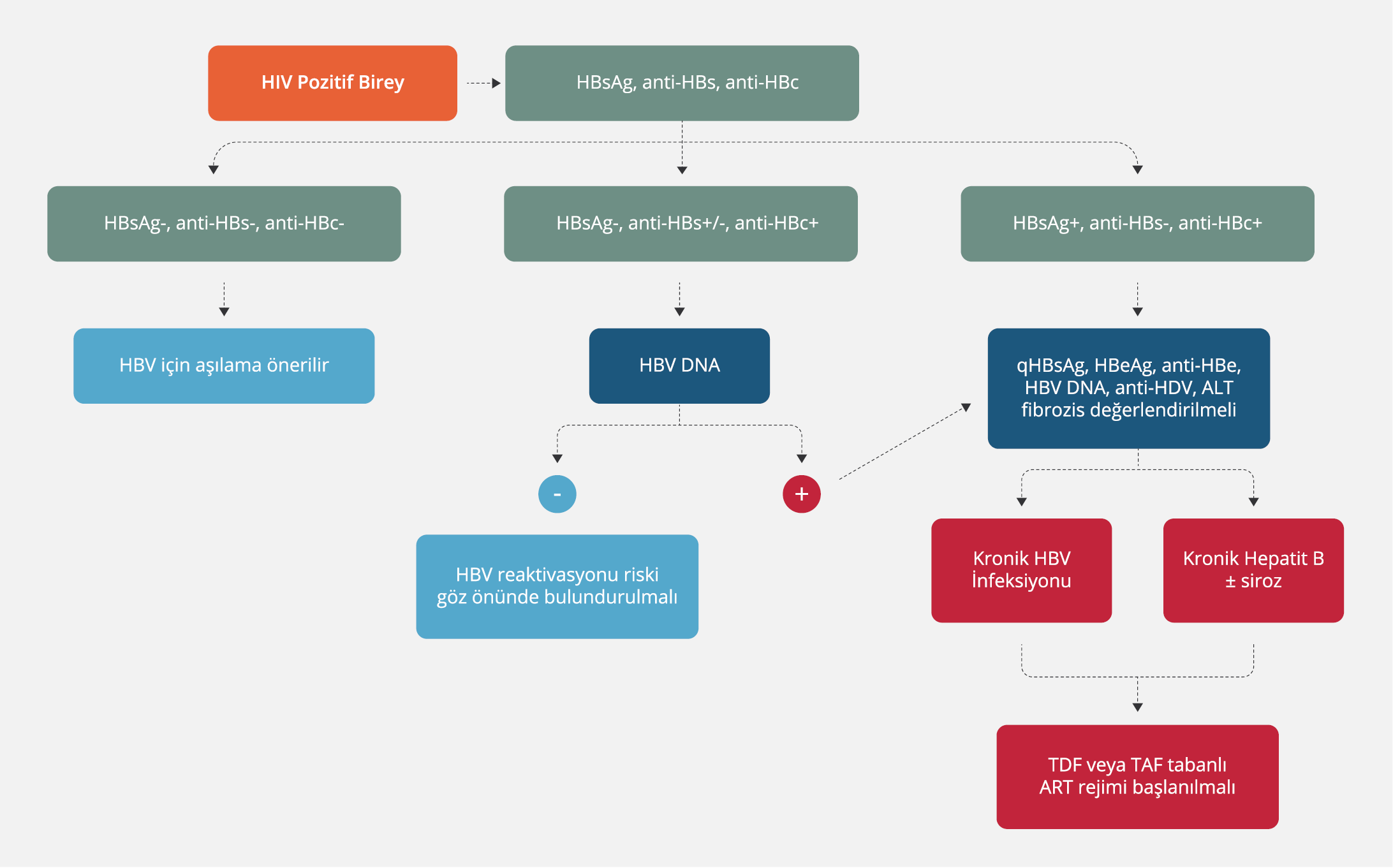
Bulaşma yolu aynı olduğu için HIV ile infekte olan tüm bireyler, HBV [HBsAg pozitifliği olan bireylerde hepatit Delta virusu (HDV), anti-HDV] ve HCV için test edilmelidir; bunun tersi de geçerlidir. Anti-HBs pozitifliği olan HIV pozitif hastalarda HBV serolojik testleri tekrarlanmalıdır. Anti-HBc, geçmişte HBV infeksiyonu geçirmiş olması nedeniyle HIV pozitif hastalarda da bulunabilir.
HBV/HIV koinfekte hastalara HSK taraması yapılması maksadıyla, her altı ayda bir karaciğer ultrasonografisi ve alfa-fetoprotein (AFP) serolojisi yapılmalıdır. HIV/HBV koinfeksiyonu olan durumu ciddi hastalarda da karaciğer biyopsisi gerekebilir. Bununla birlikte, serum fibrozun belirteçleri ve geçici elastografi gibi non-invazif ölçümler, biyopsi yapılmaksızın altta yatan fibrozun derecesini belirlemeye yardımcı olabilir (31,32).
Ayrıca KHB infeksiyonu olan bireyler hepatit A virusu (HAV) bağışıklığı (anti-HAV IgG) için test edilmelidir. HAV ile koinfeksiyon olması karaciğer hastalığı, dekompansasyon veya fülminan hepatite ilerlemeyi hızlandırabileceğinden, hasta duyarlı ise aşı önerilmelidir.
HIV/HBV Koinfeksiyonunda Tedavi ve İzlem
Tedavi İndikasyonu ve Tedavi Seçimi
HIV/HBV koinfeksiyonu olan tüm hastalar tenofovir intoleransı yoksa tenofovir disoproksil fumarat (TDF) veya 2016’da onaylanan bir tenofovir formülasyonu olan tenofovir alafenamid fumarat (TAF) içeren antiretroviral tedavi (ART) almalıdır. Hepatit B’ye etkili ART alan HIV/HBV koinfekte hastalarda hepatik alevlenme ve HBV reaktivasyonu sonrası dekompanzasyon riskinden dolayı tedavi kesilmesinden kaçınılmalıdır (33,34).
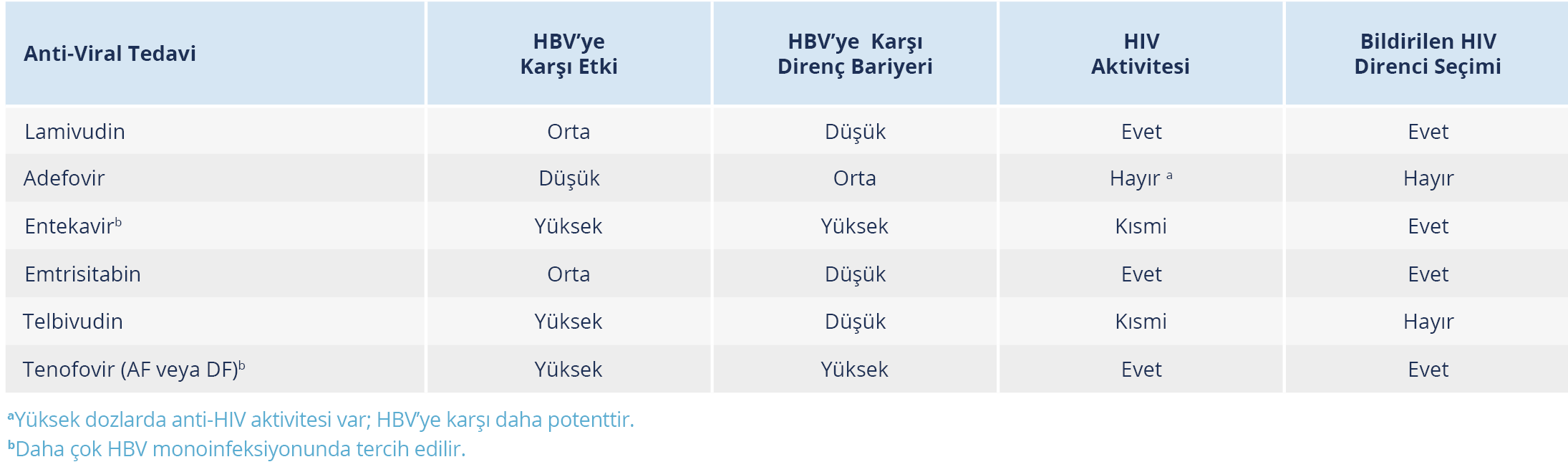
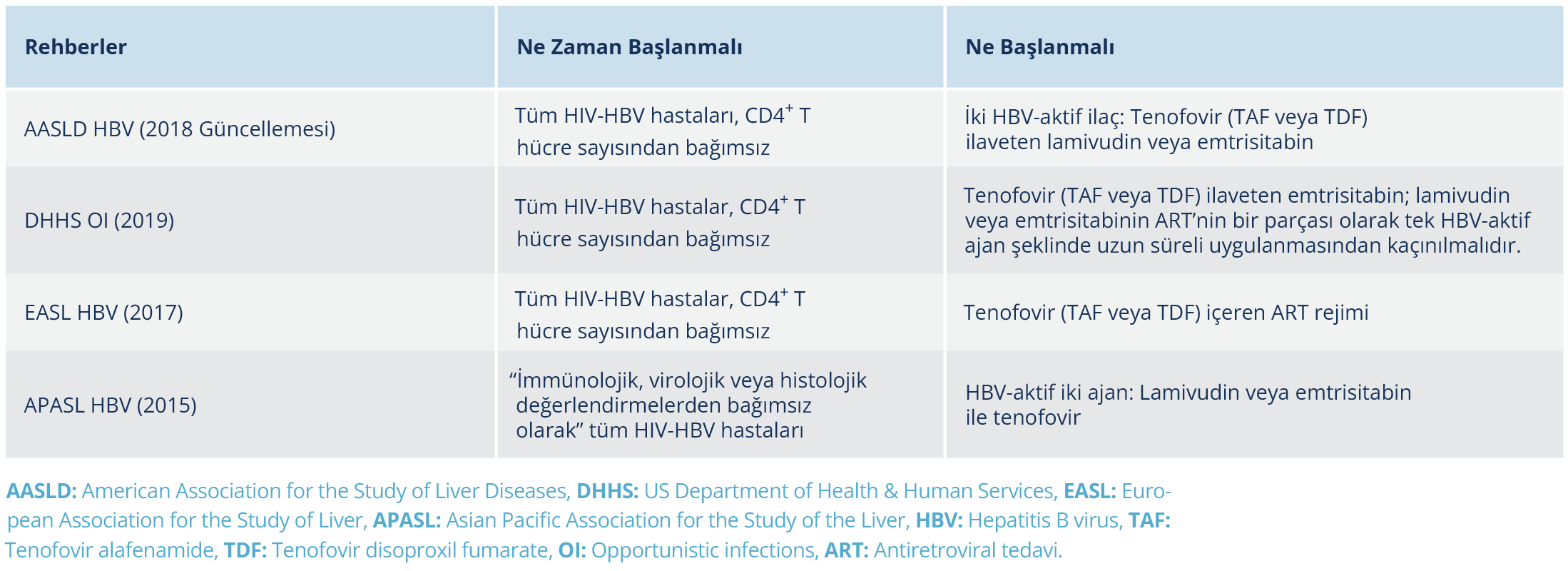
Tablo 1. Oral Nükleozid veya Nükleotid Analoglarının Hepatit B’ye Karşı Aktivitesi ile HIV’e Karşı Tam/Kısmi Aktiviteleri (15).
Tedavide amaç, serum HBV DNA düzeyini mevcut en duyarlı tanı yöntemleriyle saptanan düzeyin altında tutmaktır. HIV/HBV koinfeksiyonunda HBV tedavisi halen ömür boyu sürmektedir. Mevcut rehberler, hastalığın ilerleme riskini azaltmak için CD4+ T hücre sayısından bağımsız olarak HIV infeksiyonu olan tüm bireylerde kombine ART tedavisi düşünülmesi gerektiğini belirtmektedir. Bu öneri, CD4+ T hücre sayısından bağımsız, HIV/HBV koinfeksiyonu olan hastalarda karaciğer hastalığı progresyon hızının yüksek ve kombine HIV ve HBV aktivitesine sahip ilaçların mevcut olması nedeniyle özellikle önemlidir. Emtrisitabin (FTC), lamivudin (3TC), TDF ve TAF hem HIV hem de HBV’ye karşı etkili olup ART, tam süpresyon sağlayan nükleozid revers transkriptaz inhibitörleri (NRTI) ile TDF veya TAF’ın yer aldığı temel bir kombinasyonu içermelidir (33,34). HIV/HBV koinfekte hastalarda, HBV’ye karşı olan potensin ve genetik bariyerin yüksek olması nedeniyle TDF veya daha yeni bir formülasyon olan TAF, birinci basamak tedavi ajanı olarak kabul edilir (Tablo 1). Tenofovir preparatlarının büyük ölçüde hem HBV hem de HIV’e karşı ikili antiviral aktivitesi olması nedeniyle, HIV ve HBV koinfeksiyonu olan bireylerde temel antiviral olarak entekavire nazaran TDF veya TAF tercih edilir (33, 35). Mevcut tüm rehberler, HIV/HBV koinfeksiyonu olan tüm hastalarda TDF veya TAF’a ilaveten lamivudin veya FTC içeren kombine ART kullanılmasını önermektedir. Detay Tablo 2’de verilmiştir (19,36).
Herhangi bir nedenle HIV tedavisi yapılamıyorsa ve HBV için tedavi endikasyonu varsa anti-HIV etkisi olmayan bir ilaç seçilmelidir. Bu durumda pegile-interferon PEG-IFN ve adefovir tercih edilebilir. Her ne kadar önceleri entekavirin anti-HIV aktivitesi olmadığı düşünülse de kısmi aktivitesi olduğu ve antiretroviral direnç gelişimine yol açabileceği gösterilmiştir. Bu nedenle kombine ART tedavisinde entekavir kullanımından kaçınılmalıdır (37). Tenovir disoproksil fumarat ya da TAF kesin kontrendike ise daha önce lamivudin (3TC) almamış hastalarda tam etkin ART ile entekavir verilebilir.
Panel Önerileri (10,15)
Emtrisitabin, lamivudin (3TC), TDF ve TAF hem HIV hem de HBV’ye karşı aktivite gösterdiğinden, HIV/HBV koinfeksiyonunda TAF veya TDF’ye ilaveten tamamen baskılayıcı olan bir antiretroviral (ARV) rejiminin omurgası olarak NRTI (3TC veya FTC) verilmelidir (AI).
Tenovir disoproksil fumarat veya TAF güvenli bir şekilde kullanılamıyorsa, önerilen alternatif HBV tedavisi, tamamen baskılayıcı bir ART’ye (BI) ek olarak entekavir olmalıdır. Entekavir HIV’e karşı kısmen etkindir; koinfeksiyonu olan hastalarda ART olmadan HBV tedavisi için kullanılması, 3TC ve FTC’ye HIV direnci kazandıran M184V mutasyonunun seçilmesine neden olabilir. Bu nedenle entekavir, HIV/HBV-koinfeksiyonu (AII) olan hastalara verildiğinde, tamamen baskılayıcı bir ARV rejimine ek olarak kullanılmalıdır. Bazı hastalarda pegile-interferon alfa (PEG-IFN-α) monoterapisi de düşünülebilir (CII).
Tek başına ya da 3TC veya FTC’nin telbivudin ile kombinasyonu ile bile olsa HIV/HBV koinfeksiyonu olan hastalarda adefovir dahil diğer HBV tedavi rejimleri önerilmemektedir (CII).
Hepatit B virusuna etkili olan ajanların kesilmesi, HBV’nin reaktivasyonundan kaynaklanan ciddi hepatoselüler hasara neden olabilir; hastalara bu ilaçları kesmemeleri tavsiye edilmeli ve HBV tedavisine ara verildiğinde dikkatle izlenmelidir (AII).
HIV virolojik başarısızlığı nedeniyle ART’nin modifiye edilmesi gerekiyorsa ve hastada yeterli HBV baskılaması varsa, HIV baskılanmasını sağlamak için diğer uygun ARV ajanlar HBV’ye karşı da aktif olan ilaçları içerecek şekilde seçilerek tedavi sürdürülmelidir (AIII).
Önerilerin derecelendirilmesi;
A=Güçlü; B=Orta; C=Opsiyonel.
Kanıt derecelendirmesi;
I=Randomize kontrollü çalışmalardan elde edilen veriler; II=İyi tasarlanmış randomize olmayan çalışmalardan veya uzun vadeli klinik sonuçları olan gözlemsel kohort çalışmalarından elde edilen veriler; III=Uzman görüşü.
HIV/HBV Koinfeksiyonunda Önerilmeyen HBV İlaçları
Antiretroviral rejime adefovir ya da telbivudin eklenmesi durumunda, TDF, TAF veya entekavir içeren rejimlerle karşılaştırıldığında, HBV infeksiyonun tedavi başarısızlığının ve toksisite insidansının oranı daha yüksektir. Adefovir içeren rejimlerde böbrek hastalığı ve telbivudin içeren rejimlerde miyopati ve nöropati riski artar. Sonuç olarak; HIV/HBV koinfeksiyonu olan hastalar için adefovir veya telbivudin önerilmemektedir (19,36-38).
Antiretroviral Tedavi Değişikliği
HIV/HBV koinfekte bir hastada ART rejimi değiştirilse bile HBV aktif ARV ilaçlara devam edilmelidir (AII) veya spesifik anti-HBV ilaçlara başlanmalıdır.
HIV/HBV Koinfekte Hastalarda HBV’ye Karşı Etkili Antiretroviral İlaçların Kesilmesinin Gerekliliği
HIV/HBV koinfeksiyonu olan hastalarda, HBV aktif tedavinin kesilmesi önerilmez. Önerilen bir aktif HBV ilacına güvenlik endişesi nedeniyle devam edilemiyor ve HBV aktif tedavinin kesilmesi gerekiyorsa, karaciğer transaminazları ve total bilirubin için sık sık test yapılarak hastanın klinik seyri izlenmelidir. Bu durumda HBeAg pozitif hastalarda ve aktif HBV infeksiyonu olan hastalarda HBV alevlenme riski en yüksektir. Hiçbir anti-HBV ARV ilaç kullanılamıyorsa, özellikle kritik hepatik rezervi olan hastalarda, örneğin kompanse veya dekompanse sirozu olan hastalarda, alevlenmeleri önlemek için tam baskılayıcı bir ART rejimine ilaveten entekavir kullanımı düşünülebilir.
Siroz
Karaciğer sirozu olan CD4+ T sayısı düşük hastalarda, immün yeniden yapılanma sendromunu (immune reconstitution inflammatory syndrome – IRIS) ve ardından karaciğer enzimlerindeki alevlenmelere bağlı karaciğer dekompanzasyonunu gözden kaçırmamak için ART’ye başladıktan sonraki ilk aylarda dikkatli takip gerekir. Halihazırda HBV tedavisi alan kişilerde siroz teşhisinin zor olabileceği unutulmamalıdır.
Özellikle önceden lamivudin (3TC) ile tedavi edilmiş sirotik hastalarda TDF/TAF bazlı bir rejimden daha düşük genetik bariyeri olan ilaçlara (örn. FTC veya 3TC) geçişte, arşivlenmiş tirozin-metionin-aspartat-aspartat (YMDD) mutasyonu nedeniyle viral kırılma (breakthrough) olması muhtemeldir. Bu, daha önce lamivudin direnci olan ve TDF’den entekavir’e geçiş yapan HBV pozitif bireylerde tanımlanmıştır. Tenovir disoproksil fumarat ve TAF içermeyen bir rejimle ART tedavisine geçişten önce, HBV klinik ve laboratuvar parametreleri yeniden kontrol edilmelidir (19,36-38).
Tedavi Takibi
İlk yıl üç ayda bir, sonrasında 6-12 ayda bir karaciğer laboratuvar testleri yapılmalıdır. HBV DNA düzeyine, ilk yıl 3-6 ayda bir bakılmalıdır. Sonrasında 12 ayda bir HBsAg kaybolana kadar bakılması önerilir. Kantitatif HBsAg <1000 İÜ/ml olması HBsAg kaybına işaret eder (Tablo 3).
Öneriler
- HIV ile yaşayan bireylerde HBV ve/veya HCV ile koinfeksiyon gelişmesi karaciğer kaynaklı morbidite ve mortaliteleri artırmaktadır.
- Yeni tanı almış HIV ile yaşayan bir birey aynı zamanda HBV (HBsAg, anti-HBs, anti-HDV) ve HCV açısından taranmalıdır. Tersi bir durum da geçerlidir.
- HBV/HIV koinfekte bireylerde hem HBV’nin HIV’e hem de HIV’in HBV üzerine etkisinden dolayı monoinfekte hastalara göre persistan viral replikasyon daha fazla görülmektedir; siroza ilerleme riski, son dönem karaciğer hastalığı ve HSK riski de artmaktadır.
- HBV/HIV koinfekte bireylerin yönetiminde TAF veya TDF’ye ilaveten tamamen baskılayıcı bir ART rejiminin omurgası olarak NRTI (3TC veya FTC) verilmelidir. Tenofovir disoproksil fumarat veya TAF güvenli bir şekilde kullanılamıyorsa, önerilen alternatif HBV tedavisi, tamamen baskılayıcı bir ART rejimine ek olarak entekavir olmalıdır.
- HBV/HIV koinfekte hastalar yakından takip edilmeli ve verilecek her yeni ilaçta ilaç etkileşimleri dikkate alınmalıdır.
AĞIR COVID-19 GEÇİREN HASTALARDA KRONİK HBV YÖNETİMİ
HBV infeksiyonu, önemli morbidite ve mortaliteye sebep olan bir halk sağlığı sorunudur. Yüzyılın başından bu yana viral hepatite bağlı ölümler yaklaşık olarak %22 oranında artmıştır. Kronik HBV infeksiyonu tanı ve tedavisinde sorunlar yaşanması durumunda bu oranların artması beklenmektedir. Küresel olarak hepatit B virusunun, siroz ve hepatoselüler karsinom gibi komplikasyonlardan kaynaklanan yaklaşık 800 000 ölümden sorumlu olduğu tahmin edilmektedir (39,40). Şiddetli akut solunum yolu sendromu virusu-2 (SARS-CoV-2)’nin neden olduğu koronavirus hastalığı 2019 (COVID-19), neredeyse tüm bireyleri farklı biçimlerde etkileyen ve bazı hasta gruplarında ağır ve ölümcül seyredebilen bir infeksiyon hastalığıdır. Dünya Sağlık Örgütü (DSÖ) tarafından 11 Mart 2020 tarihinde pandemi ilan edilmesinden bu yana üç yıldan fazla bir zaman geçmiş olmasına rağmen hastalığın etkileri halen devam etmektedir (41).
COVID-19 tüm dünyada, özellikle kronik hastalıkları olan bireyleri daha çok etkilemekte ve hem kronik hastalıkların hem de COVID-19’un yönetimi açısından ciddi sorunlar yaratmaktadır (42). Belirli sağlık sorunları olan hastalarda, 65 yaş üstü bireylerde, huzurevinde veya uzun süreli bakım tesislerinde yaşayanlarda COVID-19’un seyri daha şiddetli olabilmektedir. Obezite, uzun süredir devam eden ciddi karaciğer, böbrek, kalp ve akciğer hastalıkları olanlarda ağır COVID-19 geçirme riski yüksektir. Ayrıca sirozlu hastalar, organ nakli alıcıları ve immünosüpresif ilaçları kullanan bireylerde de COVID-19 nedeniyle ciddi hastalık geçirme riskinin yüksek olduğu bildirilmiştir (43).
COVID-19 hastalığında ana tutulum yeri solunum yolları ve akciğer olmakla birlikte, neredeyse tüm organ ve sistemleri farklı derecede etkilemektedir. Olguların yarısından fazlasında diğer organ ve sistemlere ait belirtiler, özellikle de karaciğer tutulumları izlenmektedir. Hastalarda gastrointestinal sistem ve karaciğer tutulumuna ait klinik ve laboratuvar bulguları sıklıkla bildirilmektedir. Bununla beraber; COVID-19’un ağır seyri ve bozulmuş karaciğer belirteçleri arasındaki ilişkiyi açıklamada, virusun indüklediği sitotoksik T hücreler ve bozulmuş doğal immün cevaptan kaynaklı kollateral karaciğer hasarı oluşturması daha olası görünmektedir. Yapılan çalışmalarda hastaların yarıya yakınında ishal, bulantı, kusma ve karın ağrısı gibi belirtilerin olduğu tespit edilmiştir. Bu belirti ve bulgular COVID-19 nedeniyle tedavi gören hastalarda kısmen kullanılan ilaçlara da bağlı olabilir. Ancak COVID-19 hastalığının etkeni olan SARS-CoV-2 virusunun hücre içine girişinde “angiotensin-converting enzyme” 2 (ACE 2) reseptör proteini önemli rol oynamaktadır. Solunum yolları ve akciğer dışında ACE 2 reseptörlerinin en çok bulunduğu yerler arasında bağırsak, karaciğer ve safra yolları yer almaktadır. Dolayısıyla COVID-19 hastalığının sindirim sistemi ve karaciğer ile ilgili şikayetlere ve klinik bulgulara sebep olması beklenen bir durumdur. Ayrıca COVID-19 hastalarının %20-50’sinin dışkısında SARS-CoV-2 PCR testinin pozitif olduğu ve bazı olgularda virusun 30 güne kadar dışkıda saptanabildiği belirtilmiştir (44-46).
Yapılan çalışmalarda, COVID-19 hastalarındaki hepatobiliyer patolojilerin ve karaciğer histolojisindeki değişikliklerin olası nedenleri aşağıda verildiği şekilde özetlenebilir (47-51):
- Hepatik hücrelerde SARS-CoV-2’nin aktif replikasyonu ve direkt sitopatik etkisi,
- COVID-19 infeksiyonuna bağlı gelişen komplikasyonlar veya tedavileri,
- Virusun neden olduğu ağır inflamasyona bağlı değişiklikler, sepsis, septik şok, hipoksik hasar ve/veya ventilatör komplikasyonları,
- Hiperinflamatuar sitokin fırtınasına yol açan IL-1, IL-6, tümör nekroz faktörü (TNF) gibi artan inflamatuar sitokinlerin etkisiyle karakterize hipoksiye duyarlı hepatosit hasarı,
- COVID-19’lu hastalarda kullanılan ilaçlar (antibiyotikler, antiviraller veya destek amaçlı kullanılan diğer ilaçlar),
- COVID-19 infeksiyonuna bağlı, AST düzeyinin baskın olduğu yaygın hipoksik-iskemik karaciğer hasarı,
- Daha önce tanı konulmamış altta yatan karaciğer hastalıkları [HAV, HBV, HCV, hepatit E virusu (HEV), alkole bağlı karaciğer hastalığı, yağlı karaciğer hastalığı, otoimmün karaciğer hastalığı, vb.]
COVID-19 ve karaciğer hasarının değerlendirildiği bir sistematik derleme ve meta-analizde 527 makale incelenmiş olup kriterlere uyan 27 araştırmanın sonuçları kapsamında 2900 ağır, 7184 ağır olmayan COVID-19 hastası olmak üzere toplam 10 084 hasta irdelenmiştir. Çalışmada, transaminazların normal üst limitin üç katından yüksek olması karaciğer hasarı kriteri olarak kabul edilmiştir. COVID-19 hastalarında karaciğer hasarı prevalansının beklenenden daha yüksek olduğu, hasarın boyutu ile hastalığın ciddiyeti arasında ilişki olduğu ve hepatik hasarın virus, ilaçlar veya her ikisinden kaynaklanabileceği belirtilmiştir (52).
COVID-19’un karaciğeri nasıl etkilediğine ve önceden var olan karaciğer hastalıklarının COVID-19’un klinik seyrini nasıl etkileyebileceğine odaklanan birçok çalışma yayımlanmıştır. Pek çok husus tam olarak anlaşılamamış olmakla birlikte önceden herhangi bir karaciğer hastalığı olan COVID-19 hastalarının hastalık seyri sırasında karaciğer hasarının akılda tutulması gerektiği özellikle vurgulanmaktadır. Gerek COVID-19 gerekse kronik HBV infeksiyonu olan hastalarda kür sağlayacak tedaviler henüz geliştirilmiş değildir. Bu nedenle pandemi sürecinde COVID-19’lu hastalarda, ek kronik hastalıkların tanı ve tedavilerinin ertelenmesi, özel bir durum olmadığı sürece çok rasyonel bir yaklaşım gibi görünmemektedir (53).
COVID-19’un karaciğer hastalığı olan hastaların bakımına etkisi ile ilgili olarak Avrupa Karaciğer Araştırmaları Derneği (European Association for the Study of the Liver – EASL) ve Avrupa Klinik Mikrobiyoloji ve Bulaşıcı Hastalıklar Derneği (European Society of Clinical Microbiology and Infectious Diseases – ESCMID) tarafından yayınlanan raporlarda da viral hepatitler için başlanan tedavilerin devamı önerilmektedir. Ayrıca bu hastaların takibinde tele-tıp uygulamalarının ve yerel laboratuvar testlerinin kullanılması önerilmektedir (54).
Öneriler
- Halihazırda başlanmış olan antiviral tedavilere mutlaka devam edilmesi,
- Antiviral tedavi alanlarda takip için tele-tıp ve yerel laboratuvar testlerinin kullanılması, takip reçetelerinin postayla gönderilmesi, ancak ilaç uyumu zayıf olan hastalarda doğrudan gözetimli tedavi protokollerinin düşünülmesi,
- Pandemi sırasında COVID-19 olmayan hastalarda HBV ve HCV infeksiyonu tedavilerinin genel kılavuzlara göre başlatılması,
- Şiddetli akut HBV infeksiyonu için yüksek hastalık aktivitesi (alevlenme) olan veya klinik şüphe bulunan COVID-19 hastalarında olgu bazında antiviral tedaviye başlama kararı verilmesi,
- IFN-α’nın COVID-19 ile ilişkili sistemik inflamasyon üzerindeki bilinmeyen etkisi göz önüne alındığında, COVID-19 pandemisi sırasında HBV infeksiyonu olan hastalar için tedaviye başlarken alternatif ajanların düşünülmesi,
- Kortikosteroidler, tosilizumab veya diğer immünosüpresif ajanlar ile tedavi edilen kronik, okült hepatit veya doğal bağışıklığı olan hastalarda viral alevlenmeyi veya reaktivasyonu önlemek için yakın takip ve/veya antiviral tedavi açısından olgu bazlı değerlendirme yapılması,
- Hizmetlerin güvenli bir şekilde sunulması için, bakım basamaklarının pandemi durumuna ve yerel gereksinimlere göre düzenlenmesinin yanı sıra DSÖ’nün 2030 viral hepatit eliminasyon hedefleri doğrultusunda çalışmaya devam edilmesi önerilmektedir.
GEBELİK VE EMZİRME DÖNEMİNDE KRONİK HEPATİT B TEDAVİSİ
Hepatit B infeksiyonu aşıyla engellenebilir olmasına karşın, tüm dünyadaki en yaygın ve ciddi sağlık sorunlarının başında gelmektedir. HBV; kontamine kan ürünü, korunmasız cinsel ilişki veya perinatal yolla bulaşabilir. Özellikle hepatit B infeksiyonunun endemik olduğu bölgelerde en önemli bulaşma yollarından biri anneden bebeğe bulaşmadır. Erişkinlerde infeksiyonun kronikleşme oranı %5-10 iken, perinatal kazanılmış infeksiyonun kronikleşme oranı %95’lere kadar çıkmaktadır (55). Bu nedenle tüm gebelerde HBsAg pozitifliğinin taranması ve sonucun negatif olduğu riskli gebeliklerde doğuma yakın dönemde serolojisinin tekrar değerlendirilmesi önerilmektedir. Serolojisi negatif olan yüksek riskli gebelere hepatit B aşısı yapılması önerilir (56,57).
Gebeliğin Kronik Hepatit B’nin Doğal Seyri Üzerindeki Etkisi
KHB infeksiyonu olan ve ilerlemiş karaciğer hastalığı olmayan kadınlarda gebelik genellikle iyi tolere edilir. Bununla birlikte, gebelik immün toleranslı bir durum olarak kabul edilir ve immün yanıtı modüle edebilen yüksek seviyelerde adrenal kortikosteroidlerle ilişkilidir. Bu nedenle, KHB tanılı gebe kadınlarda ALT enzimlerinde 2 veya daha fazla kat artışlarla seyreden hepatik alevlenmeler veya karaciğer hastalığının ilerlemesi gibi farklı klinik tablolar görülebilir (58,59).
Kronik Hepatit B’nin Gebelik Sonuçları Üzerindeki Etkisi
KHB tanılı anneler için, HBV infeksiyonunun yenidoğanlar üzerindeki etkisi iyi tanımlanmamıştır ve veriler çelişkilidir. Çalışmaların bazılarında; yenidoğanda düşük doğum ağırlığı, prematüre doğum, neonatal sarılık, konjenital anomaliler veya perinatal mortalitede hiçbir fark görülmezken (58), diğer çalışmalarda, KHB ile gestasyonel diabetes mellitus (DM) (59), artmış erken doğum riski (60), düşük doğum ağırlığı (61) ve antepartum kanama arasında olası ilişkiler bulunmuştur. Dolayısıyla bazı gebeler karaciğer hastalığının ilerlemesini önlemek için antiviral tedaviye ihtiyaç duyarken (örneğin immün aktif hepatiti olanlar) diğerlerinin sadece gözlemle takibi yapılabilir.
HBsAg pozitifliği olan gebede HBV’nin fetusa geçişinin doğum sırasında olabileceği beklenmekle birlikte, annenin HBV yükünün artması sonucu prenatal dönemde de bebeğe bulaşma gerçekleşebilir. Annenin viral yükünün yüksekliği bulaşma riskini artırabilmektedir (19).
HBsAg Pozitifliği Saptanan Gebeye Yaklaşım
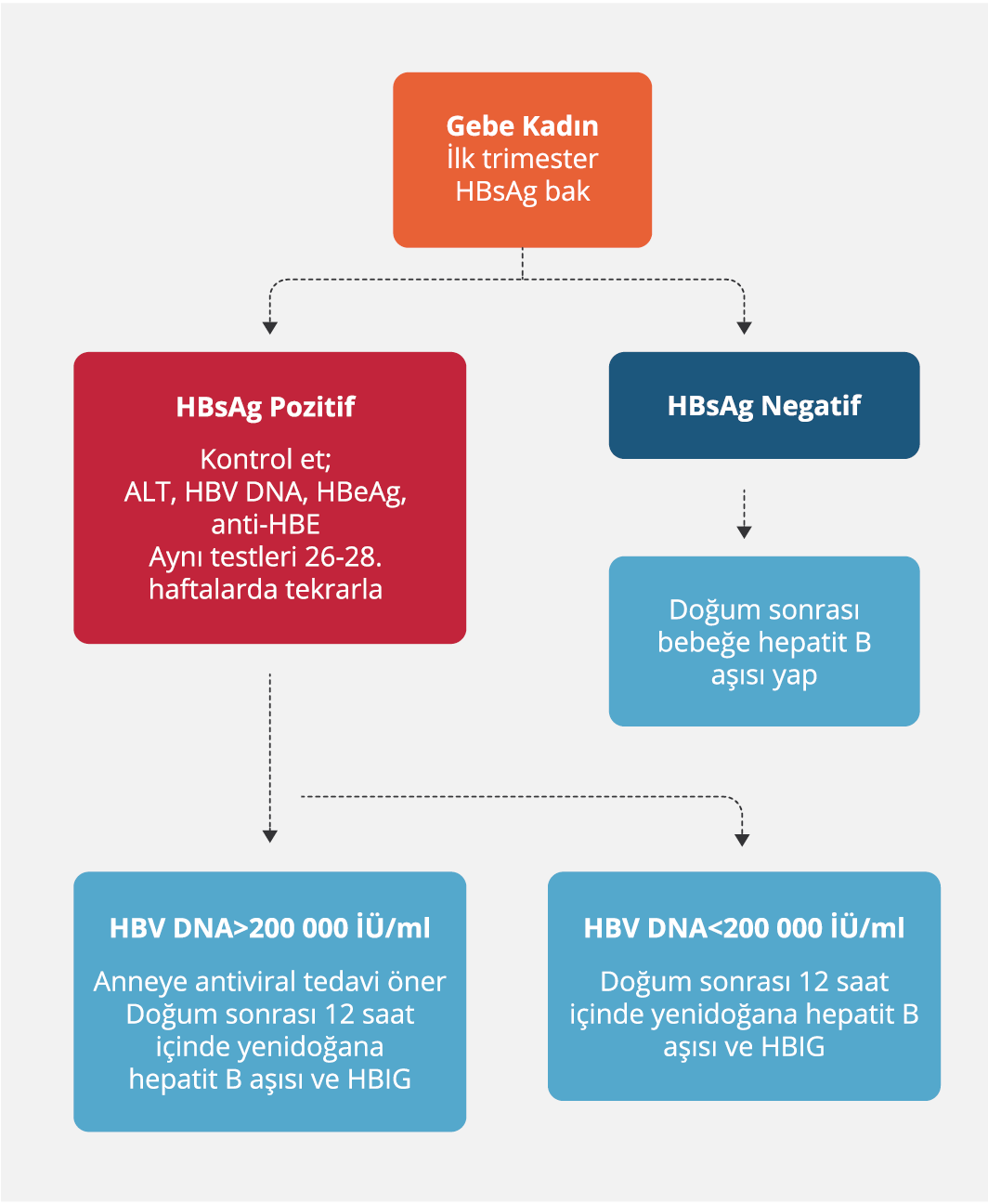
İlk başvuruda gebenin HBsAg testi pozitif olarak sonuçlanmışsa, HBeAg, anti-HBe, HBV DNA, serum ALT düzeyleri de tespit edilmeli ve hastalığın şiddeti, diğer viral hastalıkların varlığı gibi ek sağlık durumları bilinmelidir. KHB infeksiyonu olan gebede serum HBV DNA ve ALT düzeyleri üç ayda bir ve üçüncü trimesterin sonuna doğru bakılmalıdır (62).
Gebelerde antiviral tedavi endikasyonları genellikle gebe olmayan hastalarla aynıdır (63). Gebelik sırasında ALT’si normalin üst sınırının iki katından fazla olup HBV DNA düzeyi yüksek ve/veya önemli hepatik fibrozu (METAVIR skoru ≥F2) tespit edilenlere (ilk trimesterde bile) (HBeAg-pozitif hastalarda HBV DNA>20 000 İÜ/ml veya HBeAg-negatif hastalarda HBV DNA düzeyi ≥2000 İÜ/ml) antiviral tedavi önerilir (63). Ancak, antiviral tedavinin riskleri ve yararları gebe ile tartışıldıktan sonra tedavi kararı alınmalıdır. Bu durumda uzun süreli tedavi gerektiğinden direnç riskinin en düşük olduğu ve gebelikte kullanımı güvenli olan ajanlarla tedavi tercih edilmelidir (63,64). Gebe kadın, tedavi eşiğinin hemen üzerindeki aminotransferaz seviyeleri gibi hafif hastalık aktivitesine dair kanıtlar varsa, tedaviyi doğum sonrasına ertelemeyi seçebilir. Aksine, viral yükü >2 x 105 İÜ/ml olan bir gebede, aminotransferaz seviyeleri normal olsa bile üçüncü trimesterde tedaviye başlanmalıdır (64). Bu durumda tedavinin amacı çocuğa bulaşmayı önlemektir.
Tedavisiz İzlenen Kronik Hepatit B İnfeksiyonlu Gebeler
Karaciğer hastalığında progresyonu belirleyebilmek ve tedavi ihtiyacını ortaya koyabilmek için gebelik sırasında karaciğer fonksiyon testleri ve HBV DNA düzeyleri izlenmelidir (65). Üç ay aralıkla ve hepatik alevlenmeler açısından doğumdan sonra altı aya kadar ALT düzeyleri test edilmelidir.
KHB infeksiyonlu gebeden bebeğe HBV geçişini önlemek esastır. Doğumdan sonraki 12 saat içerisinde bebeğe hepatit B hiperimmünoglobulin (HBIG) ile hepatit B aşısının uygulanması ile bulaş %95’lere kadar önlenebilir. HBV aşısı üç doza tamamlanmalıdır (0- 1 ve 6. aylar). HBV aşıları ve HBIG’in çok önemli koruyucu etkisine rağmen anneden bebeğe %5-10 oranında bulaşma görülebilmektedir. Doğum sırasında annenin viral yükünün yüksek olması, aşıdan kaçan mutant suşlar ve intrauterin infeksiyon varlığı bebeğe bulaşmayı artıran risk faktörlerindendir. Yapılan çalışmalarda olası intrauterin bulaşmanın 28. haftadan itibaren başladığı gösterilmiştir. Ayrıca bu dönem ilaç tedavisinin fetüse yan etkisinin en az olduğu dönemdir. Bu dönemde HBsAg pozitifliği olan ve viral yükü yüksek gebelere üçüncü trimesterde oral antiviral tedavi başlanması alevlenmeyi önlemede yararlı bulunmuş ve antiviral tedavinin neonatal HBV bulaşmasını azalttığı sonucuna varılmıştır (65).
Avrupa Karaciğer Araştırmaları Derneği (EASL), gebede 24. ve 28. haftalar arasında bakılan HBV DNA düzeyi> 2×105 İÜ/ml veya >106 kopya/ml) ise antiviral profilaksi başlanmasını önermektedir (63). Amerikan Karaciğer Hastalıkları Araştırmaları Derneği (American Association for the Study of Liver Diseases – AASLD)’nin 2018 rehberinde benzer ölçütleri taşıyanlarda gebeliğin 28. ve 32. haftalarında antiviral profilaksinin tercihen TDF ile başlanması önerilmiştir (19).
Gebelik sırasında antiviral ajanların güvenliğine ilişkin farklı çalışmalar yapılmıştır (63,64). Belirli nükleoz(t)idler güvenli görünmekle birlikte HBV ajanlarının hiçbirini ele alan büyük çalışmalar olmadığı için ABD Gıda ve İlaç İdaresi (U.S. Food and Drug Administration – FDA) tarafından gebelikte kullanımları onaylanmamıştır. Gebelikte HBV monoinfekte kadınlarda antiviral tedavinin güvenliğine ait verilerin çoğu, HIV ve HBV koinfekte hastalarda kombinasyon antiviral rejimlerin kullanılmasıyla elde edilmiştir. Bu ilaçlardan lamivudin ve TDF’nin kullanımları etkin ve güvenli bulunmuştur. Doğumdan sonra antiviral tedavi kesilirse hastalar alevlenme açısından izlenmelidir (64).
Antiviral Tedavi Alırken Hamile Kalan Hastalar
Kadınlar antiviral tedavi alırken hamile kalırlarsa derhal klinisyenlerine haber vermeli ve tedaviye devam etmenin riskleri ve yararları tartışılmalıdır. Tedaviye devam edilmesi fetüs için risk oluşturabilirken tedavinin kesilmesi anne için hepatit alevlenmesi riski oluşturabilir.
Hasta terapötik bir son noktaya ulaştıysa, sirozu olmayan gebelerde tedavinin kesilmesi düşünülebilir. Aksi takdirde, entekavir, adefovir, interferon veya TAF alan gebeler, daha fazla güvenlik verisi bulunan TDF gibi alternatif bir ajana geçerek tedaviye devam edebilir. Söz konusu gebeler, viral baskılamayı sağlamak için geçiş döneminde yakından izlenmelidir (64).
Sirozu olan Gebede Yönetim
İleri derecede fibroz ve sirozu olan kadınlarda gebelik öncesinde tedavi önerilir. Gebede siroz tedavisi gebe olmayan hastalardan farklı değildir (63). Endoskopi ile varis taraması hala tavsiye edilir ve hamilelik sırasında güvenlidir. Aktif varis kanaması bantlama ile aynı şekilde yönetilmelidir. Profilaktik veya postvarisiyel kanama yönetimi için beta bloker kullanımı endikasyonları hamile olmayan bireylerdeki ile aynıdır; ancak beta bloker kullanımı intrauterin gelişme geriliği, fetal/neonatal
bradikardi ve/veya neonatal hipoglisemi riskinde küçük bir artış ile ilişkilidir. Uterin iskemi riski nedeniyle akut varis kanamasının tedavisi sırasında oktreotid verilmemelidir (63).
Emzirme Dönemindeki Kadınlarda Yönetim
Doğumda HBIG ve ilk doz hepatit B aşısı yapılmış bebekler emzirilebilir. KHB infeksiyonlu emziren anneler çatlak meme uçlarından kanamayı önlemek için özen göstermelidir. Taşıyıcı anneler anne sütü bağışına katılmamalıdır.
İlaç etiketlerinde, anne sütüne geçtikleri için emzirme sırasında nükleozid analoglarından kaçınılması önerilmektedir. Bununla birlikte, TDF alan kadınlar arasında yalnızca düşük tenofovir seviyeleri tespit edilmiştir (66). Yine KHB infeksiyonu olan annelerden doğan bebeklerin olgu raporları irdelendiğinde anneleri TDF alırken emzirilen bebeklerde kısa süreli yan etki bulunmamıştır (67).
Öneriler
-
Önceki testlerden veya aşılamadan bağımsız olarak gebelikte herkese HBV’ye yönelik tarama yapılmalıdır.
- Tüm HBsAg -pozitif gebelerin ev içi temaslıları, varsa diğer çocukları ve cinsel partnerleri taranmalıdır.
- Doğum öncesi HBsAg -pozitif ve özellikle viral yükü yüksek olan gebeler, potansiyel bulaşma riski ve tedavi gereksinimleri açısından yakın takip edilmelidir.
- Tüm HBsAg-pozitif gebeler HBeAg ve anti-HBe için test edilmelidir; üçüncü trimesterde HBV DNA düzeyi >2×105 İÜ /ml olan gebelere antiviral tedavi önerilmelidir (Şekil 1).
- Antiviral tedaviye aday olan gebelerde TDF uygun bir ajandır.
- HBsAg-pozitif kadınlardan doğan bebeklere doğumdan sonra ilk 12 saat içinde hepatit B aşısı ile HBIG aynı anda uygulanmalıdır.
HEMODİYALİZ HASTALARINDA KRONİK HEPATİT B TEDAVİSİ
KHB, özellikle kronik böbrek yetmezliği (KBY) hastalarında tanısı ve tedavisi zor bir klinik süreçtir. Kronik böbrek yetmezliği hastalarında; böbrek yetmezliğinin immünosüpresif etkisinin, çok sayıda ilaç kullanılmasının, nozokomiyal bulaşmaya yatkınlığın, renal transplantasyon sonrası verilen immünosüpresif tedavilerin ve KHB’ye bağlı karaciğer hastalığının klinik seyrindeki değişimlerin morbidite ve mortalite üzerinde sıklıkla karşımıza çıkan uzun dönem etkileri vardır ve bunlar hastaların yönetimini etkiler (68). Günümüzde KHB’li KBY hastalarında antiviral tedavi kullanılmasıyla ilgili veriler, bu hastaların kontrollü randomize çalışmalara dahil edilmemeleri nedeniyle kısıtlıdır. KHB’de tedavi seçeneklerinden biri olan interferonlar (IFN), KBY hastaları tarafından iyi tolere edilememiş, nispeten düşük etkinlik göstermiş ve renal transplant alıcılarını akut rejeksiyon riskine sokmuşlardır. Etkili nükleoz(t)id analoglarının ortaya çıkışı, KBY olan KHB hastalarında siroz ve HSK riskini azaltma fırsatı sunmuştur. Yeni nükleoz(t)id analogları arasında entekavir, yüksek etki gücü, dirence karşı yüksek genetik bariyeri ve olumlu renal güvenlik profili nedeniyle tercih edilebilir, ancak lamivudin veya telbivudin direnci varlığında düşük etkinlik gösterdiği için tenofovir temelli tedaviler bu olgularda daha iyi bir seçenek olabilir. Tüm hepatit B yüzey antijeni (HBsAg) pozitif adaylar, HBV DNA negatifliğini korumak, karaciğer fibrozunu azaltmak ve böbrek naklinden sonra hepatik dekompansasyonu önlemek için böbrek naklinden önce nükleoz(t)id analogları ile tedavi edilmelidir (18,19).
Genel Tedavi Prensipleri
Kronik böbrek yetmezliği hastalarında böbrek fonksiyonları normal hastalara göre KHB tedavisi karmaşıktır. Hastaların klinik durumlarının ve böbrek fonksiyonlarının takibi multidisipliner bir yaklaşımla yürütülmelidir. Bu hasta grubunda tedaviye rehberlik edecek veriler oldukça sınırlıdır. HBsAg pozitifliği olan ve aminotransferazlar ile serum HBV DNA düzeylerine göre aktif karaciğer hastalığı kanıtı bulunan hastalarda karaciğer biyopsisi şartı olmaksızın antiviral tedavi endikedir. Tedaviye başlamak için serum HBV DNA eşik değeri 2000-20 000 İÜ/ml şeklinde önerilmekle birlikte hemodiyaliz hastalarında HBV DNA ve aminotransferazlar için normalin üst sınırının düşürülmesi gerekliliği tartışılmaktadır (69,70).
Antiviral tedavi seçenekleri arasında IFN-α (standart veya pegile), nükleozid analogları (lamivudin, telbivudin ve entekavir) ve nükleotid analogları (adefovir dipivoksil, TDF ve TAF) bulunmaktadır (2,3). Kronik böbrek yetmezliği olan hastalarda IFN’nin rolü kontrollü çalışmalarla araştırılmamış olmakla birlikte bazı olgu raporlarında IFN-α’nın renal transplant alıcılarında iyi tolere edilemediği, etkinliğinin düşük olduğu ve akut rejeksiyon riskini artırdıkları bildirilmiştir. Son yıllarda, etkili, iyi tolere edilen ve nispeten güvenli oral antiviral ajanların geliştirilmesi, KBY hastaları da dahil olmak üzere çeşitli hasta alt gruplarında KHB’nin başarılı bir şekilde tedavisine olanak sağlamıştır (18,71). İlk oral anti-HBV ilaç olan lamivudin, hemodiyalize giren HBV ile ilişkili böbrek hastalığı olan bireylerde ve HBV pozitif transplant alıcılarında KHB tedavisi için uzun yıllar kullanılmıştır (68,69,72). Bununla birlikte, uzun süreli tedavilerdeki yüksek direnç ve düşük tedavi yanıt oranları nedeniyle ilk tercih edilen ilaçlardan değildir (68,69,73).
İdeal antiviral tedavi, HBsAg serokonversiyonu ve HBV DNA klirensini öngörmekle birlikte KBY hastalarında ve özellikle renal transplant adaylarında asıl hedef viral replikasyonun baskılanması ve bunun sonucunda siroz ve HSK gibi komplikasyonların önlenmesi, proteinürinin remisyonu ile böbrek fonksiyonlarının korunmasıdır.
Kronik Böbrek Yetmezliği Hastalarında Kronik Hepatit B Tedavisi
KHB hastaları için tedavi endikasyonları tipik olarak HBV DNA ve transaminaz düzeylerinin yanı sıra siroz dâhil karaciğer hasarının varlığına bağlıdır. Genel olarak KHB tedavi endikasyonları renal yetmezliği olanlar ve olmayanlar için aynıdır (18,19).
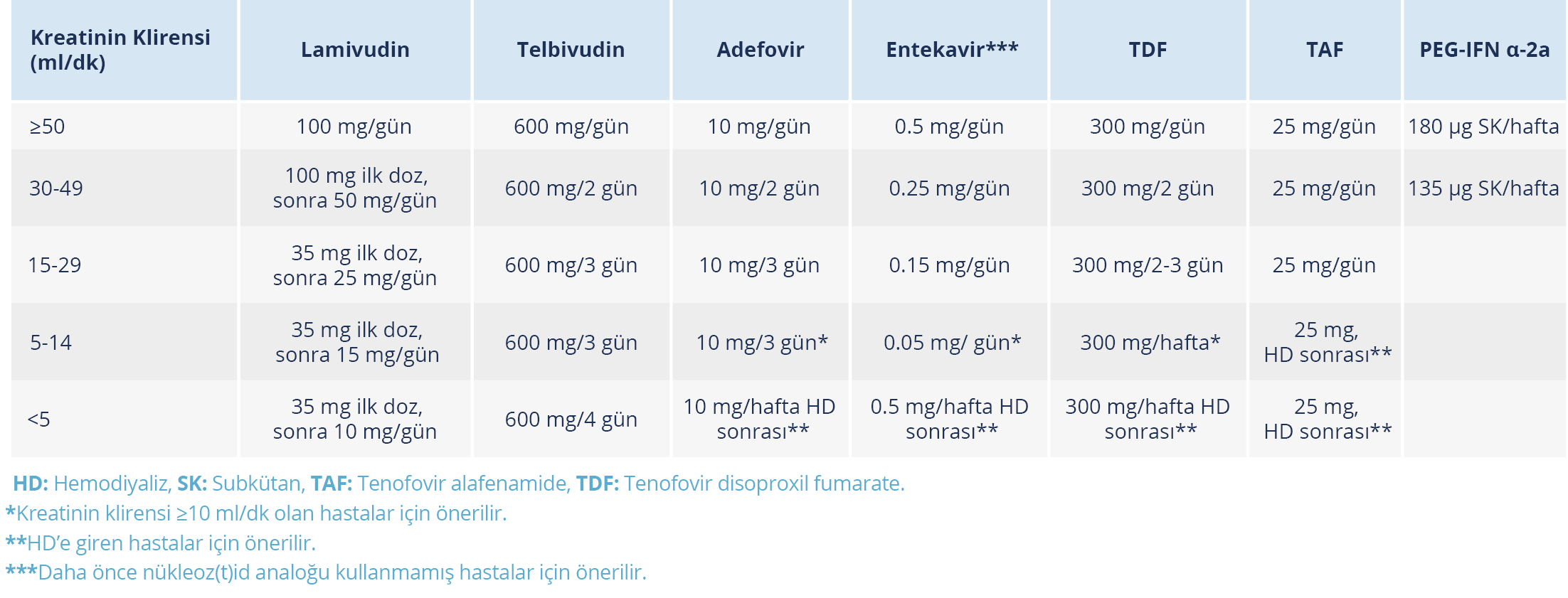
KHB ve azalmış renal fonksiyonu olan hastalar için antiviral seçimi kısmen kreatinin klirensine ve hastanın hemodiyalize girip girmemesine bağlıdır (Tablo 4):
- Kreatinin klirensi <60 ml/dk olan hastalarda mümkünse TDF’den kaçınılmalıdır.
- Kreatinin klirensi >15 ml/dk olan hastalarda entekavir veya TAF kullanılabilir. TAF’ın entekavire göre bir avantajı, dozun böbrek fonksiyonuna göre ayarlanmasına gereksinim olmamasıdır.
- Kreatinin klirensi <15 ml/dk olan ancak hemodiyalize girmeyen, kronik böbrek yetmezlikli hastalarda, farmakokinetik yeterli veri olmadığı için, TAF tedavisinden kaçınılmalıdır. Bu hastalarda kreatinin klirensine göre doz ayarlanarak entekavir kullanılabilir.
- Entekavir, TAF ve TDF hemodiyaliz hastalarına uygun doz ayarlamaları ile uygulanabilir.
Hemodiyaliz Hastalarında Kronik Hepatit B Tedavisi
Hemodiyaliz hastalarında tedavinin birincil amacı HBV’nin tam eradikasyonu olmakla birlikte günümüzde mevcut antivirallerle bu amaca nadiren ulaşılır. Bu nedenle daha gerçekçi yaklaşım HBV replikasyonunun baskılanarak hemodiyaliz sırasında hastadan hastaya HBV bulaşma riskini en aza indirmek, karaciğer hastalığının ilerlemesini yavaşlatmak, siroz, HSK gibi komplikasyonları önlemek ve proteinürinin remisyonu ile böbrek fonksiyonlarını korumak olmalıdır (74). KHB’li hemodiyaliz hastalarından aktif viral replikasyonu (HBeAg ve/veya serum HBV DNA pozitif) ve aktif karaciğer hastalığı (serum ALT değeri >1.5 kat normalin üst sınırı) olan ve/veya karaciğer biyopsisinde orta/şiddetli kronik hepatit olanlar tedavi edilmelidir (75). Diğer yandan hemodiyaliz hastalarında değişen inflamatuar yanıt nedeniyle serum ALT düzeyleri genellikle hafif artar veya hiç yükselmeyebilir. KHB infeksiyonu olan bir hemodiyaliz hastasında serum ALT seviyesinde başka türlü açıklanamayan bir yükselme var veya sürekli 30 İÜ/lt veya > 0.75 kat normalin üst sınırında ise ilerleyici karaciğer hastalığının bir kanıtı olabilir. Bu hastalarda ALT düzeylerinin >1.5 kat normalin üst sınırında olması beklenmeden belirgin hepatik inflamasyon kuşkusuyla karaciğer biyopsisi düşünülmelidir (76,77). Ayrıca bu hastalarda hemodiyaliz ile uzaklaştırılması nedeniyle serum HBV DNA düzeyleri, hemodiyaliz gereksinimi olmayan hastalara oranla, daha düşüktür (78). Yeterli klinik kanıt olmasa da normal renal fonksiyonlara sahip KHB hastalarında tedavi kriteri olarak önerilen HBV DNA düzeylerinin (karaciğer biyopsisinde ılımlı nekroinflamasyon veya fibroz varsa HBV DNA düzeyi >2000 İÜ/ml veya karaciğer histopatolojisine bakılmaksızın HBV DNA düzeyi >20 000 İÜ/ml) hemodiyaliz hastaları için geçerli olmadığı açıktır (18). Bu hastalarda daha yüksek oranlarda saptanan okült HBV infeksiyonu (HBsAg -negatif hastalarda karaciğer dokusunda ve bazı durumlarda serumda viral genomun saptanması), kardiyovasküler hastalık, DM ve anemi gibi birçok komorbidite riski de mevcuttur. Tüm bu parametreler kronik HBV infeksiyonunun klinik ve laboratuvar bulgularını, seyrini ve hastaların antiviral tedaviye yanıtını etkileyebilir. Sonuç olarak hemodiyaliz alan KHB hastalarının tedavisine ilişkin veriler kısıtlıdır. Bu hastalarda ALT düzeylerinden bağımsız olarak HBV DNA düzeyi > 2000 İÜ/ml olanlar, özellikle > F1 fibrozu karaciğer biyopsisiyle veya invazif olmayan yöntemlerle belgelenmişse tedaviye başlanması önerilir (79). Eğer renal transplantasyon planlanıyorsa, HBV DNA düzeyi ≤ 2000 İÜ/ml olsa bile nakilden iki hafta önce antiviral başlanması önerilmektedir (18,76).
KHB’li hemodiyaliz hastaları için tedavi seçenekleri interferonlar ve nükleoz(t)id analoglarıdır (79,80). Antiproliferatif ve immünomodülatör ilaç olan IFN-α, KHB’de kullanılan ilk antiviral ilaçtır. Bu ilaç renal tübüller tarafından metabolize edildiği için hemodiyaliz hastalarında, yarı ömrünün büyük ölçüde arttığı ve uzun süreli tedavinin ilaç birikimine yol açabileceği saptanmıştır. Grip benzeri semptomlara, mide bulantısına, ishale, yorgunluğa, lökopeniye, trombositopeniye, tiroid fonksiyon bozukluğuna, alopesiye ve depresyona neden olabilirler. Ayrıca hepatiti şiddetlendirebilir ve bu da altta yatan hastalığı olan hastalarda yaşamı tehdit eden hepatik dekompansasyona yol açabilir (81). Daha uzun yarı ömre sahip ilaçlar olan PEG-IFN’ler de böbrek yetmezliği olan hastalarda daha iyi tolere edilmez. Sonuç olarak KHB’li hemodiyaliz hastalarında IFN’ler önerilmemektedir (18,81). Sadece psikozu veya otoimmün hastalığı olmayan ve “glomeruler filtration rate” (GFR) > 30 ml/min/1.73 m2 olan non-sirotik, KHB’li çocuklarda kullanılabilirler (82).
Nükleoz(t)id analoglarının yaklaşık yarısı düşük molekül ağırlıklığına sahip oldukları ve görece proteinlere zayıf bağlandıkları için hemodiyalizle atılabilir. Bununla birlikte yüksek hacimli ilaç dağılımlarının olması ve hemodiyalizin genellikle haftada üç kez uygulanması nedeniyle sonrasında ek doz gerekmez. Bu nedenle çoğu nükleoz(t)id analoğu bir hemodiyaliz seansından sonra olmak kaydıyla haftada bir kez verilir (83). Kronik böbrek yetmezliği hastalarında tüm bu ilaçların dozları ayarlanmalıdır (Tablo 1).
Lamivudin, KHB tedavisinde kullanılan ilk nükleozid analog antiviraldir. Kronik böbrek yetmezliği hastalarında da başarıyla kullanılmıştır. Olumlu güvenlik profili nedeniyle iyi tolere edilir ve esas olarak böbrekler yoluyla atıldığından ve böbrek yetmezliğinde ilaç yarı ömrü üç veya dört kat artabileceği için doz ayarlamasına gereksinim vardır (84). Tüm bu olumlu profiline rağmen uzun dönem lamivudin tedavisi yüksek lamivudin direnç sorununu da beraberinde getirmekte ve bu ilacın hemodiyaliz hastaları da dahil KHB tedavisinde kullanılmasını kısıtlamaktadır (18,85).
Lamivudinin aksine adefovirin hemodiyaliz hastalarında kullanılmasıyla ilgili deneyimler yetersiz olmakla birlikte bu ilacın nefrotoksik olduğuna dair kanıtlar vardır ve rezidüel böbrek fonksiyonu olan hemodiyaliz hastalarında kullanılmamalıdır (86). Lamivudinde olduğu gibi adefovirin de uzun dönem kullanılması ilaç direncine yol açmaktadır. Hemodiyaliz alan veya almayan KHB hastalarında kullanılmaları önerilmemektedir (18, 86).
Telbivudin güçlü antiviral etkinliği ve olumlu güvenlik profiliyle lamivudine benzerlik gösterir ve uzun dönem tedaviye bağlı direnç oranları lamivudine oranla daha düşüktür (87). Bununla birlikte telbivudinin böbrek fonksiyon bozukluğu olan KHB hastalarında kullanılmasına ilişkin yeterli veri bulunmamaktadır. İlaç esas olarak böbrekler yoluyla elimine edilir; bu nedenle, hemodiyaliz hastaları da dahil olmak üzere kreatinin klirensi 50 ml/dk’nın altında olan hastalarda doz ayarlaması önerilir (88). Daha düşük direnç riskine ve yüksek etkinliğe sahip ilaçların kullanıma girmesiyle telbivudin de KHB’de birinci basamak tedavi olmaktan çıkmıştır (18).
Bir nükleotid analoğu olan TDF, böbrek fonksiyonu normal olan kronik HBV hastalarının tedavisinde birinci basamak oral antiviral olarak önerilmektedir (89). Tenovir disoproksil fumarat, lamivudine dirençli HBV infeksiyonu olan hastalarda da etkili bir alternatif olabilir ve adefovirden daha fazla HBV DNA süpresyonuna, daha yüksek ALT normalizasyon oranlarına ve daha fazla HBsAg kaybına sahiptir (90). KHB’li hemodiyaliz hastalarının tedavisinde başarılı olduğunu gösteren çalışmalar vardır (91,92). Ancak adefovirde olduğu gibi TDF ile tedavi edilen bazı hastalarda nefrotoksisite ve akut böbrek hasarı bildirilmiştir (93,94). Bu nedenle rezidüel böbrek fonksiyonu olan diyaliz hastalarında bu ilaçtan kaçınılmalıdır.
Tenefovir alafenamid (TAF) hem tedavi almamış hem tedavi deneyimli KHB hastalarında iyi bir tedavi seçeneği olabilir, ancak hemodiyaliz alan hastalarda etkinliği ve güvenilirliğiyle ilgili yeterli çalışma yoktur. Tenefovir alafenamid renal yetmezliği olan hastalarda, kreatinin klirensi 15 ml/dk’nın üstünde ise doz ayarlaması gerekmeksizin kullanılabilir. Kreatinin klirensi 15 ml/dk’nın altında olan ve hemodiyaliz uygulanmayan hastalara önerilmez. Hemodiyaliz alan hastalarda, ilaç dozu diyaliz tamamlandıktan sonra olmak koşuluyla önerilir (18,69,95).
Entekavir, daha önce tedavi görmemiş KBY hastalarında önerilen birinci basamak oral tedavidir (18,97). Bu hastalardaki yüksek etkinliği ve genetik bariyeri göz önüne alındığında, entekavir hemodiyalize giren ve/veya renal transplant adayı hastalar için en umut verici anti-HBV ilaçtır (97). Lamivudine oranla entekavire direnç oranları çok düşüktür; üç yıllık monoterapiden sonra yaklaşık %1’dir (97). Yine de uzun süreli entekavir tedavisi lamivudin direnci olan hastalarda çok etkili olmadığından, bu gibi durumlarda TDF veya TAF verilebilir (18,91). Entekavir renal yolla elimine edildiğinden hemodiyaliz hastaları için doz azaltımı önerilmektedir (98). Ayrıca, ilaç hemodiyalizden sonra uygulanmalıdır ve sürekli ayaktan periton diyalizinde ilacın eliminasyon oranı çok düşük olduğu için dikkatli kullanılmalıdır. Entekavirin yemekten en az iki saat sonra veya bir sonraki yemekten en az iki saat önce alınması önerilmektedir.
KBY Hastalarında Antiviral Tedavinin İzlenmesi
Nükleoz(t)id analoglarının tedavisine yanıt aşağıdaki parametrelerle izlenir;
- En az iki ardışık kontrolde HBV DNA negatifliği sağlanana kadar üç ayda bir, sonrasında altı ayda bir HBV DNA ölçümü yapılmalıdır.
- Üç ayda bir aminotransferaz testleri ölçülmelidir. HBV DNA negatifliği veya ALT normalizasyonu sağlanırsa sıklık üç ayda bire düşürülebilir.
- HBeAg pozitifliği olan hastalarda serokonversiyonu izlemek amacıyla 12 ayda bir HBeAg ve anti-HBe testleri yapılmalıdır. HBeAg serokonversiyonu gerçekleşmişse, sonucu doğrulamak için HBeAg ve anti-HBe testleri tekrarlanabilir.
- HBV DNA test sonucu negatif olan hastalarda HBsAg yıllık olarak test edilmelidir.
- Ayrıca antiviral ilaçlar, bu hasta popülasyonuna özgü yan etkiler açısından dikkatle izlenmelidir. Tenofovir disoproksil fumarat veya adefovir kullanılıyorsa, kreatinin ve fosfat düzeyleri her 3-6 ayda bir ölçülmelidir. Dekompanse sirozu olan hastalar için kreatinin düzeyleri daha sık izlenmelidir (1-3 ay gibi). Henüz bir rehber önerisi olmamakla birlikte TAF kullanan hastalarda izleme sıklığı azaltılabilir. Böbrek yetmezliği riski düşük olan hastalarda da yılda bir kez kreatinin izlenmesi önerilmektedir.
KARACİĞER NAKLİ SONRASI HEPATİT B NÜKS GELİŞİMİNİN ÖNLENMESİ VE NÜKS GELİŞEN HASTALARDA TEDAVİ
KHB gerek dünyadaki prevalansı gerekse de uzun dönemde dekompanse siroz ve primer karaciğer kanseri gibi komplikasyonlara yol açmasıyla dünya ölçeğinde bir sağlık sorunu olmaya devam etmektedir. Tüm karaciğer nakli olgularının yarıya yakınında neden, HBV ilişkili son dönem karaciğer yetmezliği ve karaciğer kanseri olarak belirlenmektedir (18,99,100).
Karaciğer nakli sonrası HBV rekürrensi ya da nüks, HBsAg pozitifliği ve/veya HBV DNA’nın saptanabilir düzeylerde olması olarak tanımlanmaktadır (101,102).
Uygun profilaksinin sağlanamadığı dönemlerde HBV infeksiyonu, nakil sonrası dönemde HBV rekürrensinin hızla ilerleyen karaciğer hastalığı, kolestatik hepatit, greft kaybı ve ölümle ilişkili olması nedeniyle, karaciğer transplantasyonu için rölatif bir kontrendikasyon olarak kabul ediliyordu (103). Ancak HBIG ve ardından nükleoz(t)id analoglarının kullanıma girmesiyle, günümüzde klinik sonuçlar diğer nakil endikasyonlarından farksız hale gelmiş ve nüks oranları %5’in altına düşmüştür (18,102). Bununla birlikte, nakil sonrası nüksün önlenmesi için farklı transplantasyon merkezleri arasında üzerinde uzlaşılmış bir protokolden söz etmek olanaklı değildir (99).
Nakil Sonrası Hepatit B Virusu Rekürrensi Riskinin Değerlendirilmesi
HBV rekürrensinin önlenmesine yönelik yaklaşımda nüks riskinin değerlendirilmesi belirleyicidir. Karaciğer greftinin reinfeksiyonu yönünden en önemli risk, nakil sırasında HBV DNA’nın saptanabilir düzeylerde olmasıdır (104,105). Nakil sırasında HBV DNA düzeyi >20 000 İÜ/ml olan olgularda nüks olasılığının, HBV DNA düzeyi düşük olan olgulara göre yüksek olduğu bildirilmiştir (104). Buna ek olarak, nakil sırasında HBeAg pozitifliği, primer karaciğer kanseri varlığı, HDV ve HIV koinfeksiyonu, nakil öncesi antiviral ilaç direnci varlığı ve tedaviye uyumsuzluk da HBV rekürrensi açısından yüksek riskli durumlar olarak tanımlanmıştır (18,101,106,107).
Nakil Öncesi Yaklaşım
Kronik HBV infeksiyonu olan tüm olgulara, nakil sonrası nüks olasılığının azaltılması için, nakil öncesinde nükleoz(t)id analogları ile tedavi başlanmalıdır. Alıcının nakil sırasında nükleoz(t)id analoglar ile tedavi altında olmaması durumunda, antiviral tedaviye olanaklı olan en kısa sürede başlanmalıdır. Öte yandan, acil nakil gereken akut karaciğer yetmezliği gibi durumlarda nakil öncesi yüksek viral yük varlığı nakil için bir kontrendikasyon oluşturmaz (108).
Etkinlik, istenmeyen etki sıklığının az olması ve düşük direnç olasılığı nedenleriyle tedavide tercih edilmesi önerilen ajanlar entekavir ve TDF’dir. Nakil olgularında kullanımına dair çalışmalar sınırlı olmakla birlikte, etkinliği ve renal yan etki sıklığının daha düşük olması nedeniyle, TAF kullanımı da bir seçenektir (19,99,103,108).
Karaciğer nakli alıcılarında nakil sonrası antiviral profilaksinin, uzun dönemde saptanamayan serum HBV DNA düzeyleri ve düşük HBsAg pozitifliği ile ilişkili olduğu gösterilmiştir (109,110).
Nakil sonrası antiviral profilaksi, nüks riskinin düşük olduğu hastalar dahil olmak üzere, ömür boyu kesilmeksizin sürdürülmelidir (19).
İmmünoprofilaksi Kullanımı
Nükleoz(t)id analoglarının kullanıma girmesi öncesinde profilaksi amacıyla tek başına kullanılan HBIG’in dolaşımdaki viriyonları nötralize ederek ve infekte hepatositlerin eksprese ettiği HBsAg’ye bağlanarak hücresel sitotoksisite aracılığıyla hücre lizisini sağladığı ve böylece greft reinfeksiyonunu önlediği düşünülmektedir (103).
Hepatit B hiperimmünoglobulin monoterapisi HBV nüksü olasılığını %70’lere varan oranda azaltsa da HBIG ile potent antivirallerin kombinasyonu karaciğer nakli sonrası standart yaklaşım haline gelmiştir ve HBIG ile monoterapi önerilmez (99,101,102).
Hepatit B hiperimmünoglobulin uygulaması için yaygın olarak kabul görmüş bir doz, süre, uygulama yolu yaklaşımı yoktur ve merkezler arasında farklılık gösterir. Genel olarak HBIG karaciğer nakli sırasında, anhepatik fazda, risk düzeyine göre intravenöz yolla bolus olarak uygulanan 5000-10 000 İÜ’nün ardından olmak üzere üç aşamada uygulanır; nakil sonrası yedi gün boyunca günde 2000-10 000 İÜ dozunda intravenöz HBIG önerilmektedir. İlerleyen dönemde HBIG uygulamasının bireyselleştirilerek anti-HBs düzeyi 100 İÜ/lt üzerinde kalacak şekilde haftalık ya da aylık idame tedavisi planlanması yaygın olarak önerilen yaklaşımdır (99,108). Hepatit B hiperimmünoglobulin kullanımı ile nakil sonrası anti-HBs düzeylerinin 100 İÜ/lt üzerinde tutulmasının HBV nüksünü önleyebileceği gösterilmiştir (112). İdame tedavisi, merkezlerin tercihine göre, intravenöz, intramüsküler ve subkütan yolla uygulanabilir (99,108).
Potent nükleoz(t)id analoglarının ömür boyu kullanımıyla birlikte, özellikle düşük riskli hastalarda, HBIG dozunun azaltılması ya da tamamen kesilmesi bir seçenek haline gelmiştir (19,99,108). Bu hasta grubunda kısa süreli kombinasyon durumunda anti-HBs düzeylerinin nakil sonrası 4 hafta süreyle hedef değerlerde tutulması önerilmektedir. Post-operatif dönemde 5-7 gün süreyle uygulanan HBIG ile hedeflenen anti-HBs düzeylerinin sağlanacağı akılda tutulmalıdır (108). Yüksek riskli hastalarda ise HBV DNA negatifliği sağlanması durumunda HBIG tedavisinin nükleoz(t)id analogları ile en az bir yıl sürdürülmesi önerilir (108).
Kimi nakil merkezlerinde HBIG sadece nüks açısından yüksek riskli hastalarda kullanılmaktadır (19). Hepatit B hiperimmünoglobulin kullanılmayan ve sadece nükleoz(t)id analoglarıyla profilaksi uygulanan olgularda daha yüksek oranlarda HBsAg pozitifliği saptanır. Bununla birlikte, tam viral baskılanmanın ve HBV DNA negatifliğinin sağlanması halinde bu seropozitifliğin önemi tartışmalıdır ve greft ile hasta sağ kalımı açısından bir fark yaratmaz (108). Nükleoz(t)id analoglarının monoprofilaksisinin etkinliğinin araştırıldığı bir çalışmada, entekavir alan 265 hastada 8. yılda %92 HBsAg negatifliği ve %100 HBV DNA negatifliği sağlandığı; dokuz yıllık sağkalımın %85 olduğu bildirilmiştir (112).
Nükleoz(t)id analogları ile monoprofilaksi, nakil öncesi saptanamayan HBV DNA düzeylerine sahip hastalarda ve özellikle HDV koinfeksiyonu olmayan olgularda alternatif bir profilaktik yaklaşım olabilir. Bununla birlikte, HDV koinfeksiyonu olan olgularda HBsAg ’nin yeniden saptanabilir hale gelmesi halinde HDV rekürrensi ile karşılaşılabileceği için bu yaklaşımdan kaçınılmalıdır. HDV rekürrensinin önlenmesi açısından bu hasta grubunda standart yaklaşım nükleoz(t)id analogları ile HBIG kombinasyonunun ömür boyu devamıdır. Bununla birlikte, nükleoz(t)id analoğu ile monoprofilaksi için, hasta uyumunun yüksek olması şarttır ve gereği halinde hasta eğitim programları düzenlenmelidir (108).
Öte yandan kimi kılavuzlarda nükleoz(t)id analoğu ile monoterapinin klinik çalışmalarla sınırlı tutulması önerilmektedir (108). Nakil sonrası tüm profilaktik yaklaşımlarda hem nükleoz(t)id analoglarının hem de HBIG’in bırakılması, hiçbir hasta grubunda önerilmez.
HBV Bağışıklaması
Nakil alıcılarında, HBV bağışıklamasının rekürrensi önlemedeki etkinliği belirsizdir. Nakil listesinde olan hastalara HBV bağışıklaması önerilmekle birlikte, nakil sonrası profilaksinin kesilmesi amacıyla HBV bağışıklaması sadece kontrollü çalışmalar kapsamında düşünülebilir ve anti-HBs yanıtından bağımsız olarak nükleoz(t)id analoglarının tedavisi kesilmemelidir (108,113).
Anti-Hbc Pozitif Karaciğer Greftlerinin Kullanımı
Anti-HBc pozitif donör prevalansı Avrupa’da %10, Asya’da %50’lere ulaşmakta olup donör havuzunun genişletilmesi amacıyla bu vericilerin organlarının kullanılmasının giderek yaygınlaştığı bildirilmiştir (108,114). Anti-HBc pozitif vericilerin karaciğerleri ideal olarak, nakil sonrası rutin profilaksi alacak olan HBsAg pozitif hastalarda kullanılmalıdır. Ancak söz konusu vericilerden alınan greftler KHB infeksiyonu olmayan olgularda da kullanılabilmektedir.
Anti-HBc pozitif olan bir vericinin hepatositlerinde var olan “covalently closed circular” DNA (cccDNA)’nın, alıcıdaki immün baskılanmayla birlikte reaktivasyonu greft ilişkili HBV infeksiyonuna yol açabilir. Anti-HBc pozitif vericiden alınan greftle ilişkili HBV infeksiyonu riski, alıcının HBV serolojisine göre değişir; HBV naif alıcılarda en yüksek iken anti-HBc ve anti-HBs pozitif alıcılarda en düşüktür (108,115,116).
KHB infeksiyonu olmayan alıcılarda profilaksinin amacı, alıcıda “greft ilişkili” ya da “de novo” HBV infeksiyonunun önlenmesidir. Anti-HBc pozitif donörlerin alıcılarının, nakille birlikte başlanarak, ömür boyu antiviral profilaksi alması önerilir. Bu alıcılarda HBIG ile immünoprofilaksinin yeri yoktur (19,108,117).
HBsAg Pozitif Karaciğer Greftlerinin Kullanımı
HBsAg pozitif vericilerden karaciğer nakli için, delta koinfeksiyonu ve histolojik olarak karaciğer hasarının dışlanması gereklidir. Bu koşulların sağlanması halinde HBsAg pozitif greftlerin kullanıldığı nakillerin uzun dönem sonuçları, HBsAg negatif greftlerden farklı değildir. Bu greftlerin alıcılarının ömür boyu antiviral profilaksi almaları önerilir. Ancak HBIG kullanımının faydası belirsizdir (108).
Öneriler
- Karaciğer nakli planlanan tüm hastalara nükleoz(t)id analogları ile profilaktik tedavi başlanmalıdır. Etkinlik ve uzun dönem direnç verileri dikkate alındığında, tercih edilmesi gereken ilaçlar entekavir, TDF ve TAF’tır. Nakil sonrası antiviral profilaksi, nüks riskinin düşük olduğu hastalar dahil olmak üzere, ömür boyu sürdürülmelidir.
- Nakil sonrası HBIG kullanımı hastanın risk düzeyi dikkate alınarak bireyselleştirilmelidir. Düşük riskli hastalarda kısa süreli HBIG uygulaması yeterliyken, HDV ya da HIV ile koinfekte hastaların ya da nükleoz(t)id analogları ile tedavi uyum sorunu yaşayanların antiviral tedavi ve HBIG kombinasyonu altında izlemi daha uygun bir yaklaşımdır.
- Anti-HBc pozitif vericilerden alınan greftlerin kullanıldığı HBsAg negatif hastalar ömür boyu antiviral tedavi altında izlenmelidir. Bu alıcılarda HBIG ile immünoprofilaksi yapılmasına gerek yoktur.
TRANSPLANT DIŞI İMMÜNOSÜPRESİF TEDAVİ ALANLARDA HEPATİT B TEDAVİ YÖNETİMİ
Hepatit B virusunun doğal seyri virusun replikasyonu ve konağın immün yanıtı arasındaki etkileşimle belirlenmektedir. HBV infeksiyonunda klinik ve serolojik iyileşme olsa ve hatta HBsAg serumdan kaybolsa bile hepatositlerde HBV genetik materyali cccDNA kalmakta ve gelecekte viral replikasyon için kalıp oluşturmaktadır (118). Bu nedenle hastalarda immün kontrolün bozulması; HBV reaktivasyonuna yol açabilir, alevlenmeler görülebilir ve hatta ölümle sonuçlanabilir.
HBsAg pozitif hastalarda, HBV DNA düzeyinin daha önceki bazal değere göre ≥1-2 log10 İÜ/ml (10-100 kat) artması, HBsAg-negatif, anti-HBc pozitif olan hastalarda HBV DNA pozitifliği reaktivasyon tanısı koydurmaktadır (19,119). Hepatit B’nin alevlenme tanısı için ALT’nin bazal düzeyden veya daha önce ALT’si normal olanlarda üst normalden ≥3 kat artması veya ALT’nin >100 İÜ/ml olması yeterlidir.
İmmünosüpresif Tedavi Öncesi HBV Taraması Nasıl Yapılmalıdır?
Kemoterapi ya da transplantasyonun yanı sıra romatolojik veya inflamatuar hastalık nedeniyle biyolojik ajan ya da diğer immünosüpresif tedavileri alacak tüm hastalar tedavi öncesi HBV infeksiyonu yönünden taranmalıdır.
Tüm riskli hasta grupları HBsAg ve anti-HBc antikor ve anti-HBs testleri ile taranmalıdır (63,119-123). Anti-HBs bakılması önleyici tedavi verilecek hastaları belirlemekte kullanılmamaktadır. Anti HBc pozitif olanlarda anti-HBs varlığında HBV reaktivasyon riski azalmakla birlikte, risk ortadan kalkmamaktadır. Anti-HBs’nin, anti-HBc pozitifliği ile birlikteliği geçirilmiş infeksiyonu gösterecektir; pozitif iken negatifleşmesi de reaktivasyon bulgusu olabilir (120).
HBsAg pozitifliği bulunan hastalarda bazal HBV DNA düzeyi ölçülmelidir. Ek olarak; HBeAg ve anti-HBe’nin yanı sıra eş zamanlı olabilecek HDV, HCV ve HIV gibi diğer infeksiyonlar için de test yapılmalıdır (63,120).
HBsAg negatif ve anti-HBc pozitif ise risk değerlendirilerek orta-yüksek risk grubunda bulunan hastalarda da HBV DNA düzeyi ölçülmelidir (19,63,122).
Tüm HBsAg pozitif ve HBsAg negatif fakat anti-HBc pozitif hastalarda karaciğer fibrozu açısından (invazif yöntemler kullanılabilir) değerlendirme önerilmektedir (119).
HBV Reaktivasyonu İçin Risk Değerlendirmesi Nasıl Yapılır?
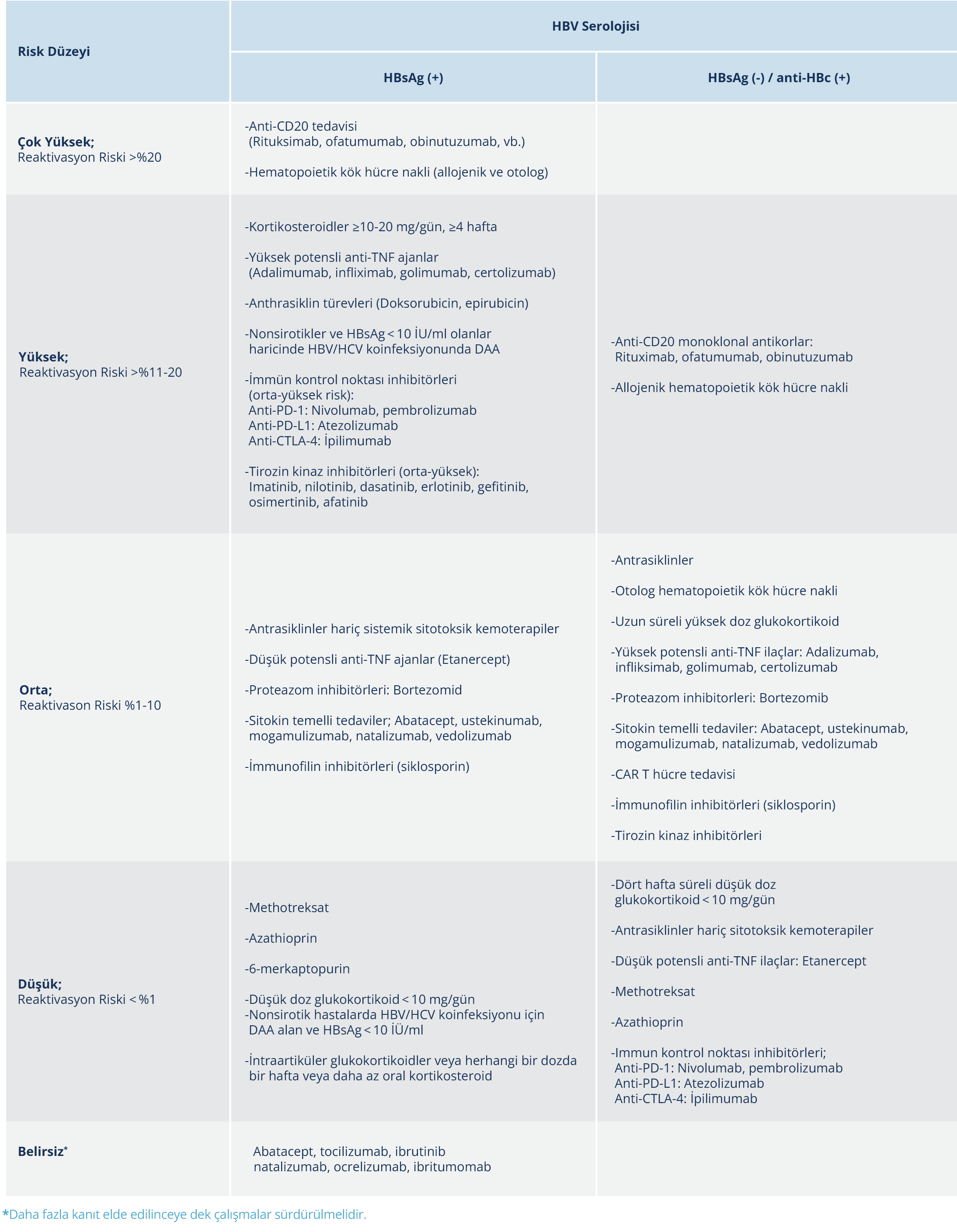
Tablo 5. HBsAg-Pozitif ve HBsAg Negatif/Anti-HBc Pozitif Hastalar Arasında HBV Reaktivasyonu Risk Sınıflandırması
Risk değerlendirmesi serolojik bulgular ve immünosüpresif tedavi tipine göre yapılır. HBsAg-pozitif ve HBsAg negatif/anti-HBc pozitif hastalar için, alacakları immünosüpresif tedaviye göre, HBV reaktivasyonu açısından risk sınıflandırması Tablo 5’te gösterilmiştir.
Öneriler (19,63,119,121, 125-131)
- HBV infeksiyonu yönünden negatif bulunan tüm hastalar aşılanmalıdır. Hepatit B aşılarına immünosüpresif tedavi almadan en az 14 gün önce başlanmalıdır. Immünosüpresif hastalarda aşı yanıtı yeterli olmayabilir. Yeterli anti-HBs düzeyine erişmek için yüksek doz ya da güçlendirilmiş aşılama gerekebilir.
- KHB infeksiyonu olup tedavi kriterlerini karşılayan tüm hastalar immünosüpresif tedavinin özelliğine bakılmadan entekavir, TDF veya TAF ile immünokompetan hastalar gibi antiviral tedaviye alınmalıdır. Immünosüpresif tedavi kesilse de tedaviye devam edilmelidir. Hangi sınıftan olursa olsun ileri fibroz ya da sirozu olanlara tedavi başlanmalıdır.
- Serolojik bulgusu olan tüm hastalar HBV reaktivasyon riski ve önleyici tedavi açısından değerlendirilmelidir.
- Antiviral profilaksi, tarama test sonuçları ve alınacak immünosüpresif tedaviye göre belirlenerek risk sınıfına göre değerlendirilir. HBsAg pozitif veya HBsAg negatif/anti-HBc pozitif orta-yüksek riskli gruba antiviral profilaksi başlanmalıdır. HBV DNA düzeyi yüksek olanlarda (>4 log10 İÜ/ml), mümkün olduğunca immünosüpresif tedavi HBV DNA düzeyleri baskılanıncaya dek (<3 log10 İÜ/ml) ertelenmelidir.
- Düşük risk grubundaki hastalarda risk; virolojik profil, altta yatan hastalık, immünosüpresyonun tipi ve süresi ile de ilgilidir. Bu hastalarda mutlaka başlangıç HBV DNA düzeyine bakılmalıdır.
- Antiviral profilakside yüksek direnç bariyeri ve yüksek potensleri nedeni ile TDF, TAF veya entekavir kullanılmalı, interferonlar asla verilmemelidir. Nefrotoksisite riski olan hastalarda entekavir veya TAF tercih edilmelidir.
- Antiviral profilaksi mümkünse immünosüpresif tedavinin 2-4 hafta öncesinde başlatılmalıdır ve eğer bu sağlanamamışsa immünosüpresif tedavi ile birlikte verilmelidir; immünosüpresif tedavinin kesiminden sonra en az 12 ay devam etmelidir. Başlangıç HBV DNA düzeyi düşük olan (<2000 İÜ/ml) veya sirozu olmayan hastalarda altı ay yeterli olabilir. Rituksimab gibi B hücrelerini baskılayan tedavi alan hastalarda tedavi süresi en az immünosüpresyonun kesilmesinden 18 ay sonraya dek uzatılmalıdır; ayrıca altta yatan hastalığın remisyona girmesi de belirleyicidir. Ancak altta yatan hastalık remisyondaysa kesilmelidir.
- HBsAg pozitif veya HBsAg negatif/anti-HBc pozitif olup tedavi başlanmayan ve preemptif yaklaşım düşünülen düşük risk grubu hastalar, 1-3 ayda bir karaciğer testleri ve üç ayda bir HBV DNA düzeyinin takibi ile izlenmelidir. Anti-HBc tekrarına gerek yoktur. Immünosüpresif tedavi sonlandıktan sonra da 6-12 ay izleme devam etmelidir.
- HBV için profilaksi alan kemoterapi veya immünosüpresif tedavi sırasında reaktivasyonu olan tüm hastalar entekavir veya TDF/TAF ile tedavi edilmelidir. Tedavi süresi altta yatan karaciğer hastalığına, HBV DNA düzeyine ve immünosüpresif tedavinin tipine göre belirlenir.
- İmmünosüpresif tedavi ya da kemoterapinin kesilmesi ya da ara verilmesi gerekebilir; bu durum hasta bazında değerlendirilmelidir. Özellikle transaminaz düzeylerinde ≥5 kat artış ve sarılık semptomları olan hastalarda ALT/AST’de üç kat yükselme olması durumlarında HBV DNA düzeyi ve ALT düzeyi düşünceye kadar immünosüpresif tedavi ya da kemoterapiye ara verilmesi önerilir.
FÜLMİNAN HEPATİTTE TEDAVİ
Fülminan hepatit; ciddi karaciğer hasarına bağlı karaciğer fonksiyon bozukluğu sonucunda koagülopati ve hepatik ensefalopatiye gidebilen, mortalitesi yüksek, nadir görülen bir sendromdur (131). Akut hepatit B infeksiyonu sırasında, önceden bilinen ya da bilinmeyen kronik karaciğer hastalığı varlığında, herhangi bir nedene bağlı KHB infeksiyonunun reaktivasyonunda veya HDV gibi KHB infeksiyonu üzerine gelişen süper infeksiyon sonrasında gelişebilir. Kronik karaciğer hastalığı varlığında sarılık, koagülopati ve yaklaşık dört hafta içinde asit ve/veya hepatik ensefalopati gelişirse karaciğer yetmezliği düşünülmelidir (132-134).
Akut karaciğer yetmezliğinde; sarılık başlamasından hepatik ensefalopatiye kadar geçen süre yedi günden az ise hiperakut, 8-28 gün arasında ise akut, 29-72 gün arasında ise subakut olarak tanımlanır. Hiperakut karaciğer yetmezliğinde koagülopati ciddidir, transaminazlar hızla yükselir, bilirübin değerleri orta derecede yüksektir. Subakut formunda ise transaminazlar hafif, bilirübin belirgin yüksektir, hafif-orta koagülopati olur; bu nedenle karaciğer enzimleri güvenilir bir parametre değilken koagülasyon parametreleri daha değerlidir (131,134).
Akut karaciğer yetmezliğinde, karaciğerde sentezlenen K vitaminine bağlı olan faktör II, V, VII ve X eksikliği sonucu koagülopati gelişir. Bu yüzden prognozu gösteren protrombin zamanı ve “international normalised ratio” (INR) takibi çok önemlidir. Karaciğer enzimleri düzelirken bilurubin, protrombin zamanı (PTZ), INR değerlerinde artış varsa prognozun kötüleştiğinden söz edilebilir; INR, varfarin gibi birçok ilaçtan etkilenebilir, bu yüzden PTZ koagülopatiyi gösteren en doğru parametredir. Koagülopatisi olan hastalarda trombosit sayısı (<60 000/mm3) çok düşmeden, kanama belirtisi olmadan profilaktik amaçlı pıhtılaşma faktörlerinin verilmesi önerilmez. Özellikle INR ve PTZ prognozun belirleyicisi olduğundan, taze donmuş plazma desteği verilirse hızla yalancı düzelme görülebilir ve bu durum prognozun belirlenmesi ve nakil gerekliliği açısından yanıltıcı olabilir (131). Akut karaciğer yetmezliğinde, fibrin yıkım ürünleri artarken, fibrinojen, antitrombin III, plazminojen, protrombin, faktör V, VII, IX ve X azalır (132,133,135). Fülminan hepatitten şüphe edilen hastalarda INR değeri >1.5 ise ve hepatik ensefalopati bulguları varsa prognozun kötüleştiği düşünülmeli ve hastalar mutlaka karaciğer nakli yapılan merkeze vakit kaybetmeden gönderilmelidir (131).
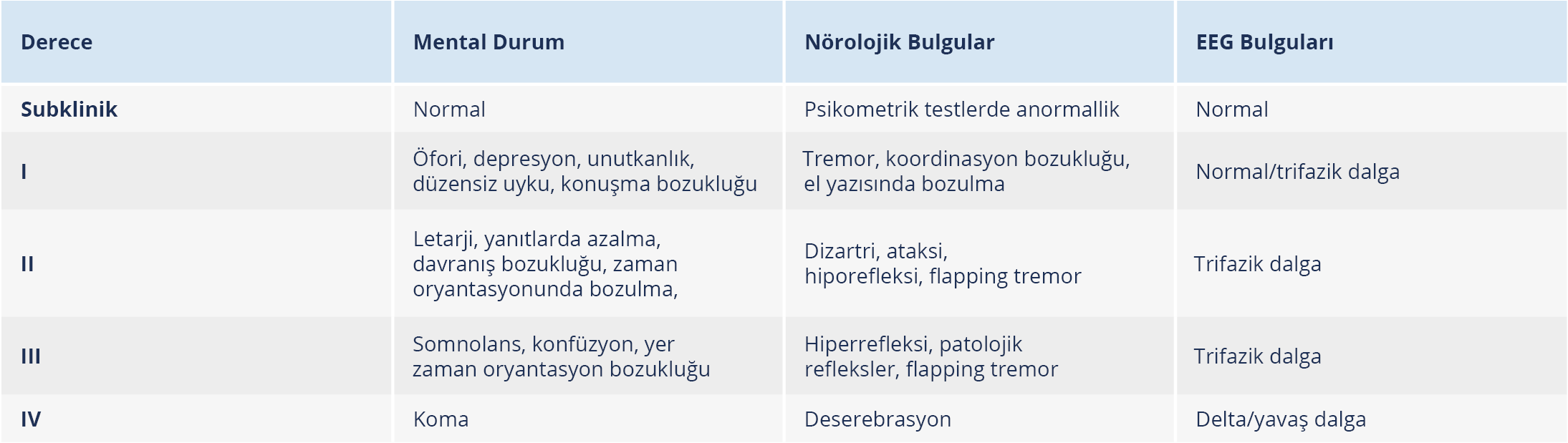
Akut karaciğer yetmezliğinin en önemli bulgularından birisi ensefalopatidir. Başlangıçta ensefalopati atlanabilir, bu yüzden hastalar mutlaka dikkatlice yakın takip edilmelidir. Hepatik ensefalopati derece I’den IV’e kadar değişmekle birlikte ilk belirtisi uyku düzensizliği, değişik derecelerde unutkanlık olabilir; beraberinde hiperrefleksi, hipertoni, halüsinasyonlar, asteriksis, nöromüsküler anormallikler görülebilir. Derece II’de nörolojik semptomlar biraz daha belirginleşir, uykuya meyil ve inkontinans olabilir; derece III’te hasta sürekli uyku halindedir, ancak uyandırılabilir; derece IV’te ise koma hali vardır ve hasta uyandırılamaz (Tablo 6) (131,134).
En önemli mortalite nedenlerinden biri beyin ödemidir ve kafa içi basıncın artmasıyla birlikte beyin perfüzyonu bozulur, iskemik hasar sonrasında da beyin sapı herniasyonu gelişebilir. Hepatik ensefalopatide beyin ödemi derece I-II’de nadir, derece III’te %25-35, derece IV’te %65-75 oranındadır. Derece I’de yoğun bakım ihtiyacı yoktur, derece II ve sonrasında hastalar yoğun bakımda takip edilmelidir (131). Ayrıca ensefalopati gelişen hastalarda kafa içi basıncını azaltmak açısından hastanın başı nötral 30° olacak şekilde kaldırılmalıdır. Beyin perfüzyon basıncı 50 mmHg’nın altına düşerse hastayı tekrar supin pozisyonuna getirmek gerekebilir (136). Kafa içi basıncı monitörizasyonu yapılması gerekiyor ise hastaların koagülasyon bozuklukları mutlaka düzeltilmelidir. Hepatik ensefalopati gelişen hastalarda kafa içi basıncı monitörize ediliyorsa, kafa içi basıncı 20-25 mmHg’nın altında, beyin perfüzyon basıncı ise 50-60 mmHg üstünde tutulmalıdır. Beyin perfüzyonunu istenen seviyede tutmak için sistemik kan basıncı düşük ise yükseltilmeye çalışılmalı, ancak kafa içi basınç artışına neden olabileceğinden kontrolsüz sıvı replasmanından da kaçınılmalıdır (137).
Beyin ödemi ve kafa içi basınç artışında patogenezden artmış serum amonyak (>150 mikromol/lt) düzeyi sorumludur. Enteral laktüloz verilmesinin amonyak düzeyini düşürmeye, dolayısıyla da beyin ödemini önlemeye katkı sağlayacağı belirtilmektedir. Ancak geç dönem hepatik ensefalopatide aspirasyon riski olabileceği için oral ya da nazogastrikten laktüloz verilmesinden kaçınılmalıdır (131).
Antikonvülzan ilaçların profilaktik kullanımı konusunda net bir veri bulunmamaktadır. Ancak konvülsiyon gelişirse öncelikle fenitoin başlanmalıdır; yanıt alınamaz ise kısa etkili benzodiazepinler verilmelidir (137).
Ozmotik ajanlardan olan mannitol, hafif beyin ödemi geliştiğinde ilk tercih edilecek tedavidir (IV 0.5-1 g/kg bolus). Mannitol verilirken renal yetmezlik açısından dikkatli olunmalıdır (131). Kafa içi basıncı çok yüksek ise (>60 mmHg) etkili olmayabilir. Kafa içi basıncı artmış, mannitol infüzyonu ile yanıt alınamamış durumlarda akut kafa içi basıncının regülasyonunu sağlamak ve herniasyonu önlemek amacıyla hiperventilasyon uygulanabilir. Hiperventilasyon ile vazokonstriksiyon sağlanarak kafa içi basıncı düşürülebilir. Hiperventilasyonun etkisinin geçici olduğu unutulmamalıdır (131).
Serebral ödemi azaltmak için vücut ısısının 32-35 °C’ye düşürülmesinin de yararlı olduğunu gösteren küçük çaplı çalışmalar mevcuttur. Ancak hipotermi sırasında kardiyak ritim bozuklukları, infeksiyon ve koagülasyon bozuklukları gelişebileceğinden yararı kanıtlanmış değildir (138).
Akut karaciğer yetmezliği gelişen olguların yaklaşık %30’unda pulmoner ödem de görülebilir ve mekanik ventilasyon ihtiyacı olabilir. Bu durumda “positive end-expiratory pressure” (PEEP) uygulanırken beyin ödemini artırabileceğinden ekspirasyon sonu basınç düzeyleri dikkatle izlenmelidir (136).
Hastalarda ensefalopatiye bağlı ajitasyon gelişebilir, bu durum beyin ödemini artırır. Ajitasyon ve kontrol edilemeyen ağrı durumunda analjezi ve sedasyon sağlanmalıdır. Sedasyonda daha çok kısa etkili midazolam ya da kısa etkili benzodiazepinler düşük dozlarda kullanılabilir. İleri hepatik ensefalopati durumunda entübasyon öncesi ve entübasyon süresince propofol (50 g/kg/dk) kafa içi basıncını azaltmak amaçlı kullanılabilir (139).
Viral hepatit B’ye bağlı gelişen akut karaciğer yetmezliği, akut hepatit B’nin klinik seyri sırasında ya da KHB zemininde akut alevlenme şeklinde de olabilir (135,140). Akut viral hepatit B’ye bağlı akut karaciğer yetmezliği %4’ten az görülür, ancak mortalitesi diğer etiyolojilere göre daha yüksektir. Bu yüzden karaciğer yetmezliğinde kötü prognozu önlemek için antiviral tedavi başlanmalıdır (131). Dekompanzasyona neden olabileceğinden interferon önerilmezken, nükleoz(t)id analoglarından herhangi biri kullanılabilir. Önceki çalışmalarda en çok deneyim lamuvidinle olmasına rağmen son zamanlarda direnç bariyeri yüksek olan entekavir, tenofovir gibi diğer antiviraller de önerilmektedir (140-145). Hızlı viral baskılanmanın karaciğer hasarını artırdığını belirten az sayıda çalışma mevcuttur. Ancak antiviral tedavi başlanan olgularda mortalitenin daha düşük olduğunu gösteren çalışmaların sayısı her geçen gün artmaktadır. Özellikle nakil öncesi HBV DNA düzeyi ne kadar düşük olursa greftin infekte olma olasılığı o kadar azalır. Bu açıdan fülminan gidişli viral hepatit B infeksiyonlarında antiviral tedavi konusunda kesinleşmiş veri olmamakla birlikte özellikle direnç bariyeri yüksek antiviral tedavi kullanımı genel olarak kabul görmektedir. Akut hepatit B’ye bağlı gelişen fülminan hepatitte anti-HBs oluşumu sonrası üç ay, HBsAg kaybı yok ise anti-HBe oluşumundan sonra 12 ay daha nükleoz(t)id analogları verilmeye devam edilmelidir. KHB zemininde gelişen olgularda ise nükleoz(t)id analoglarına devam edilmelidir. (131,133,144).
Fülminan hepatit tedavisi antiviral tedavi dışında yakın izlem gerektirir. Hastalar; hemodinamilerinin korunması, sıvı desteği sağlanması, metabolik parametrelerinin yakın takibi, beslenme desteği, gerekirse solunum desteği ve gelişebilecek diğer infeksiyonların takibi için yoğun bakımda izlenmelidir. Hepatotoksik olacağı düşünülen asetaminofen gibi nonsteroid antiinflamatuar ilaçlardan mümkün oldukça kaçınılmalıdır (146,147).
Fülminan hepatitte renal fonksiyonlar da bozulmaya eğilimlidir. Yaş, hipotansiyon, araya giren infeksiyonlara bağlı olarak renal yetmezlik gözlenebilir. Karaciğer fonksiyon bozukluğuna bağlı olarak üre düşük düzeydedir ve yüksek bilirubin seviyesinde kreatin takibi yanıltıcı olabilir. Bu açıdan kreatin takibi yanında saatlik idrar çıkışı takibi yapılmalıdır. Nefrotoksik ajanlardan kaçınılmalıdır. Kreatin klirensi ile amonyak klirensi koreledir ve erken dönemde amonyak artışı ve hızlı ilerleyen hepatik ensefalopatinin renal yetmezlik açısından erken uyaran olduğu bilinmelidir. Hemodiyaliz ihtiyacı doğarsa, hastalara aralıklı değil sürekli hemodiyaliz başlanmalıdır. Özellikle aralıklı diyaliz hemodinamide hızlı değişikliklere yol açabileceğinden kafa içi basıncını etkileyebilir. Diyaliz gereken hastalarda antikoagülan ve laktat içermeyen diyaliz tamponları kullanılmasına özen gösterilmelidir (131).
Fülminan hepatitli hastalarda, oral alım azlığı, kusma ve vazodilatasyona bağlı sıvı replasman ihtiyacı doğar. Sıvı replasmanı yapılırken venöz basınç artışı, buna bağlı sağ kalp yetmezliği ve karaciğerde konjesyon gelişebileceği unutulmamalıdır. Bu yüzden hastanın aldığı çıkardığı sıvı takibi dikkatli yapılmalıdır. Periferik hipotansiyon, metabolik asidoz, oligüri ve renal yetmezlik ile kendini gösteren hiperlaktatemi ortaya çıkabilir; önlemek için kolloidal sıvı yerine kristaloidlerin kullanımı tercih edilmelidir (131).
Fülminan hepatitli hastalarda katabolizma gelişebileceğinden nütrisyon desteği de çok önemlidir. Hastalarda günlük 25-30 kcal/kg kalori hedeflenmelidir. Serum amonyak üretimini artırmamak için düşük protein içerikli beslenmeye geçilmelidir (protein alımı günde 1 gr/kg/gün). Amonyak üretimini artırabileceğinden glutamin verilmesinden kaçınılmalıdır. Ayrıca dallanmış yan zincire sahip aminoasitlerin diğer protein içerikli preparatlara üstünlüğü kanıtlanmamıştır (148). Derece I ve II’de oral ya da enteral beslenme sağlanmalıdır. Ayrıca hastaların kanamaya eğilimi olduğu için stres ülser profilaksisi de mutlaka yapılmalıdır. Enteral beslenme sırasında proton pompa inhibitör (PPI)’leri verilmesi önerilmektedir. Nazogastrik tüp takılması sırasında kafa içi basıncı artabileceğinden, sadece entübe sedatize hastalarda nazogastrik tüpten beslenme düşünülmelidir. Nazogastrik tüp takılması durumunda ise PPI’ler, erken dönem Clostridium difficile infeksiyonu ve ventilatör ilişkili infeksiyon riskini artıracağından kesilmelidir (131).
Oral alımın azalmasına, karaciğerden glukozun yetersiz salınımına ve glukoneogenezin bozulmasına bağlı olarak hipoglisemi gelişebilir; insülin yıkımının yetersiz olması sonucunda plazma insülinin artması da hipoglisemiye katkıda bulunur. Bu yüzden hastalara iki saatte bir kan glukoz takibi yapılmalı ve hipoglisemi varlığında intravenöz glukoz infüzyonu başlanmalıdır (1.5-2 g/kg/gün). Ancak hipergliseminin de kafa içi basıncını artırabileceği unutulmamalıdır. Kan glukoz seviyesinde istenen düzey yaklaşık 150-180 mg/dl’dir (131). Ayrıca hiponatremi, hipomagnezemi, hipofosfatemi, asit-baz denge bozukluğu da gözlenebilir. Hastalar yakın takip edilerek gerekli replasmanlar yapılmalıdır (132,133,135).
Fülminan hepatitli hastalarda immün sistemin zayıflaması, kompleman eksikliği, opsonizasyonda bozulma, bağırsakta bakteriyel translokasyonun artması gibi nedenlerden dolayı ciddi infeksiyon ve sepsis gelişebilir. En sık gözlenen infeksiyonlar sırasıyla; solunum yolu infeksiyonları, üriner sistem infeksiyonları ve kan dolaşımı infeksiyonlarıdır. Bakteriyel infeksiyonlar kadar fungal infeksiyonlar da sıktır; en fazla mortalite nedenlerinden olan infeksiyonların tanı ve tedavisinde dinamik olmak gerekir. Birçok uzman rutin testlerin yanında kan, idrar, balgam sürveyans kültürlerinin alınmasını, radyolojik inceleme yapılmasını önermektedir. Ciddi infeksiyon ile ileri hepatik ensefalopatisi olan hastaların klinikleri benzerdir ve infeksiyon atlanırsa mortalite artabilir. Bu yüzden ensefalopatinin hızlı ilerlemesi, refrakter hipotansiyon, sistemik inflamatuar yanıtın gelişmesi durumunda kültürler alınıp olası etkenler, bölge ve hastane antibiyotik direnç sürveyansı da göz önüne alınarak geniş spektrumlu ampirik antibiyotik başlanmalıdır. Tablo hızlı kötüleşiyor ise ampirik antifungal tedavi de eklenmelidir. Fülminan hepatitli hastalarda profilaktik antibiyotik tedavisi önerilmez (131,146).
Öneriler
- Hepatit B virusuna bağlı gelişen fülminan hepatitte tercihen direnç bariyeri yüksek bir antivirale gecikmeden başlanmalıdır. Akut hepatit B’ye bağlı gelişen fülminan hepatitte anti-HBs oluşumu sonrası üç ay, HBsAg kaybı yok ise anti-HBe oluşumundan sonra 12 ay daha nükleoz(t)id analogları verilmeye devam edilmelidir. KHB zemininde gelişen olgularda ise nükleoz(t)id analoglarına devam edilmelidir.
- Fülminan gidişli HBV infeksiyonunda interferon tedavisi kontrendikedir.
- Akut karaciğer yetmezliğinde koagülopatiyi düşündüren parametreler (INR >1.5 ve PTZ uzamış) ve hepatik ensefalopatiye gidişi düşündüren klinik bulgu varlığında hastalar karaciğer nakli yapabilecek merkezlere geç kalınmadan sevk edilmelidir.
- Ensefalopatinin erken dönemlerinde mümkün oldukça sedasyondan kaçınılmalıdır.
- Laktüloz ensefalopatinin erken dönemelerinde kullanılabilir. Ancak nakil ihtiyacı olan hastalarda batında distansiyona yol açabileceğinden nakil aşamasında kullanılmamalıdır.
- Ensefalopatiyi erken tanımlayabilmek için saatlik nörolojik muayene yapılmalıdır.
- Derece III ve derece IV ensefalopati gelişen hastalarda yatak başı 30° yukarıya kaldırılmalıdır.
- Serebral ödeme bağlı konvülsif nöbet gelişen hastalarda, fenitoin ya da kısa etkili benzodiazepinler tedaviye eklenmelidir. Profilaktik antikonvülzan ilaçlar önerilmez.
- Rutinde kafa içi basınç monitörizasyonu kanama riski nedeniyle önerilmez. Ancak ileri evre ensefalopatisi olan hastalarda takip edebilmek için monitörizasyon sağlanacak ise deneyimli merkezlerde yapılmalıdır.
- Kafa içi basınç artışı olan hastalarda ilk basamak mannitol tedavisidir (0.5-1.0 gr/kg intravenöz bolus tarzında), profilaktik amaçlı önerilmez. Mannitol uygulanırken renal fonksiyonlar yakın takip edilmelidir.
- Beyin ödemi riski yüksek olan (serum amonyağı >150 mikromol/lt), akut renal yetmezlik gelişen, derece III/IV ensefalopatisi olan ve vazopresör ihtiyacı olan hastalara hipertonik sodyum klorür önerisi mevcuttur (serum sodyum düzeyini 145-155 mEq/lt tutacak şekilde).
- Akut karaciğer yetmezliği olan hastalarda hipotansiyona eğilim vardır. Hipotansiyonu düzeltmek için kristaloid sıvılar tercih edilmelidir. Sıvı replasmanı sırasında yüklenmeye bağlı sağ kalp yetmezliği gelişebilir, dolayısıyla karaciğer konjesyonu artar ve klinik tablo kötüleşebilir. Bu yüzden sıvı replasmanı sırasında yüklenmeye dikkat edilmelidir.
- Sıvı replasmanına rağmen hipotansiyon devam ediyorsa vazopresör olarak norepinefrin tercih edilmelidir. Yine yanıt yok ise vazopressin ya da terlipresin eklenebilir.
- Akut renal yetmezlik gelişen hastalarda hemodiyaliz ihtiyacı var ise, ani kafa içi basınç değişikliklerine yol açmamak için sürekli hemodiyaliz tercih edilmelidir.
- Akut karaciğer yetmezliği olan hastalarda dolaşım desteğiyle ortalama arter basıncının ≥75 mmHg ve beyin perfüzyon basıncının 60-80 mmHg olması hedeflenir.
- Rutinde koagülopatiyi düzeltmek amacıyla replasman tedavisi önerilmez. Ancak hastanın aktif kanaması varsa ya da invazif bir işlem yapılacaksa replasman yapılmalıdır.
- Kan glikozu, elektrolitler yakın takip edilmeli ve gerekirse replasman yapılmalıdır.
- Bakteriyel ve fungal infeksiyonlara yatkınlık olduğundan hastalar yakın takip edilmeli, refrakter hipotansiyon, klinik tabloda hızlı kötüleşme varlığında geniş spektrumlu antibiyotik ve gerekiyorsa antifungal başlanmalıdır. Profilaktik antibiyotik kullanım önerisi yoktur.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – S.T., F.K., N.D.; Tasarım – S.T., F.K.; Denetleme – S.T., F.K.; Kaynak ve Fon Sağlama – N.D.; Malzemeler/Hastalar – SZ, F.K., U.D.B., İ.Ç., N.T., E.T., O.Y., E.Y., N.D.;
Veri Toplama ve/veya İşleme – SZ, F.K., U.D.B., İ.Ç., N.T., E.T., O.Y., E.Y., N.D.; Analiz ve/veya Yorum – SZ, F.K., U.D.B., İ.Ç., N.T., E.T., O.Y., E.Y., N.D.; Literatür Taraması – SZ, F.K., U.D.B., İ.Ç., N.T., E.T., O.Y., E.Y., N.D.; Makale Yazımı – SZ, F.K., U.D.B., İ.Ç., N.T., E.T., O.Y., E.Y., N.D.; Eleştirel İnceleme – N.D., S.T.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Mavilia MG, Wu GY. HBV-HCV coinfection: Viral interactions, management, and viral reactivation. J Clin Transl Hepatol. 2018;6(3):296-305. [CrossRef]
- Abdelaal R, Yanny B, El Kabany M. HBV/HCV coinfection in the era of HCV-DAAs. Clin Liver Dis. 2019;23(3):463-72. [CrossRef]
- Konstantinou D, Deutsch M. The spectrum of HBV/HCV coinfection: epidemiology, clinical characteristics, viral interactions and management. Ann Gastroenterol. 2015;28(2):221-8.
- Shih YF, Liu CJ. Hepatitis C virus and hepatitis B virus co-infection. Viruses. 2020;12(7):741. [CrossRef]
- Aygen B, Çelen MK, Köksal İ, et al. The prevalence and epidemiological characteristics of hepatitis B virus and hepatitis C virus coinfection in Turkey. Türkiye Klinikleri J Med Sci. 2013;33(5):1245-9. [CrossRef]
- Yılmaz-Karadağ F. Investigation of hepatitis B virus seroprevalence in hepatitis C infected patients. Turk Hij Den Biyol Derg. 2017;74(4):287-92. [CrossRef]
- Şenol FF, Bahçeci İ, Arslan N, et al. Investigation of anti-HBs, HBsAg positivity in patients infected with hepatitis C virus. J Immunol and Clin Microbiol. 2021;6(2):90-6.
- Fidan I, Çuhadar T, Koç Z, Karakuş R. [Detection of the prevalence of HBV/HCV coinfection in anti-HCV-positive samples]. Klimik Derg. 2018;31(1):16-9. Turkish. [CrossRef]
- Papadopoulos N, Papavdi M, Pavlidou A, et al. Hepatitis B and C coinfection in a real-life setting: viral interactions and treatment issues. Ann Gastroenterol. 2018;31(3):365-70. [CrossRef]
- Yan BM, Lee SS. Acute coinfection with hepatitis B and hepatitis C viruses. Can J Gastroenterol. 2005;19(12):729-30. [CrossRef]
- Caccamo G, Saffioti F, Raimondo G. Hepatitis B virus and hepatitis C virus dual infection. World J Gastroenterol. 2014;20(40):14559-67. [CrossRef]
- Sagnelli E, Coppola N, Pisaturo M, et al. HBV superinfection in HCV chronic carriers: a disease that is frequently severe but associated with the eradication of HCV. Hepatology. 2009;49(4):1090-7. [CrossRef]
- Sagnelli E, Sagnelli C, Macera M, Pisaturo M, Coppola N. An update on the treatment options for HBV/HCV coinfection. Expert Opin Pharmacother. 2017;18(16):1691-702. [CrossRef]
- El-Maksoud MA, Habeeb MR, Ghazy HF, et al. Clinicopathological study of occult hepatitis B virus infection in hepatitis C virus-associated hepatocellular carcinoma. Eur J Gastroenterol Hepatol. 2019;31(6):716-22. [CrossRef]
- Saitta C, Pollicino T, Raimondo G. Occult hepatitis B virus infection: An update. viruses. 2022;14(7):1504. [CrossRef]
- Chopra S, Pockros PJ. Overview of the management of chronic hepatitis C virus infection [Internet]. UpToDate. [erişim 13 Ocak 2023]. https://www.uptodate.com/contents/overview-of-the-management-of-chronic-hepatitis-c-virus-infection
- Pawlotsky JM, Negro F, Aghemo A, et al. European Association For The Study Of The Liver. Corrigendum to ‘EASL recommendations on treatment of hepatitis C: Final update of the series’ [J Hepatol 73 (2020) 1170-218]. J Hepatol. 2023;78(2):452. Erratum for: J Hepatol. 2020;73(5):1170-218. [CrossRef]
- Lampertico P, Agarwal K, Berg T, et al. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatology. 2017;67(2):370-98. [CrossRef]
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99. [CrossRef]
- Butt AA, Yan P, Aslam S, et al. Hepatitis C virologic response in hepatitis B and C coinfected persons treated with directly acting antiviral agents: Results from ERCHIVES. Int J Infect Dis. 2020;92:184-8. [CrossRef]
- Jiang XW, Ye JZ, Li YT, Li LJ. Hepatitis B reactivation in patients receiving direct-acting antiviral therapy or interferon-based therapy for hepatitis C: A systematic review and meta-analysis. World J Gastroenterol. 2018;24(28):3181-91. [CrossRef]
- Pisaturo M, Macera M, Alessio L, Calò F, Coppola N. Hepatitis B virus (HBV) reactivation following pharmacological eradication of hepatitis C virus (HCV). Viruses. 2019;11(9):850. [CrossRef]
- Yeh ML, Huang CF, Huang CI, et al. Hepatitis B-related outcomes following direct-acting antiviral therapy in Taiwanese patients with chronic HBV/HCV co-infection. J Hepatol. 2020;73(1):62-71. [CrossRef]
- Su YT, Chang ML, Chien RN, Liaw YF. Hepatitis C virus reactivation in anti-HCV antibody-positive patients with chronic hepatitis B following anti-HBV therapies. Viruses. 2022;14(9):1858. [CrossRef]
- Estimated number of people (all ages) living with HIV [Internet]. Geneva: World Health Organization (WHO). [erişim 26 Eylül 2022]. https://www.who.int/data/gho/data/indicators/indicator-details/GHO/estimated-number-of-people–living-with-hiv
- Shahriar S, Araf Y, Ahmad R, et al. Insights into the coinfections of human immunodeficiency virus-hepatitis B virus, human immunodeficiency virus-hepatitis C virus, and hepatitis B virus-hepatitis C virus: Prevalence, risk factors, pathogenesis, diagnosis, and treatment. Front Microbiol. 2022;12:780887. [CrossRef]
- Weldemhret L. Epidemiology and challenges of HBV/HIV co-infection amongst HIV-infected patients in endemic areas: Review. HIV AIDS (Auckl). 2021;13:485-90. [CrossRef]
- McGovern BH. The epidemiology, natural history and prevention of hepatitis B: implications of HIV coinfection. Antivir Ther. 2007;12 Suppl 3:H3-13.
- Bivigou-Mboumba B. Human immunodeficiency virus-hepatitis B virus (HIV-HBV) coinfection [Internet]. Advances in HIV and AIDS Control. IntechOpen; 2018. [erişim 10 Ekim 2022]. [CrossRef]
- Wandeler G, Gsponer T, Bihl F, et al; Swiss HIV Cohort Study. Hepatitis B virus infection is associated with impaired immunological recovery during antiretroviral therapy in the Swiss HIV cohort study. J Infect Dis. 2013;208(9):1454-8. [CrossRef]
- Singh KP, Crane M, Audsley J, Avihingsanon A, Sasadeusz J, Lewin SR. HIV-hepatitis B virus coinfection: epidemiology, pathogenesis, and treatment. AIDS. 2017;31(15):2035-52. [CrossRef]
- Lee JE, Lee JM, Lee KB, et al. Noninvasive assessment of hepatic fibrosis in patients with chronic hepatitis B viral infection using magnetic resonance elastography. Korean J Radiol. 2014;15(2):210-7. [CrossRef]
- Fasano M, Poliseno MC, Fiore JR, et al. Management of chronic hepatitis B in HIV-coinfected patients. Viruses. 2022;14(9):2022. [CrossRef]
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in adults and adolescents with HIV [Internet]. Washington: U.S. Department of Health and Human Services (HHS)(Clinicalinfo.HIV.gov.). [erişim 31 Aralık 2022]. https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-opportunistic-infections/hepatitis-b-0?view=full
- Hepatitis B virus co-infection [Internet]. Sydney: Australian Society for HIV, Viral Hepatitis and Sexual Health Medicine (ASHM). [erişim 11 Ocak 2023]. https://hivmanagement.ashm.org.au/hepatitis-b-virus-co-infection/management/
- EACS Guidelines Version 11.0 October 2021 [Internet]. Brussels: European AIDS Clinical Society (EACS). [erişim 31 Aralık 2022]. https://www.eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf
- Antiretroviral Guidelines: Hepatitis B virus/HIV coinfection [Internet]. Sydney: Australian Society for HIV Medicine (ASHM). [erişim 20 Ocak 2023]. https://arv.ashm.org.au/hepatitis-b-virus-hiv-coinfection/
- Kim HN. Chronic hepatitis b and HIV coinfection: a continuing challenge in the era of antiretroviral therapy. Curr Hepatol Rep. 2020;19(4):345-53. [CrossRef]
- Bertolli MR, Rocha PA, Pinto VB, Ono SK. Access to antiviral therapy for chronic hepatitis B during COVID-19. Rev Assoc Med Bras (1992). 2022;68(11):1509-13. [CrossRef]
- Ford N, Scourse R, Lemoine M, et al. Adherence to nucleos(t)ide analogue therapies for chronic hepatitis B infection: A systematic review and meta-analysis. Hepatol Commun. 2018;2(10):1160-7. [CrossRef]
- WHO Director-General’s opening remarks at the media briefing on COVID-19-11 March 2020 [Internet]. Geneva: World Health Organization (WHO). [erişim 26 Eylül 2022]. https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020
- Garrido I, Liberal R, Macedo G. Review article: COVID-19 and liver disease-what we know on 1st May 2020. Aliment Pharmacol Ther. 2020;52(2):267-75. [CrossRef]
- Clinical best practice advice for hepatology and liver transplant providers during the COVID-19 pandemic: AASLD expert panel consensus statement [Internet].Alexandria: American Association for the Study of Liver Diseases (AASLD). [erişim 31 Aralık 2022]. https://www.aasld.org/sites/default/files/2022-04/AASLD%20COVID-19%20Expert%20Panel%20Consensus%20Statement%20Update%2011.02.2021%20%281%29.pdf
- Bangash MN, Patel J, Parekh D. COVID-19 and the liver: little cause for concern. Lancet Gastroenterol Hepatol. 2020;5(6):529-30. [CrossRef]
- Zhang C, Shi L, Wang FS. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol Hepatol. 2020;5(5):428-30. [CrossRef]
- Tian Y, Rong L, Nian W, He Y. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther. 2020;51(9):843-51. [CrossRef]
- Sun J, Aghemo A, Forner A, Valenti L. COVID-19 and liver disease. Liver Int. 2020;40(6):1278-81. [CrossRef]
- Members of the Hepatology Interest Group of WGO. Guidance for patients with COVID-19 and liver disease [Internet]. Milwaukee: World Gastroenterology Organization. [erişim 26 Eylül 2022]. https://www.worldgastroenterology.org/UserFiles/file/COVID19/WGO_200601_DACYKBNRDVLBMMCleanCOVID19andLiverDisease.pdf
- Alqahtani SA, Buti M. COVID-19 and hepatitis B infection. Antivir Ther. 2020;25(8):389-97. [CrossRef]
- Ekpanyapong S, Bunchorntavakul C, Reddy KR. COVID-19 and the liver: Lessons learnt from the EAST and the WEST, a year later. J Viral Hepat. 2022;29(1):4-20. [CrossRef]
- Kang SH, Cho DH, Choi J, Baik SK, Gwon JG, Kim MY. Association between chronic hepatitis B infection and COVID-19 outcomes: A Korean nationwide cohort study. PLoS One. 2021;16(10):e0258229. [CrossRef]
- Ahmed J, Rizwan T, Malik F, et al. COVID-19 and liver injury: A systematic review and meta-analysis. Cureus. 2020;12(7):e9424. [CrossRef]
- Tekin S, Sümer Ş, Demirtürk N, Aygen B. [Chronic hepatitis C in the pandemic]. Klimik Derg. 2021;34(1):13-7. Turkish. [CrossRef]
- Boettler T, Marjot T, Newsome PN, et al. Impact of COVID-19 on the care of patients with liver disease: EASL-ESCMID position paper after 6 months of the pandemic. JHEP Rep. 2020;2(5):100169. [CrossRef]
- Yılmaz G. Kronik hepatit tanısında invazif ve invazif olmayan testlerin karşılaştırılması. In: Tabak F, Tosun S, eds. Viral Hepatit 2013. 1. Baskı. İstanbul Medikal Sağlık ve Yayıncılık Hiz. Tic.Ltd.Şti. 2013; 201-13.
- Tabak F, Yurdaydın C, Kaymakoğlu S, et al.; Guidelines Study Group VH. Diagnosis, management and treatment of hepatitis B virus infection: Turkey 2017 Clinical Practice Guidelines. Turk J Gastroenterol. 2017;28(Suppl 2):73-83. [CrossRef]
- Akhan S, Aynıoğlu A, Çağatay A, et al. [Management of chronic hepatitis B virus infection: A consensus report of the Study Group for Viral Hepatitis of the Turkish Society of Clinical Microbiology and Infectious Diseases]. Klimik Derg. 2014;27(Özel Sayı 1):2-18. Turkish. [CrossRef]
- Lobstein S, Faber R, Tillmann HL. Prevalence of hepatitis B among pregnant women and its impact on pregnancy and newborn complications at a tertiary hospital in the eastern part of Germany. Digestion. 2011;83(1-2):76-82. [CrossRef]
- Lao TT, Chan BC, Leung WC, Ho LF, Tse KY. Maternal hepatitis B infection and gestational diabetes mellitus. J Hepatol. 2007;47(1):46-50. [CrossRef]
- Reddick KL, Jhaveri R, Gandhi M, James AH, Swamy GK. Pregnancy outcomes associated with viral hepatitis. J Viral Hepat. 2011;18(7):e394-8. [CrossRef]
- Safir A, Levy A, Sikuler E, Sheiner E. Maternal hepatitis B virus or hepatitis C virus carrier status as an independent risk factor for adverse perinatal outcome. Liver Int. 2010;30(5):765-70. [CrossRef]
- Krajden M, McNabb G, Petric M. The laboratory diagnosis of hepatitis B virus. Can J Infect Dis Med Microbiol. 2005;16(2):65-72. [CrossRef]
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Lee H, Lok A SF. Hepatitis and pregnancy [Internet]. UpToDate. [erişim 01 Mayıs 2023] https://www.uptodate.com/contents/hepatitis-b-and-pregnancy
- Han GR, Xu CL, Zhao W, Yang YF. Management of chronic hepatitis B in pregnancy. World J Gastroenterol. 2012;18(33):4517-21. [CrossRef]
- Gouraud A, Millaret A, Bernard N, et al. Tenofovir exposure through breast feeding: Serum concentrations in neonates and clinical follow-up. Fundam Clin Pharmacol. 2012;26 (Suppl 1):9. [CrossRef]
- Tekin-Koruk S, Batirel A, Kose S, et al. Evaluation of hepatitis B virus transmission and antiviral therapy among hepatitis B surface antigen-positive pregnant women. J Obstet Gynaecol Res. 2015;41(12):1870-6. [CrossRef]
- Yi Z, Jie YW, Nan Z. The efficacy of anti-viral therapy on hepatitis B virus-associated glomerulonephritis: A systematic review and meta-analysis. Ann Hepatol. 2011;10(2):165-73.
- Pipili CL, Papatheodoridis GV, Cholongitas EC. Treatment of hepatitis B in patients with chronic kidney disease. Kidney Int. 2013;84(5):880-5. [CrossRef]
- Marzano A, Angelucci E, Andreone P, et al; Italian Association for the Study of the Liver. Prophylaxis and treatment of hepatitis B in immunocompromised patients. Dig Liver Dis. 2007;39(5):397-408. [CrossRef]
- Papatheodoridis GV. Treatment of HBeAg-negative chronic hepatitis B patients with nucleos(t)ide analogues. Liver Int. 2011;31 Suppl 1:95-103. Erratum in: Liver Int. 2011;31(5):748. [CrossRef]
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney inter., Suppl. 2012;2:139–274.
- Mesquita M, Lasser L, Langlet P. Long-term (7-year-) treatment with lamivudine monotherapy in HBV-associated glomerulonephritis. Clin Nephrol. 2008;70(1):69-71. [CrossRef]
- Wong PN, Mak SK, Wong AK. Management of chronic hepatitis B infection in patients with end-stage renal disease and dialysis. Hep B Annual. 2006;3:76-105.
- Lai CL, Ratziu V, Yuen MF, Poynard T. Viral hepatitis B. Lancet. 2003;362(9401):2089-94. [CrossRef]
- Wong PN, Fung TT, Mak SK, et al. Hepatitis B virus infection in dialysis patients. J Gastroenterol Hepatol. 2005;20(11):1641-51. [CrossRef]
- Fabrizi F, Messa P, Dixit V, Martin P. Therapy with nucleos(t)ide analogues: current role in dialysis patients. Int J Artif Organs. 2010;33(6):329-38.
- Tseng GY, Lin HJ, Fang CT, et al. Hemodialysis reduces the viral load in uremic patients with chronic hepatitis B infection. Ren Fail. 2008;30(10):1000-5. [CrossRef]
- Pipili C, Cholongitas E, Papatheodoridis G. Review article: nucleos(t)ide analogues in patients with chronic hepatitis B virus infection and chronic kidney disease. Aliment Pharmacol Ther. 2014;39(1):35-46. [CrossRef]
- Petersen J, Buti M. Considerations for the long-term treatment of chronic hepatitis B with nucleos(t)ide analogs. Expert Rev Gastroenterol Hepatol. 2012;6(6):683-93. [CrossRef]
- Duarte R, Huraib S, Said R, et al. Interferon-alpha facilitates renal transplantation in hemodialysis patients with chronic viral hepatitis. Am J Kidney Dis. 1995;25(1):40-5. [CrossRef]
- Cholongitas E, Tziomalos K, Pipili C. Management of patients with hepatitis B in special populations. World J Gastroenterol. 2015;21(6):1738-48. [CrossRef]
- Asari A, Iles-Smith H, Chen YC, et al. Pharmacokinetics of lamivudine in subjects receiving peritoneal dialysis in end-stage renal failure. Br J Clin Pharmacol. 2007;64(6):738-44. [CrossRef]
- Lapinski TW, Flisiak R, Jaroszewicz J, Michalewicz M, Kowalczuk O. Efficiency and safety of lamivudine therapy in patients with chronic HBV infection, dialysis or after kidney transplantation. World J Gastroenterol. 2005;11(3):400-2. [CrossRef]
- Fontaine H, Thiers V, Chrétien Y, et al. HBV genotypic resistance to lamivudine in kidney recipients and hemodialyzed patients. Transplantation. 2000;69(10):2090-4. [CrossRef]
- Schiff ER, Lai CL, Hadziyannis S, et al.; Adefovir Dipovoxil Study 435 International Investigators Group. Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre- and post-liver transplantation patients. Hepatology. 2003;38(6):1419-27. [CrossRef]
- McKeage K, Keam SJ. Telbivudine: a review of its use in compensated chronic hepatitis B. Drugs. 2010;70(14):1857-83. [CrossRef]
- Zhou XJ, Swan S, Smith WB, et al. Pharmacokinetics of telbivudine in subjects with various degrees of renal impairment. Antimicrob Agents Chemother. 2007;51(12):4231-5. [CrossRef]
- Lok AS, McMahon BJ. Chronic hepatitis B: update 2009. Hepatology. 2009;50(3):661-2. [CrossRef]
- Marcellin P, Heathcote EJ, Buti M, et al. Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B. N Engl J Med. 2008;359(23):2442-55. [CrossRef]
- Izzedine H, Launay-Vacher V, Jullien V, Aymard G, Duvivier C, Deray G. Pharmacokinetics of tenofovir in haemodialysis. Nephrol Dial Transplant. 2003;18(9):1931-3. [CrossRef]
- Kearney BP, Yale K, Shah J, Zhong L, Flaherty JF. Pharmacokinetics and dosing recommendations of tenofovir disoproxil fumarate in hepatic or renal impairment. Clin Pharmacokinet. 2006;45(11):1115-24. [CrossRef]
- Patel SM, Zembower TR, Palella F, Kanwar YS, Ahya SN. Early onset of tenofovir-induced renal failure: case report and review of the literature. Sci World J. 2007;7:1140-8. [CrossRef]
- Liaw YF, Sheen IS, Lee CM, et al. Tenofovir disoproxil fumarate (TDF), emtricitabine/TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease. Hepatology. 2011;53(1):62-72. [CrossRef]
- Custodio JM, Fordyce M, Garner W, et al. Pharmacokinetics and safety of tenofovir alafenamide in HIV-uninfected subjects with severe renal impairment. Antimicrob Agents Chemother. 2016;60(9):5135-40. [CrossRef]
- Ridruejo E, Adrover R, Alonso C, et al. Entecavir in the treatment of chronic hepatitis B in end stage renal disease and kidney transplantation. Dial Transplant. 2010;39:397-400. [CrossRef]
- Yuen MF, Seto WK, Fung J, Wong DK, Yuen JC, Lai CL. Three years of continuous entecavir therapy in treatment-naïve chronic hepatitis B patients: VIRAL suppression, viral resistance, and clinical safety. Am J Gastroenterol. 2011;106(7):1264-71. [CrossRef]
- Leung N. Recent data on treatment of chronic hepatitis B with nucleos(t)ide analogues. Hepatol Int. 2008;2(2):163-78. [CrossRef]
- Orfanidou A, Papatheodoridis GV, Cholongitas E. Antiviral prophylaxis against hepatitis B recurrence after liver transplantation: Current concepts. Liver Int. 2021;41(7):1448-61. [CrossRef]
- Stanaway JD, Flaxman AD, Naghavi M, et al. The global burden of viral hepatitis from 1990 to 2013: findings from the Global Burden of Disease Study 2013. Lancet. 2016;388(10049):1081-8. [CrossRef]
- Akarsu M, Onem S, Turan I, et al. Recommendations for hepatitis B immunoglobulin and antiviral prophylaxis against hepatitis B recurrence after liver transplantation. Turk J Gastroenterol. 2021;32(9):712-9. [CrossRef]
- Te H, Doucette K. Viral hepatitis: Guidelines by the American Society of Transplantation Infectious Disease Community of Practice. Clin Transplant. 2019;33(9):e13514. [CrossRef]
- Nasir M, Wu GY. Prevention of HBV recurrence after liver transplant: A review. J Clin Transl Hepatol. 2020;8(2):150-60. [CrossRef]
- Marzano A, Gaia S, Ghisetti V, et al. Viral load at the time of liver transplantation and risk of hepatitis B virus recurrence. Liver Transpl. 2005;11(4):402-9. [CrossRef]
- Wang P, Tam N, Wang H, et al. Is hepatitis B immunoglobulin necessary in prophylaxis of hepatitis B recurrence after liver transplantation? A meta-analysis. PLoS One. 2014;9(8):e104480. [CrossRef]
- Chauhan R, Lingala S, Gadiparthi C, et al. Reactivation of hepatitis B after liver transplantation: Current knowledge, molecular mechanisms and implications in management. World J Hepatol. 2018;10(3):352-70. [CrossRef]
- Verna EC. Updated Hepatitis B Guidance: Implications for liver transplant patients. Liver Transpl. 2018;24(4):465-9. [CrossRef]
- Duvoux C, Belli LS, Fung J, et al. 2020 position statement and recommendations of the European Liver and Intestine Transplantation Association (ELITA): management of hepatitis B virus-related infection before and after liver transplantation. Aliment Pharmacol Ther. 2021;54(5):583-605. [CrossRef]
- Darweesh SK, Gad AA, Akroof K, ElLatif ZA. Entecavir and other nucleos(t)ide analogs prophylaxis in hepatitis B virus-related liver transplantation: long-term efficacy and safety. Eur J Gastroenterol Hepatol. 2019;31(5):607-12. [CrossRef]
- Saab S, Song D, Challita YP, et al. Long-term outcomes with oral therapy in liver transplant recipients with hepatitis B. Clin Transplant. 2019;33(12):e13740. [CrossRef]
- Onoe T, Tahara H, Tanaka Y, Ohdan H. Prophylactic managements of hepatitis B viral infection in liver transplantation. World J Gastroenterol. 2016;22(1):165-75. [CrossRef]
- Fung J, Wong T, Chok K, et al. Long-term outcomes of entecavir monotherapy for chronic hepatitis B after liver transplantation: Results up to 8 years. Hepatology. 2017;66(4):1036-44. [CrossRef]
- Ikeda A, Takaki A, Yasunaka T, et al. Predictive factors for successful vaccination against hepatitis B surface antigen in patients who have undergone orthotopic liver transplantation. Acta Med Okayama. 2019;73(1):41-50. [CrossRef]
- Cholongitas E, Papatheodoridis GV, Burroughs AK. Liver grafts from anti-hepatitis B core positive donors: a systematic review. J Hepatol. 2010;52(2):272-9. [CrossRef]
- Ayoub WS, Martin P, Bhamidimarri KR. Hepatitis B virus infection and organ transplantation. Gastroenterol Hepatol (NY). 2018;14(1):33-40.
- Yang Y, Huang A, Zhao Y. Effect of hepatitis B surface antibody in patients with core antibody-positive liver transplantation: a systematic review and meta-analysis. Hepatol Int. 2020;14(2):202-11. [CrossRef]
- Saab S, Waterman B, Chi AC, Tong MJ. Comparison of different immunoprophylaxis regimens after liver transplantation with hepatitis B core antibody-positive donors: a systematic review. Liver Transpl. 2010;16(3):300-7. [CrossRef]
- Lang J, Neumann-Haefelin C, Thimme R. Immunological cure of HBV infection. Hepatol Int. 2019;13(2):113-24. [CrossRef]
- Lau G, Yu ML, Wong G, et al. APASL clinical practice guideline on hepatitis B reactivation related to the use of immunosuppressive therapy. Hepatol Int. 2021;15(5):1031-48. Erratum in: Hepatol Int. 2022;16(2):486-7. [CrossRef]
- Aygen B, Demir AM, Gümüş M, et al. Immunosuppressive therapy and the risk of hepatitis B reactivation: Consensus report. Turk J Gastroenterol. 2018;29(3):259-69. [CrossRef]
- Loomba R, Liang TJ. Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: Current concepts, management strategies, and future directions. Gastroenterology. 2017;152(6):1297-309. [CrossRef]
- Fraenkel L, Bathon JM, England BR, et al. 2021 American College of Rheumatology Guideline for the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken). 2021;73(7):924-39. [CrossRef]
- Su J, Lim JK. Hepatitis B virus reactivation in the setting of immunosuppressive drug therapy. Gastroenterol Hepatol (NY). 2019;15(11):585-92.
- Papatheodoridis GV, Lekakis V, Voulgaris T, et al. Hepatitis B virus reactivation associated with new classes of immunosuppressants and immunomodulators: a systematic review, meta-analysis, and expert opinion. J Hepatol. 2022;77(6):1670-89. [CrossRef]
- Lok AS, Bonis PAL. Hepatitis B virus reactivation associated with immunosuppressive therapy [Internet]. UpToDate. [erişim 8 Mart 2023]. https://www.uptodate.com/contents/hepatitis-b-virus-reactivation-associated-with-immunosuppressive-therapy
- Immunization of immunocompromised persons: Canadian Immunization Guide [Internet]. Ottowa: Public Health Agency of Canada. [erişim 15 Mart 2023]. https://www.canada.ca/en/public-health/services/publications/healthy-living/canadian-immunization-guide-part-3-vaccination-specific-populations/page-8-immunization-immunocompromised-persons.html
- Aktuğ Demir N. İmmünosüpresif veya sitotoksik tedavi alan hastalarda HBV profilaksisi ve tedavisi. In: Akhan S (ed). Hepatit B Rehber Güncelleme. Kocaeli Üniversitesi Vakfı Yayınları, 2021; 44-7.
- Etienne S, Vosbeck J, Bernsmeier C, Osthoff M. Prevention of hepatitis B reactivation in patients receiving immunosuppressive therapy: A case series and appraisal of society guidelines. J Gen Intern Med. 2023;38(2):490-501. [CrossRef]
- Nakaya A, Fujita S, Satake A, et al. Delayed HBV reactivation in rituximab-containing chemotherapy: How long should we continue anti-virus prophylaxis or monitoring HBV-DNA? Leuk Res. 2016;50:46-9. [CrossRef]
- Kaewdech A, Tangkijvanich P, Sripongpun P, et al. Hepatitis B surface antigen, core-related antigen and HBV RNA: Predicting clinical relapse after NA therapy discontinuation. Liver Int. 2020;40(12):2961-71. [CrossRef]
- European Association for the Study of the Liver. EASL Clinical Practical Guidelines on the management of acute (fulminant) liver failure. J Hepatol. 2017;66(5):1047-81. [CrossRef]
- Polson J, Lee WM; American Association for the Study of Liver Disease. AASLD position paper: the management of acute liver failure. Hepatology. 2005;41(5):1179-97. [CrossRef]
- Sarin SK, Kumar A, Almeida JA, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the study of the liver (APASL). Hepatol Int. 2009;3(1):269-82. [CrossRef]
- O’Grady JG, Schalm SW, Williams R. Acute liver failure: redefining the syndromes. Lancet. 1993;342(8866):273-5. Erratum in: Lancet. 1993;342(8877):1000. [CrossRef]
- Ichai P, Samuel D. Etiology and prognosis of fulminant hepatitis in adults. Liver Transpl. 2008;14 Suppl 2:S67-79. [CrossRef]
- Muñoz SJ. Difficult management problems in fulminant hepatic failure. Semin Liver Dis. 1993;13(4):395-413. [CrossRef]
- Lee WM, Stravitz RT, Larson AM. Introduction to the revised American Association for the Study of Liver Diseases Position Paper on acute liver failure 2011. Hepatology. 2012;55(3):965-7. [CrossRef]
- Karvellas CJ, Todd Stravitz R, Battenhouse H, Lee WM, Schilsky ML; US Acute Liver Failure Study Group. Therapeutic hypothermia in acute liver failure: a multicenter retrospective cohort analysis. Liver Transpl. 2015;21(1):4-12. [CrossRef]
- Basile AS, Hughes RD, Harrison PM, et al. Elevated brain concentrations of 1,4-benzodiazepines in fulminant hepatic failure. N Engl J Med. 1991;325(7):473-8. [CrossRef]
- Seto WK, Lai CL, Yuen MF. Acute-on-chronic liver failure in chronic hepatitis B. J Gastroenterol Hepatol. 2012;27(4):662-9. [CrossRef]
- Sun LJ, Yu JW, Zhao YH, Kang P, Li SC. Influential factors of prognosis in lamivudine treatment for patients with acute-on-chronic hepatitis B liver failure. J Gastroenterol Hepatol. 2010;25(3):583-90. [CrossRef]
- Tsang SW, Chan HL, Leung NW, et al. Lamivudine treatment for fulminant hepatic failure due to acute exacerbation of chronic hepatitis B infection. Aliment Pharmacol Ther. 2001;15(11):1737-44. [CrossRef]
- Chan HL, Tsang SW, Hui Y, Leung NW, Chan FK, Sung JJ. The role of lamivudine and predictors of mortality in severe flare-up of chronic hepatitis B with jaundice. J Viral Hepat. 2002;9(6):424-8. [CrossRef]
- Coffin CS, Fung SK, Alvarez F, et al. Management of hepatitis B virus infection: 2018 Guidelines from the Canadian Association for the Study of Liver Disease and Association of Medical Microbiology and Infectious Disease Canada. Can Liver J. 2018;1(4):156-217. [CrossRef]
- Tillmann HL, Zachou K, Dalekos GN. Management of severe acute to fulminant hepatitis B: to treat or not to treat or when to treat? Liver Int. 2012;32(4):544-53. [CrossRef]
- Kumar R, Bhatia V. Structured approach to treat patients with acute liver failure: A hepatic emergency. Indian J Crit Care Med. 2012;16(1):1-7. [CrossRef]
- Wang G, Duan Z. Guidelines for prevention and treatment of chronic hepatitis B. J Clin Transl Hepatol. 2021;9(5):769-91. [CrossRef]
- Naylor CD, O’Rourke K, Detsky AS, Baker JP. Parenteral nutrition with branched-chain amino acids in hepatic encephalopathy. A meta-analysis. Gastroenterology. 1989;97(4):1033-42. [CrossRef]