En Çok Okunanlar
Özet
Doğrudan etkili antiviral (DEA) ilaçlar hepatit C hastalarında tedavinin etkinliğini artırmıştır. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu tarafından, ilki 2014 yılında yayımlanan ve 2017 yılında güncellenen hepatit C virusu (HCV) infeksiyonunun yönetimine ilişkin uzlaşı raporunun, dünyadaki gelişmeler ve ülkemizde kullanıma giren yeni DEA’lar nedeniyle güncellemesi ihtiyacı doğmuştur. Çalışma Grubu kronik hepatit C’yi her yönü ile yeniden gözden geçirerek uzlaşı raporunu güncel bilgilerle yeniden düzenledi. Her bir konunun sonunda ülkemizde geri ödemesi olan ilaçlar da dikkate alınarak üzerinde uzlaşılan öneriler özet olarak verildi.
EPİDEMİYOLOJİ
Hepatit C virusu (HCV) infeksiyonu küresel olarak önemli bir halk sağlığı sorunudur. Dünya Sağlık Örgütü (DSÖ) tarafından 2015 yılında küresel nüfusun %1’i olan 71 milyon kişinin HCV infeksiyonu ile yaşadığı, 399 000 kişinin HCV infeksiyonunun neden olduğu siroz veya hepatoselüler karsinom (HSK)’dan dolayı öldüğü ve 1.75 milyon yeni HCV infeksiyonu geliştiği bildirilmiştir (1-3).
Gelişmiş ülkelerde, genel popülasyonda HCV prevalansı %1-2’dir. Küresel olarak tüm HCV infeksiyonlarının %80’i 31 ülkede saptanmaktadır. Tüm infeksiyonların %50’sinden fazlası, Çin, Pakistan, Nijerya, Mısır, Hindistan ve Rusya gibi ülkelerde görülmektedir. Birçok ülkedeki yaygınlık verileri düşük kalitede olup sürekli yeniden değerlendirme yapılması gerekmektedir (3).
Küresel popülasyonda; HCV infeksiyonunun, 50 yaş üstü ve 20-40 yaş aralığındaki kişilerde olmak üzere iki modlu yaş dağılımı nedeniyle, bu gruplarda prevalans daha yüksektir. Damar içi opioid salgını genç popülasyondaki yeni infeksiyonların en önemli nedenidir. Yaklaşık 2.3 milyon kişi HCV ve “human immunodeficiency virus” (HIV) ile koinfektedir; erkeklerle seks yapan erkekler (men who have sex with men – MSM) ve damar içi madde kullanan kişilerde yaygınlık belirgin şekilde daha yüksektir. Dünya çapında yaklaşık 3.5 milyon çocuk HCV ile infektedir (3).
Dünya Sağlık Örgütü, 2016’da viral hepatitleri bir halk sağlığı tehdidi olarak tanımlamış, 2030 yılına kadar insidansta %90 azalma ve mortalitede %65 azalmayı öneren Küresel Sağlık Sektörü Stratejisi’ni onaylamıştır. Bir halk sağlığı tehdidi olarak viral hepatitlerin ortadan kaldırılması için geliştirilen bu stratejide, infekte olan kişilerin %90’ının teşhis edilmesi ve teşhis edilenlerin %80’inin tedavi edilmesi gerektiği bildirilmektedir (1-3). Bu hedefi gerçekleştirebilmek için ilk strateji olarak, ilerlemiş kronik hepatit C (KHC) infeksiyonu olan kişileri tedavi etmek yerine, tüm hastalarda güvenli ve son derece etkili olan doğrudan etkili antiviral (DEA) ilaç tedavisi kullanımı önerilmiştir. 2016 yılından bu yana geri ödeme kurumları tarafından tedavi kararını belirlemede talep edilen genotiplendirme gereksiniminin yeni pangenotipik DEA ilaçlar ile azaltılmış olması ikinci stratejinin temelini oluşturmaktadır. Bir diğer önemli nokta ise, DEA ilaçların fiyatının sürekli olarak düşmesi sayesinde tedavinin düşük ve orta gelirli ülkelerde hızla yaygınlaşabilmesidir (2-3).
Doğrudan etkili antiviral tedavi yüksek ve kalıcı viral yanıt (KVY) sağlar. KHC infeksiyonu tedavisi için DEA ilaçların etkinliğine ilişkin sistematik incelemeler, KVY oranlarının genel olarak %95’i aştığını göstermektedir (4). Kalıcı viral yanıt hastalığın HSK’ye ilerleme riskinde ve mortalite oranında azalma ile ilişkilidir. Tüm HCV ile infekte olmuş kişileri tedavi etmek, bulaşma riskini azaltması bakımından da önemlidir (2).
KHC hastalığı yaygın olmakla birlikte HCV ile infekte olan çoğu kişi bu durumdan habersizdir (5). Dünya çapında zayıf sürveyans sistemleri, HCV infeksiyonunun küresel yükünü tam olarak ölçmeyi zorlaştırmaktadır (6). HCV infeksiyonu olan kişiler tespit edilip uygun şekilde tedavi edilmedikçe hastalığa bağlı ölümlerin sayısı artmaya devam edecektir (7).
Küresel Genotip Dağılımı
Hindistan’da tespit edilen son genotip ile birlikte HCV’nin doğrulanmış sekiz genotipi ve 86 alt tipi mevcuttur (8). Dünya çapında HCV infeksiyonlarının %44’üne, yüksek ve orta gelirli ülkelerdeki HCV infeksiyonlarının ise %60’ına genotip 1 neden olmaktadır; genotip 1 infeksiyonlarının yaklaşık üçte biri Doğu Asya’da görülmektedir (3). Genotip 3 infeksiyonları düşük-orta gelirli ülkelerde diğer gelir grubundaki ülkelere göre daha yaygındır ve tüm HCV infeksiyonlarının %25’ini oluşturur; genotip 3 kaynaklı HCV infeksiyonlarının yaklaşık %75’i Güney Asya’da görülmektedir. Genotip 4 infeksiyonları ise tüm HCV infeksiyonlarının %15’ini oluşturur ve en yaygın olarak Kuzey Afrika ve Orta Doğu’da görülür. Genotip 2 ve 6 infeksiyonlarına büyük ölçüde Doğu Asya’da rastlanır. Genotip 5, 7 ve 8 infeksiyonları ise küresel HCV infeksiyonlarının %1’inden azını oluşturur ve olguların çoğu Güney ve Orta Sahra Altı Afrika’da saptanır. Söz konusu tüm genotipler ve alt tipleri mevcut tedavilere farklı şekilde yanıt verir (3).
Bulaşma Yolları
HCV’nin bulaşması infeksiyöz viriyonların çoğalabildiği duyarlı hücrelerle temas etmesini gerektirir. Virusun RNA’sı kanda, tükürükte, gözyaşında, seminal sıvıda, asit sıvısında ve beyin omurilik sıvısında saptanabilir (9). Bu nedenlerle HCV’nin bulaşması tipik olarak kan transfüzyonu, sağlık hizmeti ile ilişkili parenteral uygulamalar veya damar içi madde kullanımı yoluyla doğrudan kana maruz kalma ile gerçekleşir. Baskın bulaşma yolları zaman içinde değişebilir, ülkeler arasında ve hatta ülke içinde farklılık gösterebilir (3).
Anti-HCV pozitif donörlerden seronegatif alıcılara transfüzyon ile virus %90’dan fazla oranda bulaşır. HCV infeksiyonunun tespiti için özgül enzim immünoessey (EIA) testlerinin 1990 yılında kullanıma sunulmasından önce, 1960’ların ortalarında ve 1970’lerin başlarında kan donörü ve alıcılar üzerinde yapılan retrospektif çalışmalar, ABD’deki kan alıcılarının neredeyse %25’inin HCV ile infekte olduğunu göstermiştir (10,11).
HCV infeksiyonunun tespiti için özgül EIA testlerinin kullanıma sunulmasından önce, ABD’deki HCV infeksiyonlarının yaklaşık %17’si transfüzyonla ilişkili bulunmuştur. HCV ayrıca immün globülin dahil olmak üzere kontamine kan ürünlerinin intravenöz uygulanmasıyla da bulaşabilir (9). HCV ile infekte donörlerden seronegatif alıcılara organ nakli, hemen her zaman HCV infeksiyonu ile sonuçlanır. HCV seropozitif alıcılarda ise farklı bir viral suş ile süperinfeksiyon ortaya çıkabilir (9).
Güvenli olmayan tıbbi uygulamalar, HCV bulaşmasının dünya çapında en yaygın nedenidir Evrensel önlemleri uygulamak için yeterli kaynakların olduğu ülkelerde nozokomiyal bulaşma nadirdir ve infeksiyon kontrol protokollerindeki ihlallerle ilişkilendirilir. Ancak nozokomiyal bulaşma, infeksiyon kontrol standartlarını sürdürmek için kaynakların yetersiz olduğu ülkelerde özellikle önemlidir. Düşük-orta gelirli ülkelerdeki güvenli olmayan tıbbi uygulamalar; Mısır, Hindistan ve Asya’daki yüksek HCV prevalansının (ulusal HCV prevalansının > %1) temelini de oluşturan en önemli risk faktörleridir (3,9). Yüzeylerin kontaminasyonu ve diyaliz ünitelerinde el hijyenine ve eldiven kullanımına uyulmaması nedenleriyle hemodiyaliz ünitelerinde HCV’nin nozokomiyal bulaşması spesifik bir endişe kaynağıdır. Evrensel önlemlere tam olarak uyulması diyaliz ünitelerinde bulaşma riskini önemli ölçüde azaltabilir (9).
HCV’nin sağlık çalışanlarına bulaşması, HCV ile infekte hastaların enjektör iğnelerinin kaza ile batırılması sonucunda %1-2 oranında gerçekleşir. Konjonktivaya kan sıçraması ile de HCV infeksiyonu bulaşması rapor edilmiştir (12). Bu risklere rağmen diş ve tıp sağlığı çalışanları arasında HCV infeksiyonu prevalansı genel popülasyondan daha az veya benzerdir (9).
Günümüzde damar içi madde kullananlar HCV salgınının dünya çapında önemli bir rezervuarıdır. Pakistan, Gürcistan ve Hindistan’ın bazı bölgelerinde en yaygın HCV infeksiyonu nedenleri; damar içi madde kullanımı ve iyatrojenik bulaşmadır (9). Ekonomik olarak gelişmiş ülkelerde, yeni HCV infeksiyonlarının çoğu yasa dışı damar içi madde kullanımıyla ilişkilidir (3). Dünyanın ekonomik olarak gelişmekte olan bölgelerinde HCV’nin bulaşması, hem geleneksel hem de geleneksel olmayan tıbbi ortamlarda, enjeksiyon ve diğer perkütan uygulama malzemelerinin yaygın olarak yeniden kullanımı nedeniyle gerçekleşir. Çoğu gelişmiş ülkede HCV infeksiyonundan büyük ölçüde kontamine enjektör iğneleri ve yasa dışı uyuşturucu kullanımıyla ilişkili diğer gereçler sorumludur. Küresel olarak 10 milyon damar içi madde kullanan kişinin HCV ile infekte olduğu tahmin edilmektedir; bu da %67’lik bir orta nokta prevalansına karşılık gelmektedir (13). HCV infeksiyonu genellikle enjekte edilen ilaçların yasa dışı kullanımının başlamasından sonraki aylar içinde ortaya çıkar. HCV, HIV’den en az 10 kat daha bulaşıcı olup HIV için enjeksiyon başına %0.3 olan oran HCV için %3-10 olarak bildirilmiştir (14).
HCV cinsel partnerler arasında ve anneden bebeğe de bulaşabilir ancak bu durum HBV ile karşılaştırıldığında nadirdir (14). Virusun cinsel ilişki sırasında bulaştığını kanıtlamak zor olmakla birlikte bunun meydana geldiğine dair ikinci dereceden kanıtlar giderek artmaktadır; semen ve tükürükte HCV RNA tespit edilmiştir. Birden fazla cinsel partneri olan kişilerde ve seks işçilerinde yüksek HCV prevalansı söz konusudur (9). Öte yandan tek eşli birlikteliklerde HCV’nin cinsel yolla bulaşmasının nispeten seyrek olduğunu gösteren veriler bulunmaktadır (15). Virusun cinsel yolla bulaşması 2000 yılından beri, özellikle Avrupa, Kuzey Amerika ve Asya’daki HIV-pozitif MSM’de HCV infeksiyonu için bir risk faktörü olarak ortaya çıkmıştır. HIV-pozitif MSM’de eş zamanlı damar içi madde kullanımı, HCV bulaşma riskini daha da artırmaktadır. HCV’nin bulaşma olasılığını; prezervatifsiz alıcı cinsel ilişki, travmatik cinsel ilişki, grup seks gibi davranışsal risk faktörleri ile birlikte eş zamanlı ülseratif cinsel yolla bulaşan infeksiyonlar, HIV infeksiyonu ve yüksek HCV viral yükü olan kişiler gibi biyolojik risk faktörleri de artırır. HIV-negatif MSM’de meydana gelen infeksiyon nadir olmakla birlikte en yaygın olarak damar içi madde kullanımı ile ilişkilidir. HIV-negatif MSM’de temas öncesi profilaksinin yapılması, HCV infeksiyonu riskini artırabilir. HIV ile koinfeksiyon bulunan olgular dışında, serodiskordan çiftlerde HCV’nin cinsel yolla bulaşması nadiren görülür. Tek eşli heteroseksüel çiftler üzerinde yapılan bir çalışmada, atfedilebilir HCV prevalansının genotip uyumuna bağlı olarak %0.6 olduğu tahmin edilmiştir (9).
HCV nadiren anneden bebeğe bulaşır. Büyük ölçekli çalışmalarda perinatal bulaşma sıklığı tahminleri %0-4 arasında değişmektedir. Bulaşmanın zamanlaması bilinmemektedir. Bununla birlikte, anne sütü ile beslenmeyen ve sezaryen ile doğan bebeklerde doğumdan sonraki bir ay içinde HCV RNA saptanması, en azından bazı durumlarda bulaşmanın intrauterin gerçekleştiğini düşündürmektedir (9). Anneden bebeğe bulaşma, monoinfekte kadınlarda %6, HCV ve HIV koinfeksiyonu olanlarda ise %11 olarak bildirilmiştir (16). Doğum yöntemi, monoinfekte kadınlarda dikey bulaşmayı etkilememektedir (17).
HCV infeksiyonunda bildirilen diğer bulaşma yolları, özellikle bazı Sahra Altı Afrika ülkeleri için risk faktörleri olan dövme ve estetik amaçlı geleneksel cilt kazıma girişimleridir (9). Yetersiz evrensel infeksiyon kontrol önlemlerinin uygulandığı hemodiyaliz ünitelerinin yanı sıra hapishaneler de etkenin bulaşması açısından riskli yerler olarak kabul edilmektedir (3). Bazı çalışmalarda dövmeler HCV infeksiyonu ile ilişkilendirilmiştir ve hapishanede dövme yaptırmak özellikle yüksek riskli bir prosedür gibi görünmektedir (9).
Hepatit C Virusu İnfeksiyonunun Doğal Seyri
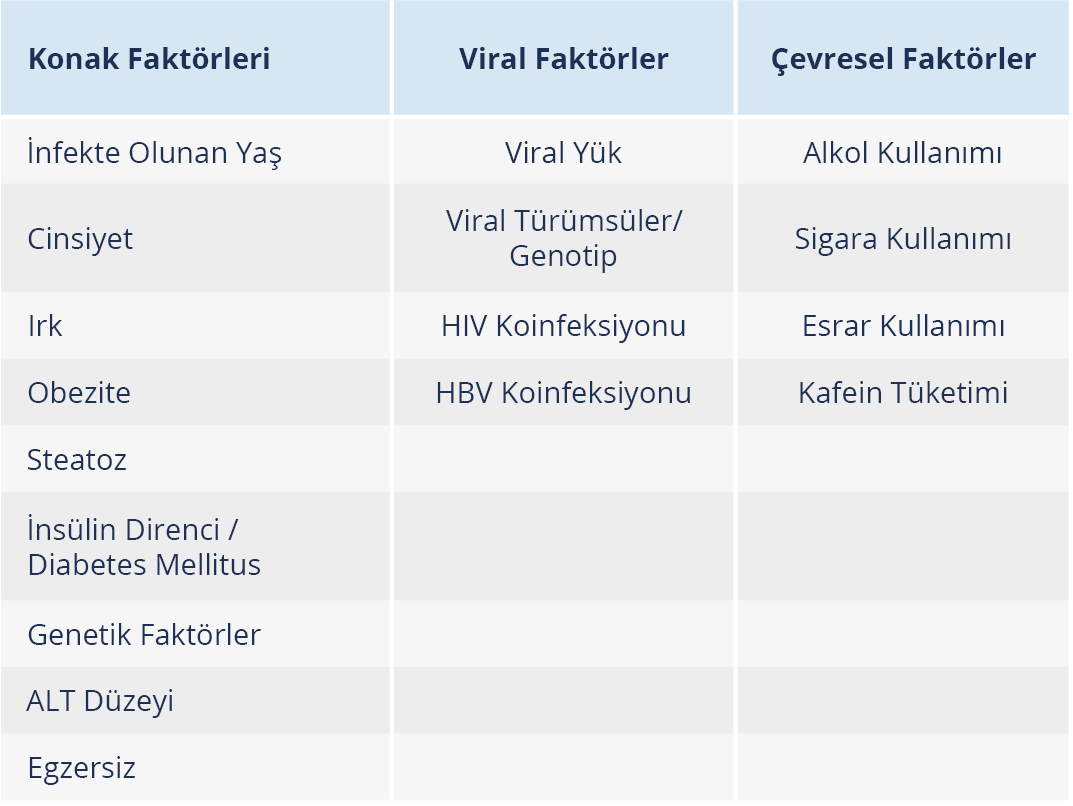
Tablo 1. Hepatit C Virusu İnfeksiyonunun Doğal Seyrini Etkileyen Faktörler (Kaynak 20’ten uyarlanmıştır.)
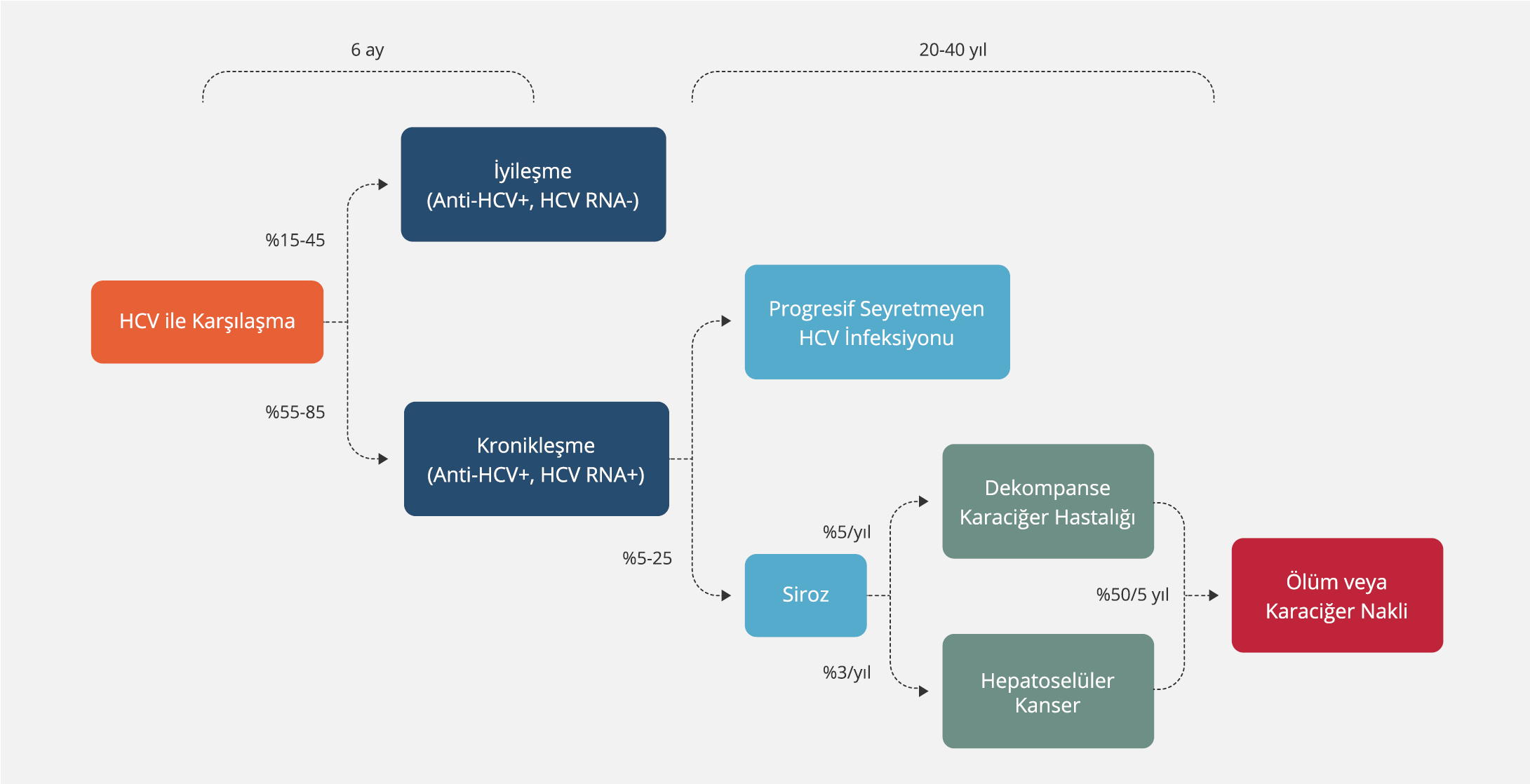
HCV bulaşan kişilerin %55-85’inde kronik hepatit gelişir. Kronik HCV infeksiyonu gelişenlerde ise yıllık siroz ve hepatik dekompansasyon riski %2-5’dir. Dekompanse karaciğer hastalığı olanların %15-20’si dekompansasyonu takip eden ilk yıl içinde kaybedilmektedir (3). HCV infeksiyonun doğal seyri Şekil 1’de, doğal seyri etkileyen faktörler ise Tablo 1’de gösterildi (18,19,20).
Yakın Zamanda Edinilmiş Hepatit C
Yakın zamanda edinilmiş HCV infeksiyonu tipik olarak anikterik seyreder ve olguların %20-30’undan azında klinik olarak spesifik olmayan belirtiler görülür. Semptomlar halsizlik, güçsüzlük, iştahsızlık ve sarılık olabilir. Sarılık hastaların sadece %15-20’sinde görülür (21). Semptomlar HCV maruziyetinden 2-26 hafta sonra ortaya çıkar ve akut hastalık 2-12 hafta sürer. HCV’ye karşı oluşan antikorlar bulaşmadan sonraki 12 hafta içinde saptanır. HCV RNA, anti-HCV serokonversiyonundan önce tespit edilebilir. Akut infeksiyonun tanısı şüphelenilen temastan sonra HCV RNA pozitifliği ile konulabilir (3).
Fülminan hepatit nadirdir (<%1); ancak kronik HBV infeksiyonu birlikteliği, HIV koinfeksiyonu ve eşlik eden immünosüpresyon fülminan hepatit gelişmesi için risk faktörleridir (3).
Akut infeksiyonun ardından HCV klirensi ile ilişkili faktörler; interferon-lambda 3 (IFNL3) (önceden IL28B olarak adlandırılıyordu) olumlu genetik polimorfizmine sahip olmak, kadın olmak, yüksek alanin aminotransaminaz (ALT) seviyesi, sarılıkla giden hastalık, HCV RNA konsantrasyonlarında hızlı düşüş ve interferon-gamma (IFN-ɣ) kaynaklı protein-10 yüksek kan konsantrasyonudur. HCV bulaşmasından 12 hafta sonra HCV RNA’nın saptanması, hastalığın kronikleştiğini ve yüksek riskli gruplarda devam eden bulaşmayı önlemek için tedavi gerekliliğini gösterir (3).
Kronik Hepatit C
HCV bulaşan kişilerin %55-85’inde hastalık kronikleşir. KHC hastalığı olan kişilerin yaklaşık %10-20’sinde 20-30 yıl içinde dekompanse siroz ve HSK gibi komplikasyonlar gelişir. Hastalığın ilerlemesi; infeksiyonun ileri yaşta kazanılması durumunda, erkek cinsiyette, obezitede, fazla alkol tüketiminde, HIV koinfeksiyonunda ve immün baskılama durumlarında hızlanır. Beş yıllık HSK gelişme riski karaciğer fibrozisi olmayan kişilerde %1 iken sirozu olanlarda %13’e kadar çıkmaktadır. HBV koinfeksiyonu, diyabet, karaciğer yağlanması, HCV genotip 3 infeksiyonu, fazla miktarda alkol tüketimi, ileri yaş, düşük trombosit sayısı, erkek cinsiyet ve muhtemelen genetik faktörler HSK gelişme riskini artırmaktadır (3).
Ekstrahepatik Tutulumlar
KHC’li hastaların yaşam kalitesi genel popülasyondan daha kötüdür. Bu hastaların %75 kadarında ekstrahepatik belirtilerin yanı sıra bağışıklık durumu veya inflamatuar süreçlerle ilişkili durumlar ortaya çıkar. Bu sekeller arasında; mikst kriyoglobülinemi vasküliti, aterosklerotik kardiyovasküler hastalık, böbrek hastalığı (tip 1 membranoproliferatif glomerülonefrit, fokal segmental glomerüloskleroz ve interstisyel nefrit), tip 2 diyabet, lenfoproliferatif hastalık (Hodgkin dışı lenfoma ve hepatosplenik T-hücreli lenfoma), deri hastalığı (porfiriya kutanea tarda ve liken planus), tiroid hastalığı (Hashimoto tiroidi ve Graves hastalığı) ve göz hastalığı (Mooren ülserleri ve Sjögren sendromu) yer alır (3).
Öneriler
- Yakın zamanda edinilmiş HCV infeksiyonunun %70-80 oranında asemptomatik seyrettiği, nadiren fülminan hepatite de neden olabileceği unutulmamalıdır.
- Yakın zamanda edinilmiş HCV infeksiyonu; spontan klirens IFNL3 olumlu genetik polimorfizmine sahip olanlarda, kadınlarda, yüksek ALT seviyesi ve sarılıkla giden hastalıkta, HCV RNA konsantrasyonlarında hızlı düşüş ve INF-ɣ kaynaklı protein-10 yüksek kan konsantrasyonu olanlarda daha fazladır.
- HCV infeksiyonu olan hastaların %55-85’inde KHC ve KHC olan hastaların da %10-20’sinde 20-30 yıl içinde dekompanse siroz ve HSK gelişebileceği bilinmelidir. Sirotik olgularda beş yılda HSK gelişme olasılığı %13’tür.
- Hastalığın ilerlemesinde; yaş, cinsiyet, obezite, alkol ve uyuşturucu kullanımı, karaciğer yağlanması, insülin direnci / diabetes mellitus, genetik faktörler ve viral (HIV/HBV) koinfeksiyonlar gibi birçok faktör rol oynar. Bu nedenle her hasta bireysel olarak değerlendirilmelidir.
- HCV infeksiyonu sırasında ekstrahepatik hastalıkların gelişebileceği ve bu komplikasyonlar sonucu hastaların hayat kalitesinin bozulacağı, mortalite ve morbitenin artacağı göz önünde bulundurulmalıdır.
- HCV ile infekte olan çoğu hasta durumdan habersiz olduğu için, ekstrahepatik bulgular saptanan hastalarda HCV infeksiyonunun, HCV infeksiyonu saptanan kişilerde ise sık görülen ve güçlü ilişkisi olduğu kanıtlanmış ekstrahepatik hastalıkların varlığı araştırılmalıdır.
YAKIN ZAMANDA EDİNİLMİŞ HEPATİT C VE KRONİK HEPATİT C TANISI
Anti-HCV Antikorları
Anti-HCV antikorlarının saptanması, HCV infeksiyonu tanısında en sık kullanılan serolojik yöntemdir. Anti-HCV sonucu, etken alındıktan 4-10 hafta sonra pozitifleşmektedir; bu sonuç bağışıklık göstergesi değildir, sadece etkenle karşılaşıldığını gösterir (22).
Bu antikorları saptamak için en sık olarak gerçekleştirilen ve son derece hassas ve özgül (>99%) bir tetkik yöntemi olan EIA referans standart olarak kabul edilmektedir; sıklıkla ikinci veya üçüncü nesil EIA testleri kullanılmaktadır. Üçüncü nesil EIA’lar, HCV yapısal proteininin (örneğin nükleus) ve yapısal olmayan bölgelerinin (örneğin NS3, NS4 ve NS5) çoklu antijen formatını kullanmaktadır. İmmün sistemi güçlü kişilerde bu testlerin duyarlılıkları %95-99’a kadar ulaşmaktadır (22,23). Bununla birlikte bazı istisnai klinik durumlar (hemodiyaliz hastaları, HIV ve HBV koinfeksiyonu, diğer bağışıklığı baskılanmış hastalar ve yakın zamanda edinilmiş HCV infeksiyonunun erken dönemi) anti-HCV testinde duyarlılık sorunlarına ve yanlış negatif sonuçlara neden olabilmektedir. Bu nedenle kuşkulu durumlarda mutlaka HCV RNA testi yapılmalıdır (22,24). Ayrıca bu testlerin yalnızca bir tarama testi olduğu ve akut veya erken infeksiyonu kronik infeksiyondan veya kendiliğinden iyileşen veya başarılı bir şekilde tedavi edilen önceki infeksiyondan ayırt ettirmediği unutulmamalıdır. Spontan olarak iyileşen veya KHC tedavisine yanıt alınan olgularda anti-HCV pozitifliği devam edebilmektedir. Bunun yanında, önceden infeksiyonu olan bazı hastalarda antikor test sonucu negatif olabilir; çünkü infeksiyonun spontan olarak iyileştiği hastalarda HCV antikor seviyeleri sürecin sonunda tespit edilebilir düzeylerin altına düşebilmektedir (22).
Gamma globülin artışına neden olan hastalıklar (multipl miyelom, romatoid artrit, vb.), otoimmün hastalıklar veya bazı aşılamalar sonrasında anti-HCV testinde yalancı pozitiflikler görülebilir. Özellikle anti-HCV pozitifliği saptanan ancak infeksiyon riski düşük olan kişilerde mutlaka HCV RNA testiyle doğrulama yapılmalıdır (25).
Toplumda HCV tarama stratejileri epidemiyolojik verilere göre belirlenmelidir; ancak HCV için riski yüksek olan gruplar tarama açısından mutlaka değerlendirilmelidir (24).
HCV Kor Antijeni Testi
Viral parçacığın bir bileşeni olan HCV kor proteinini tespit etmek için çeşitli immünolojik testler geliştirilmiştir. Özgül monoklonal antikorlar aracılığıyla HCV kor antijenleri saptanabilmektedir (26,27). Dünya Sağlık Örgütü kılavuzları nükleik asit testlerinin mevcut olmadığı sınırlı kaynaklara sahip bölgelerde viremiyi saptamak ve doğrulamak için bir alternatif olarak HCV kor antijen testlerinin kullanılmasını önermektedir (28). Bu test tüm genotiplerde kullanılabilen, ucuz, kolay uygulanan, duyarlılık ve özgüllüğü yüksek bir test olmakla birlikte, HCV RNA testlerine göre duyarlılığı düşüktür. HCV ile infekte hastalarda HCV antikoru pozitifleşmeden 30-40 gün kadar önce saptanabilmektedir. HCV kor antijeni yakın zamanda edinilmiş HCV infeksiyonunda HCV RNA’dan birkaç gün sonra pozitifleşebilir (24,26,27).
Nükleik Asit Testleri
HCV RNA tespiti ve kantifikasyonu; akut ve kronik HCV infeksiyonu olan kişilerin tanısı, antiviral tedavi yanıtının takibi, antikor üretiminin yetersiz olduğu immünosüpresyon durumlarında (HIV infeksiyonu, hemodiyalize giren hastalar, vb.) HCV infeksiyonu tanısı, anneden bebeğe ve mesleki temaslarda bulaşmanın erken dönemde tanısı amacıyla kullanılan temel bir testtir. Test infeksiyonun varlığını veya yokluğunu doğrulamak ve mevcut HCV RNA miktarını ölçmek için kullanılır (28).
HCV infeksiyonunun tanısı için en duyarlı ve altın standart yöntem olan HCV RNA testi (hem HCV genom tespiti hem de kantifikasyon için) gerçek zamanlı polimeraz zincir reaksiyonu (PZR) veya transkripsiyon aracılı amplifikasyon gibi farklı yöntemlerle saptanmaktadır (29). Dünya Sağlık Örgütü, HCV RNA testlerinin sonuçlarının standart ve karşılaştırılabilir olması için uluslararası ünite (İÜ) olarak bildirilmesini önermektedir (30).
HCV RNA genellikle etkenle temastan sonra ve kısmen inokülüm miktarına bağlı olarak, teması takip eden günler ve sekiz haftalık dönemde PZR ile serumda saptanabilir duruma gelmektedir. Şüphelenilen temastan sonra sürekli negatif sonuçlanan HCV PZR testinin infeksiyonu dışladığı minimum aralık kesin olarak belirlenememiştir. Klinik önemi belirsiz olmakla beraber, HCV RNA serumda saptanamayan hastalarda karaciğerde saptanabilir (31, 32).
HCV RNA tespiti için gerçekleştirilen nükleik asit testleri kalitatif ve kantitatif testler olmak üzere iki kategoriye ayrılır. Kantitatif testler İÜ/ml cinsinden HCV RNA miktarını değerlendirir ve infeksiyonu saptamak, tedaviden önce HCV viral yükünü ölçmek ve tedaviye yanıtı değerlendirmek için kullanılır. Kantitatif testlerin ölçebildiği alt HCV RNA düzeyinin ≤15 İÜ/ml olması önerilmektedir. Modern tahliller yaklaşık 10 ila 15 İÜ/ml’lik alt saptama sınırları ile son derece duyarlıdır ve geniş bir ölçüm aralığına sahiptir (29,30,33). Kalitatif testler de infeksiyonu saptamak ve tedaviye yanıtı değerlendirmek için kullanılabilir. Bu testler kantitatif testlere göre nispeten daha düşük seviyelerde HCV RNA’yı saptayabilmektedir (örneğin bazı testlerde seviye <10 İÜ/ml düzeyindedir) (30).
Viral Genotip Tayini
KHC tanısı almış hastalarda tedavi rejimi, dozlama ve tedavi süresi genotipler arasında değişiklik gösterebilir. Buna karşın tedavide kullanılan pangenotipik HCV ilaç rejimleri genotip ve subtip analizi yapılmaksızın uygulanabilir; ancak tedavi başarısızlığı öyküsü olanlarda ve sirotik hastalarda tedavi öncesi genotip ve subtip analizi yapılmalıdır. Pangenotipik tedavi seçeneklerinin olmadığı durumlarda ve tedaviye az duyarlı veya doğal dirençli subtiplerle infeksiyon düşünülüyorsa tedavi seçimi, süresi ve tedaviye yanıt olasılığını belirlemek için tedavi öncesinde genotip ve subtip analizi yapılması önerilmektedir (24,34).
Biyokimyasal Testler
İndirekt hepatik fibrozis belirteçleri, hepatik fonksiyondaki değişiklikleri yansıtan ancak hücre dışı metabolizmayı doğrudan yansıtmayan serolojik biyokimyasal testleri içerir. Bu belirteçler arasında serum aminotransferaz seviyeleri, trombosit sayısı, pıhtılaşma parametreleri, gamma-glutamil transferaz (GGT), total bilirubin, alfa-2 makroglobülin ve alfa-2 globülin (haptoglobin) bulunur. Özellikle serum transaminazlarının yüksek olması genellikle inflamasyon ve fibrozis lehine olmakla birlikte, normal olmasının karaciğer hasarının olmadığı anlamına gelmediği de unutulmamalıdır (35).
Yakın zamanda edinilmiş HCV infeksiyonunda aminotransferaz seviyeleri genellikle normalin üst sınırının 10 ila 20 katından fazla olmakla birlikte bu durum değişken olabilir (36,37). Semptom geliştiren hastalarda aminotransferazlar, klinik semptomların başlamasından kısa bir süre önce ve genellikle anti-HCV antikorları saptanabilir hale gelmeden yükselmeye başlar. Bununla birlikte aminotransferaz düzeyleri sıklıkla dalgalanma gösterebilir, hatta normale dönebilir ve başvuru sırasında tüm hastalarda yüksek seviyeleri saptanmayabilir. Akut infeksiyondan sonra serum aminotransferaz düzeylerinin normale dönmesi mutlaka infeksiyonun sonlandığı anlamına gelmez. Yakın zamanda edinilmiş HCV infeksiyonu olan hastalarda toplam bilirubin seviyeleri de yükselebilir (38). Yapılan bir çalışmada 28 hastada ortalama bilirubin konsantrasyonu 4.4 mg/dl (75 mikromol/lt) bulunmuştur (39).
Karaciğer Biyopsisi
Kronik HCV infeksiyonu olan kişilerde biyopsi ile karaciğerde fibrozisin ve karaciğer hasarının derecesinin değerlendirilmesi önerilmekle birlikte biyopsinin bazı sınırlamaları bulunmaktadır. Bunlar; yanlış yorumlamaya neden olan örnekleme hataları, değerlendiriciler arasında saptanan farklı yorumlar ve komplikasyon riskidir. Bu nedenle invazif olmayan testler daha çok tercih edilmektedir (40,41). Bununla birlikte karaciğer biyopsisi, eşlik eden hastalıkların (hemokromatoz, alkolik hepatit, alkolsüz steatohepatit/alkolsüz yağlı karaciğer hastalığı ve hepatik sarkoidoz gibi) varlığını ve bu hastalıkların hastanın karaciğerini ne ölçüde etkilediğini saptayabilir (42). Önerilen bir strateji; eğer kaynaklar izin veriyorsa, fibrozis için iki tür invazif olmayan testin (biyobelirteç testi ve geçici karaciğer elastografisi) kullanılması ve bu iki test de uyumsuz ise biyopsi yapılmasıdır (42,43).
İnvazif Olmayan Testler
Son yıllarda karaciğer fibrozisinin çeşitli invazif olmayan testlerle değerlendirilmesi daha çok tercih edilmektedir. Bu testlerin potansiyel faydaları karaciğer biyopsisine kıyasla uygulama kolaylığına sahip olup daha düşük maliyette olmalarıdır. Ayrıca karaciğer hastalığının ilerleyişini izlemek için tekrarlanabilirler ve klinik sonuçları karaciğer biyopsisinden daha iyi tahmin edebilirler. Bu testlerden olan aspatrat aminotransferaz (AST) / ALT oranı, AST-trombosit oranı indeksi (APRI) ve FIB-4 rutin laboratuvar testlerinin sonuçlarından hesaplanabilir. Diğer özel invazif olmayan testler arasında FibroSure® ve ultrasonografi temelli “transient” elastografi yer alır (41).
Yukarıdaki bilgilendirmeler doğrultusunda; yakın zamanda edinilmiş HCV infeksiyonu klinik belirtileri (belirgin şekilde yüksek transaminaz değerleri ve/veya sarılık, vb.) olan veya yakın zamanda HCV ile teması bulunanlarda (parenteral yaralanma, yakın zamanda damar içi madde kullanımı, vb.) anti-HCV ve HCV RNA testleri yapılmalıdır. Bu testlere ek olarak; HBV infeksiyonu, otoimmün hepatit, hepatotoksisite gibi diğer olası akut hepatit nedenleri de araştırılmalıdır. Yakın zamanda edinilmiş HCV infeksiyonu olanlarda HCV RNA seviyelerinde dalgalanma ve hatta geçici olarak negatiflik saptanabilir. Böyle bir durumda test tekrarlanmalıdır. Yakın zamanda edinilmiş HCV infeksiyonu tanısı alan ve izlemde 12. haftada HCV RNA testi pozitif kalan hastalarda kronik hepatit düşünülmelidir (44-47).
Anti-HCV ve HCV RNA pozitifliği HCV infeksiyonunu doğrular ancak tek başına akut ve kronik infeksiyon ayrımı yaptıramaz. Son altı ay içinde bu testler negatif ise akut infeksiyon akla gelmelidir. KHC tedavisini takiben yakın zamanda negatif HCV RNA’nın belgelenmesi veya önceki bir HCV infeksiyonunun spontan olarak temizlenmesinin kanıtları varsa, bu iki testin pozitif bulunması durumunda yeniden infeksiyon (reinfeksiyon) olasılığı akla gelmelidir. Tekrarlanan HCV RNA testleri akut infeksiyonu kronikten ayırmaya yardımcı olabilir. Dalgalanan ve/veya düşük HCV RNA seviyeleri akut HCV’yi düşündürürken, dalgalanmayan yüksek HCV seviyeleri kronik infeksiyonu düşündürür. Benzer şekilde aminotransferaz seviyeleri yakın zamanda edinilmiş HCV infeksiyonunda kronik HCV infeksiyonundan daha fazla dalgalanır. İki klinik tablonun ayırt edilemediği durumlarda invazif olmayan testler kullanılabilir. Bununla birlikte yakın zamanda edinilmiş HCV infeksiyonu sırasında ortaya çıkan belirgin inflamasyon, “transient” elastografi veya aminotransferazları içeren serum panellerinde (APRI veya FIB-4) yanlış bir şekilde fibrozis skorlarını yükseltebilir (44-47).
Anti-HCV pozitif olup HCV RNA negatif olan olgularda önceden geçirilmiş ve iyileşmiş HCV infeksiyonu düşünülmeli ve bunu kanıtlamak için 12 hafta sonra HCV RNA testi tekrarlanarak negatifliği gösterilmelidir.
Öneriler
- Akut hepatit klinik belirtileri olan veya yakın zamanda HCV’ye maruz kalmış olma olasılığı bulunan hastalarda (parenteral yaralanma, yakın zamanda damar içi madde kullanımı, vb.) yakın zamanda edinilmiş HCV infeksiyonundan şüphelenilmeli ve anti-HCV ve HCV RNA testleri yapılmalıdır.
- HCV infeksiyonu açısından düşük riskli olan veya otoimmün hastalığı bulunanlarda anti-HCV pozitif saptandığında doğrulama amacıyla HCV RNA testi yapılmalıdır.
- Yakın zamanda edinilmiş HCV infeksiyonunun erken döneminde veya immünosüprese kişilerde anti-HCV’nin negatif çıkabileceği unutulmamalı, gerektiğinde HCV RNA testi de yapılmalıdır.
- Anti-HCV pozitif olup HCV RNA negatif saptanan hastalarda 12 hafta sonra tekrar HCV RNA bakılarak negatif seyrettiği teyit edilmelidir.
- HCV RNA, serum veya plazmada, 15 İÜ/ml’den düşük saptama sınırı olan hassas moleküler yöntemlerle belirlenmelidir.
- Akut veya kronik infeksiyon tanısı için HCV RNA’ya bakılamadığı durumlarda HCV kor antijeni testi kullanılabilir.
- Pangenotipik antiviraller HCV genotip ve subtip analizi yapılmaksızın uygulanabilir; ancak tedavi başarısızlığı öyküsü olanlarda ve sirotik hastalarda tedavi öncesi genotip ve subtip analizi yapılmalıdır.
- Karaciğer hastalığının şiddetini belirlemek için uygun hastalarda karaciğer biyopsisi yapılabilir ya da biyopsi yapılamayan durumlarda invazif olmayan yöntemler kullanılabilir.
KRONİK HEPATİT C’DE TEDAVİNİN AMAÇLARI
KHC’de tedavinin birincil amacı KVY elde ederek infeksiyonu tedavi etmektir. Böylece HCV’ye bağlı olarak gelişen karaciğerle ilgili komplikasyonları [hepatik nekroinflamasyon, fibrozis, siroz, dekompanse siroz, HSK, HCV ilişkili ekstrahepatik hastalıklar (kriyoglobülinemi, HCV ilişkili renal hastalık, porfiriya kutanea tarda, otoimmün hastalıklar vb.)] ve ölümü önlemektir. İkincil amaç ise hastaların yaşam kalitesini iyileştirmek, hastaları damgalanmaktan korumak ve HCV bulaşmasını engellemektir. Tedavinin sonlanım noktası KVY’nin elde edilmesidir. Kalıcı viral yanıt, tedavi sonlandırıldıktan 12 veya 24 hafta sonra duyarlı moleküler yöntemlerle serum ya da plazmada HCV RNA’nın (alt saptama limiti ≤15 İÜ/ml) saptanmamasıdır. HCV RNA testine alternatif yöntem olarak tedavi öncesi HCV kor antijeni saptanmış olanlarda ise tedavi bitiminden 12 veya 24 hafta sonra bu antijenin tespit edilmemesidir (24). Günümüzde DEA ilaç tedavileri ile hastaların yaklaşık %99’unda KVY elde edilmektedir. Kalıcı viral yanıt elde edilen hastalarda virolojik kür yaklaşık %99 oranında gerçekleşmektedir. Altı aydan sonraki geç relapslar olguların %0.2’sinden azında görülmektedir (48,49).
Kalıcı viral yanıt; genellikle karaciğer enzimlerinin normal sınırlara inmesi, karaciğer nekroinflamasyonunda ve fibrozis bulgularında düzelme ve karaciğer fonksiyonlarında iyileşme ile birlikte gerçekleşir (50,51).
Öneriler
- KHC’de tedavinin birincil amacı KVY’yi sağlayarak infeksiyonu tedavi etmek, HCV’ye bağlı ortaya çıkan hepatik ya da ekstrahepatik komplikasyonları ve HCV ilişkili ölümleri engellemektir.
- İkincil olarak hastaların yaşam kalitesini artırmak, HCV’ye bağlı damgalanmayı ve HCV bulaşmasını engellemektir.
- Tedavinin sonlanım noktası KVY elde edilmesidir.
KRONİK HEPATİT C’DE TEDAVİ ÖNCESİ YAPILMASI GEREKENLER
KHC tanısı almış ve tedavisi planlanacak olan hastalar olası diğer karaciğer hastalıkları, karaciğer hastalığının şiddeti ve bazal virolojik parametreler açısından değerlendirilmelidir.
Karaciğer İlişkili Komorbiditelerin Taranması
Karaciğerde fibrozisi hızlandırabilecek diğer komorbid nedenler (renal fonksiyonlar, diyabet, obezite, olası ilaç ilişkili hepatotoksisite, vb.) araştırılmalıdır. Hastalar HCV tedavisi öncesinde HCV ilişkili ekstrahepatik tablolara yönelik değerlendirilmelidir. Aktif HCV hastalarına karaciğer hastalığının progresyonunu ve HCV bulaşmasını engellemeye yönelik eğitim verilmelidir. HCV’li tüm hastalara alkolden uzak durma ya da tüketimini azaltmaya yönelik tavsiyelerde bulunulmalıdır. Yasa dışı madde kullanıcısı olan HCV’li hastalar opioid yerine koyma tedavisi açısından desteklenmeli, ilgili polikliniklere yönlendirilmeli ve bu hastaların HCV’ye yönelik tedavi uyumunu artırmak amacıyla psikiyatrik danışmanlık almaları sağlanmalıdır. Hastalar komorbiditeleri nedeniyle almakta oldukları ilaçlarla DEA ilaçlar arasında oluşabilecek potansiyel ilaç-ilaç etkileşimleri açısından tedavi öncesinde değerlendirilmelidir (Liverpool Üniversitesi Hepatit İlaç Etkileşimleri internet sitesi; (https://www.hep-druginteractions.org/). Tüm hastalar eşlik edebilecek ve KHC’nin seyrini etkileyebilecek diğer karaciğer hastalıkları açısından taranmalıdır. HBV (HBsAg, anti-HBc ve anti-HBs) ve hepatit A virusu (HAV) yönünden (anti-HAV IgG) testleri yapılmalı ve seronegatif bulunan hastalar aşılanmalıdır. Ayrıca HIV koinfeksiyonu, otoimmün ve metabolik hastalıklar araştırılmalıdır. Sirozu olan tüm hastalara pnömokok aşılaması önerilir (24,43,52).
Karaciğer Hastalığının Şiddetinin Değerlendirilmesi ve Bazal Virolojik Parametreler
HCV infeksiyonunun tedavisinin öncesinde karaciğer hastalığının şiddetinin değerlendirilmesi uygun tedavi rejiminin seçimi ve tedavi süresinin belirlenmesi açısından önemlidir. İnvazif olmayan testlerden serumda fibrozis biyobelirteçleri, karaciğer sertlik ölçümü, karaciğer görüntülemesi çoğu hastada siroz tanısında yeterli iken karaciğer biyopsisi nadiren gerekebilir. Karaciğer hastalığının diğer nedenlerini (metabolik sendrom, alkolizm, otoimmünite, vb.) araştırmak amacıyla biyopsi yapılabilir (43).
Karaciğer hastalığının şiddetini değerlendirmede kullanılan invazif olmayan testler; karaciğerin direkt fizik bakıda değerlendirilmesi, rutin kan testleri [ALT, AST, alkalen fosfataz, albümin, bilirubin, “international normalized ratio” (INR), trombosit sayısı, glomerüler filtrasyon hızı], fibrozis biyobelirteçleri, karaciğer sertlik ölçümü, ultrasonografi ya da tomografi ile karaciğer görüntülemesinden oluşmaktadır (43). Fibrozis biyobelirteçlerinden en sık kullanılanlar APRI ve FIB-4 testleridir (53,54). Hem karaciğer sertlik ölçümü hem de biyobelirteçler sirozu belirlemede iyi performans göstermekle birlikte, fibrozisin ara derecelerini belirlemede yetersiz kalabilirler. Tanısal doğruluğu artırmak için farklı serum biyobelirteçlerinin birlikte ya da biyobelirteçlerle karaciğer sertlik ölçümünün birlikte değerlendirilmesi önerilir (55,56). Tedavi sonrası izlemde karaciğer fibrozis derecesini belirlemede invazif olmayan testler güvenilir olmadığı için önerilmemektedir (24).
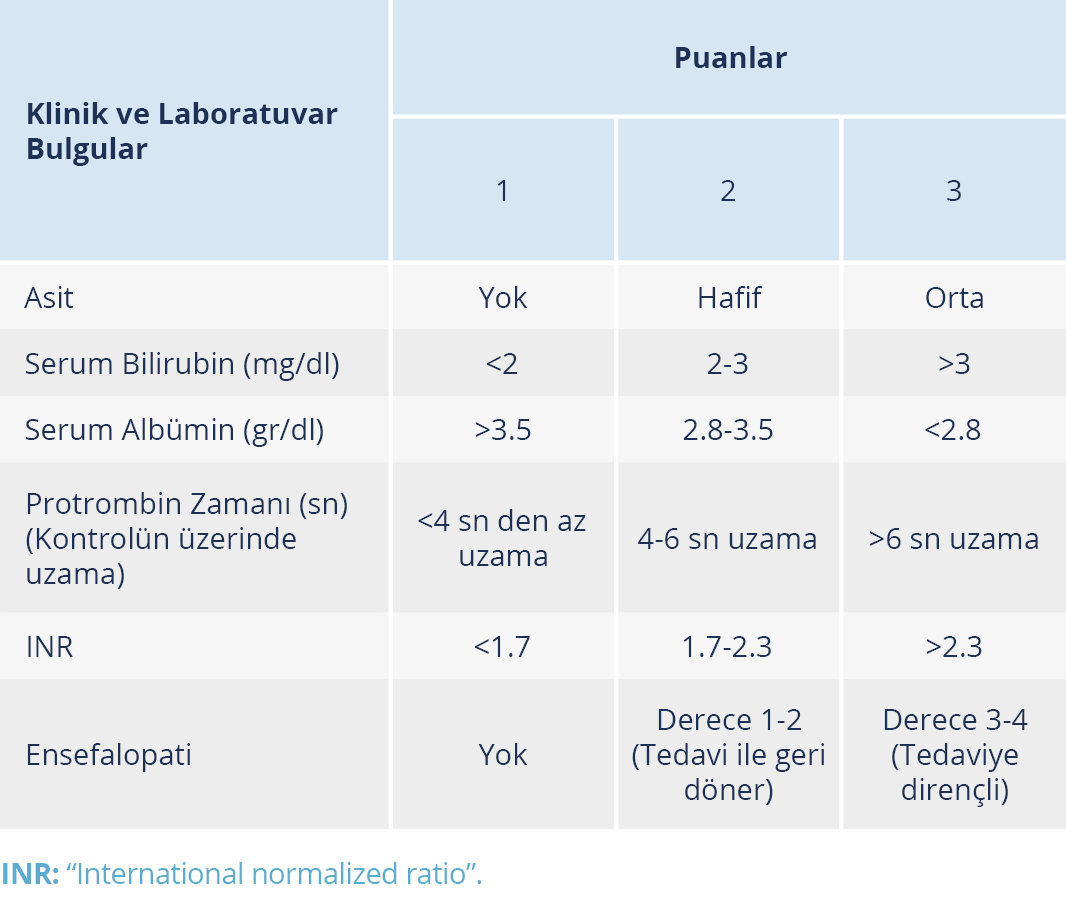
İlerlemiş fibrozis (METAVIR skoru F3) ve sirozu (METAVIR skoru F4) olan hastalarda tedavi sonrası HSK açısından 6 ay ara ile takip yapılmalı ve sirotik hastalar özafagus varisleri, asit ve portal hipertansiyon açısından değerlendirilmelidir (43). Sirotik hastaların “Child-Turcotte-Pugh” (CTP) sınıflandırmasıyla değerlendirilmesi HCV tedavi planı ve tedavi sonrası izlemlerinde yol göstericidir. Sirotik hastalar CTP sınıflaması ile hastalığın şiddetine göre aşağıdaki üç sınıfa ayrılır (57) (Tablo 2):
- Sınıf A (≤ 6 puan): kompanse siroz.
- Sınıf B (7-9 puan): ciddi fonksiyonel bozukluk.
- Sınıf C (≥10): dekompanse siroz.
Tedavi öncesi serum ya da plazmada HCV RNA ya da HCV kor antijen saptanması ve kantitasyonu yapılmalıdır. HCV RNA güvenilirliği ve duyarlılığı yüksek bir yöntemle çalışılmalı ve düzeyi İÜ/ml olarak ifade edilmelidir. HCV kor antijeni kantitasyonu güvenilir bir EIA yöntemiyle çalışılmalıdır (24,58). HCV tedavisinde pangenotipik HCV ilaç rejimleri HCV genotip ve subtip analizi yapılmaksızın uygulanabilir; ancak tedavi başarısızlığı öyküsü olanlarda ve sirotik hastalarda tedavi öncesi genotip ve subtip analizi yapılmalıdır. Günümüzde tedavi öncesinde mevcut olan direnç ilişkili dizilimlere (resistance-associated substitution – RAS) etkili, tedavi başarısı yüksek DEA rejimler kullanımdadır. Ayrıca HCV direnç testleri teknik olarak zordur ve özellikle 1 ve 4 dışındaki genotipler için performansı değişkenlik gösterir. Çoğu ülkede direnç testlerine erişim sınırlı olup yorumlanması ve raporlanması konusunda fikir birliği yoktur. Bu nedenlerden dolayı DEA deneyimi olmayan hastalarda tedavi öncesi rutin direnç testi önerilmemektedir (24).
Öneriler
- HCV’nin ekstrahepatik belirtileri tanımlanmalı, karaciğer hastalığının ilerlemesine katkısı olan komorbid durumlar belirlenmeli ve düzeltilmesine yönelik önlemler alınmalıdır.
- HCV’li tüm hastalar HBV, HIV, HAV için test edilmelidir. HBV ve HAV’a karşı bağışık olmayan hastalar aşılanmalıdır. Sirozu olan tüm hastalara pnömokok aşılaması önerilir.
- Aktif HCV hastalarına karaciğer hastalığının progresyonunu ve HCV bulaşmasını engellemeye yönelik eğitim verilmelidir.
- Alkol ve yasa dışı madde kullanıcısı olan HCV’li hastalara zarar azaltıcı önlemlere yönelik bilgilendirme yapılmalı, opioid yerine koyma tedavisi açısından psikolojik danışmanlık verilmelidir. Bu hastaların HCV tedavisine uyumunu artırmaya yönelik destek almaları sağlanmalıdır.
- Hastalar HCV tedavisi öncesinde, komorbiditeleri nedeniyle almakta oldukları ilaçlarla DEA ilaçlar arasında oluşabilecek potansiyel ilaç-ilaç etkileşimleri açısından değerlendirilmelidir.
- Tedavi öncesinde karaciğer hastalığının şiddeti değerlendirilmeli ve buna göre HCV tedavisi planlanmalıdır. İlerlemiş fibrozisi olan ve sirotik hastalarda tedavi sonrasında altı ay ara ile HSK sürveyansı yapılmalıdır.
- Tedavi öncesi karaciğerde fibrozis derecesini belirlemede invazif olmayan yöntemler kullanılmalıdır. Karaciğer sertlik ölçümünün yanı sıra APRI ve FIB-4 gibi serum biyobelirteçleri hem ucuz hem de güvenilir bir değerlendirme sağlar. Karaciğer biyopsisi, belirlenmemiş ya da ek etiyolojileri aydınlatmak için saklanmalıdır.
- Tedavi öncesinde vireminin varlığı HCV RNA veya HCV kor antijeni varlığı ile gösterilmelidir. Serum ya da plazmada HCV RNA tespiti ve kantitasyonu saptama alt sınırı 15 İÜ/ml olan duyarlı bir yöntem kullanılmalıdır.
- Pangenotipik HCV ilaç rejimleri, birinci basamak tedavide HCV genotip ve subtip analizi yapılmaksızın başlanabilir. Tedavi başarısızlığı öyküsü olan hastalarda ve sirotik hastalarda DEA rejimleri ile tedavi öncesinde genotip ve subtip analizi önerilmektedir.
- İlk tedavi öncesi rutin HCV direnç testleri önerilmemektedir.
KRONİK HEPATİT C’DE TEDAVİNİN KONTRENDİKASYONLARI
Karaciğer dışı komorbiditeleri nedeniyle kısıtlı yaşam beklentisi olan hastalara tedavi genellikle önerilmemektedir. Doğrudan etkili antiviral ilaç kombinasyonları ile tedavinin birkaç kontrendikasyonu bulunmaktadır. Sitokrom p-450 (CYP) veya P-glikoprotein (P-gp) indükleyicisi olan ajanlar (karbamazepin, fenitoin, fenobarbital, vb.) serumda DEA ilaç konsantrasyonlarını önemli ölçüde azalttıkları için yüksek virolojik yetmezliğe neden olurlar. Bu nedenle söz konusu ilaçların DEA tedavi kombinasyonları ile kullanımları kontrendikedir. NS3-4A proteaz inhibitörlü [grazoprevir (GRZ), glekaprevir (GLE), voxilaprevir (VOX), vb.] tedavi rejimlerinin dekompanse sirotik (CTP B ve C) ve öncesinde dekompansasyon öyküsü olan kompanse sirotik (CTP A) hastalarda önemli ölçüde yüksek proteaz inhibitörü konsantrasyonuna bağlı olası toksisite riski nedeniyle kullanımı kontrendikedir (24,59). KHC için tedavi başlanacak hastalarda, tedavi öncesinde hastaların kullandıkları ilaçlar ve antiviral ajanlar arasında etkileşim olup olmadığı mutlaka değerlendirilmelidir.
Öneriler
- CYP veya P-gp indükleyici olan ajanlarla DEA kombinasyonlarının birlikte kullanımı kontrendikedir.
- NS3-4A proteaz inhibitörü içeren tedavi rejimlerinin dekompanse sirotik ve öncesinde dekompansasyon öyküsü olan kompanse sirotik hastalarda kullanımı kontrendikedir.
KRONİK HEPATİT C’DE TEDAVİ ENDİKASYONLARI
Yeni kazanılmış ya da kronik HCV infeksiyonu olan, tedavi naif ya da tedavi deneyimli (yanıtsız veya nüks olgular) tüm hastalar bekletilmeksizin tedavi edilmelidir. Siroz ve HSK’ya ilerleme riski hem viral faktörlere hem de konak faktörlerine bağlıdır. İleri derecede fibrozisi (METAVIR skoru F2, F3) ve sirozu (METAVIR skoru F4, CTP A) ya da dekompanse sirozu (CTP B ve C) olanlar, klinik olarak önemli ekstrahepatik tutulumu bulunanlar (HCV ilişkili semptomatik mikst kriyoglobülinemi, HCV immün kompleks ilişkili nefropati, non-Hodgkin B hücreli lenfoma, idiyopatik trombositopenik purpura, vb.), karaciğer nakli sonrası HCV rekürrensi gösterenler acilen tedavi edilmelidir. Hastalığın edinilme yaşı, alkol kullanımı, diyabet, HBV/HIV koinfeksiyonu, herhangi bir nedene bağlı immünosüpresyon (karaciğer dışı solid organ veya kök hücre nakil alıcıları, vb.) durumlarında siroz ve HSK gelişme riski yüksektir. Söz konusu hastalar ve HCV bulaştırıcılığı açısından yüksek riskli kişiler (damar içi madde kullanıcıları, yüksek riskli cinsel davranışları olan MSM’ler, doğurganlık çağında gebe kalma potansiyeli olan kadınlar, hemodiyaliz hastaları, mahkumlar, vb.) gecikmeden tedavi edilmelidir (60-62).
Damar içi madde kullanıcıları, yüksek riskli cinsel davranışı olan MSM’ler reinfeksiyon riski ve etkenin bulaşma yolları hakkında bilgilendirilmeli ve bu hasta grubu reinfeksiyon açısından HCV RNA ile takip edilmelidir (2,24,43).
Öneriler
- Yeni kazanılmış HCV infeksiyonu olan ya da kronik HCV ile infekte olan tedavi naif ya da tedavi deneyimli tüm hastalar tedavi adayı olarak düşünülmelidir.
- İleri derecede fibrozu (METAVIR skoru F2, F3) ve sirozu (METAVIR skoru F4) olan hastalar, HCV ilişkili ekstrahepatik tutulumu olanlar, karaciğer nakli sonrası HCV rekürrensi gösterenler, karaciğer hastalığının hızlı ilerleme riski olan hastalar, HBV/HIV koinfekte hastalar, karaciğer dışı solid organ veya kök hücre nakil alıcıları ve HCV bulaşması açısından yüksek riskli kişiler acilen tedavi edilmelidir.
KRONİK HEPATİT C TEDAVİSİNDE KULLANILAN İLAÇLAR VE İLAÇ-İLAÇ ETKİLEŞİMLERİ
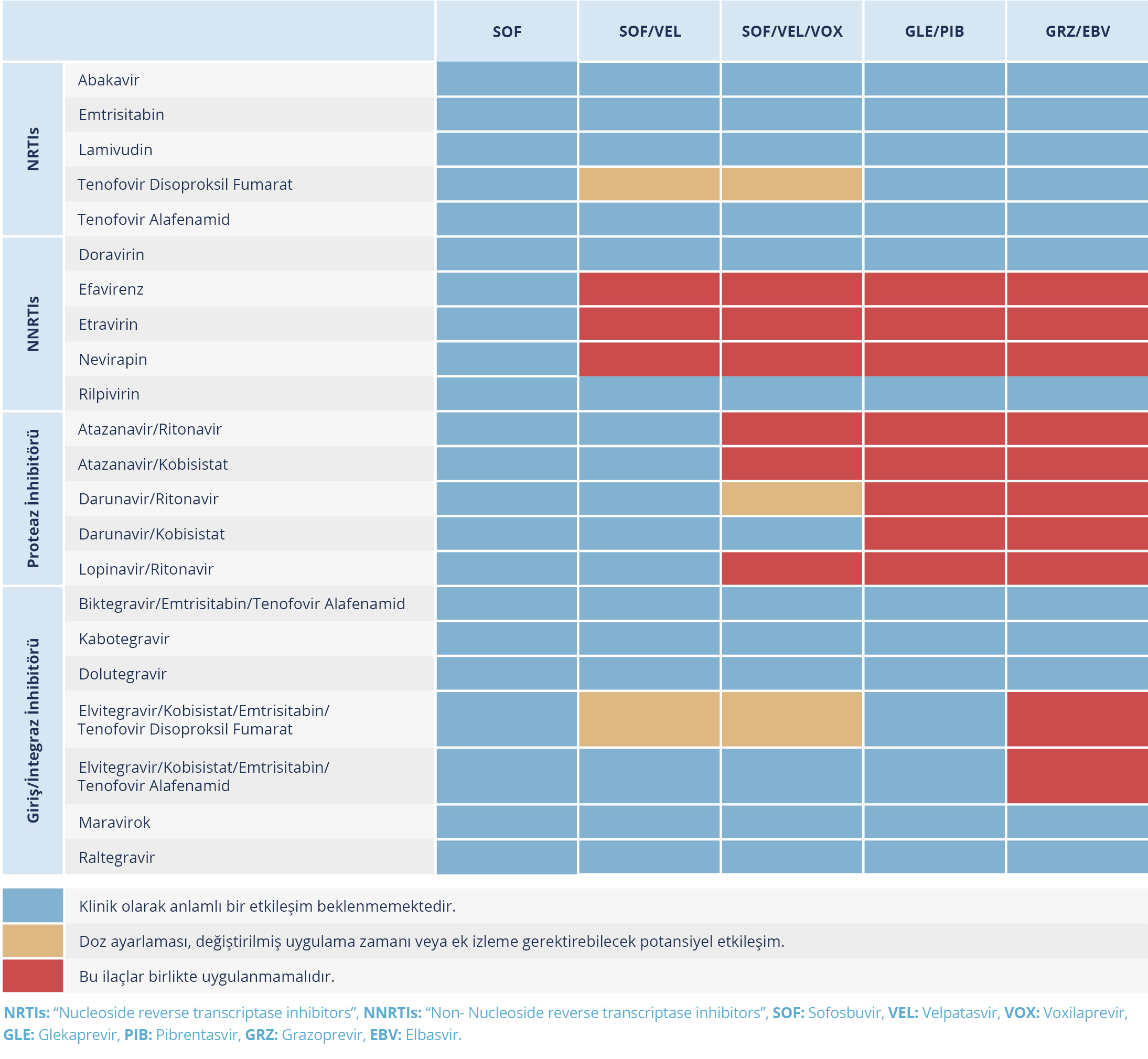
Tablo 3. Doğrudan Etkili Antiviral İlaçlar ile Antiretroviral İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
Bir DEA ile tedaviye başlamadan önce hastadan; tüm reçeteli veya reçetesiz satılan ilaçlar, bitkisel veya vitamin preparatları ve her türlü yasa dışı uyuşturucu kullanımı açısından ayrıntılı ilaç öyküsü alınmalıdır. Doğrudan etkili antiviraller ile olası etkileşimler için dikkate alınması gereken belli başlı ilaçlar arasında; proton pompası inhibitörleri, statinler, etinilöstradiyol içeren kontraseptif ajanlar, antibiyotikler, antiepileptik ilaçlar, amiyodaron, siklofilin ve rapamisin (mTOR inhibitörleri), immünosüpresif ajanlar ve antiretroviral ilaçlar (ART’ler) yer almaktadır. Kalıcı viral yanıt elde edilemeyen hastalar için ilaç uyumunun yanı sıra ilaç-ilaç etkileşimleri gözden geçirilmeli ve yeniden tedavi konusu daha kapsamlı olarak ele alınmalıdır (63).
Tedaviye başlamadan önce eş zamanlı olarak her hastanın kullandığı ilaçların gözden geçirilmesi, ilaç etkileşimleri için Liverpool Üniversitesi Hepatit İlaç Etkileşimleri internet sitesinin (https://www.hep-druginteractions.org/) kullanılması veya rehberdeki tablolara bakılması önerilir (Tablo 3-9).
Sofosbuvir
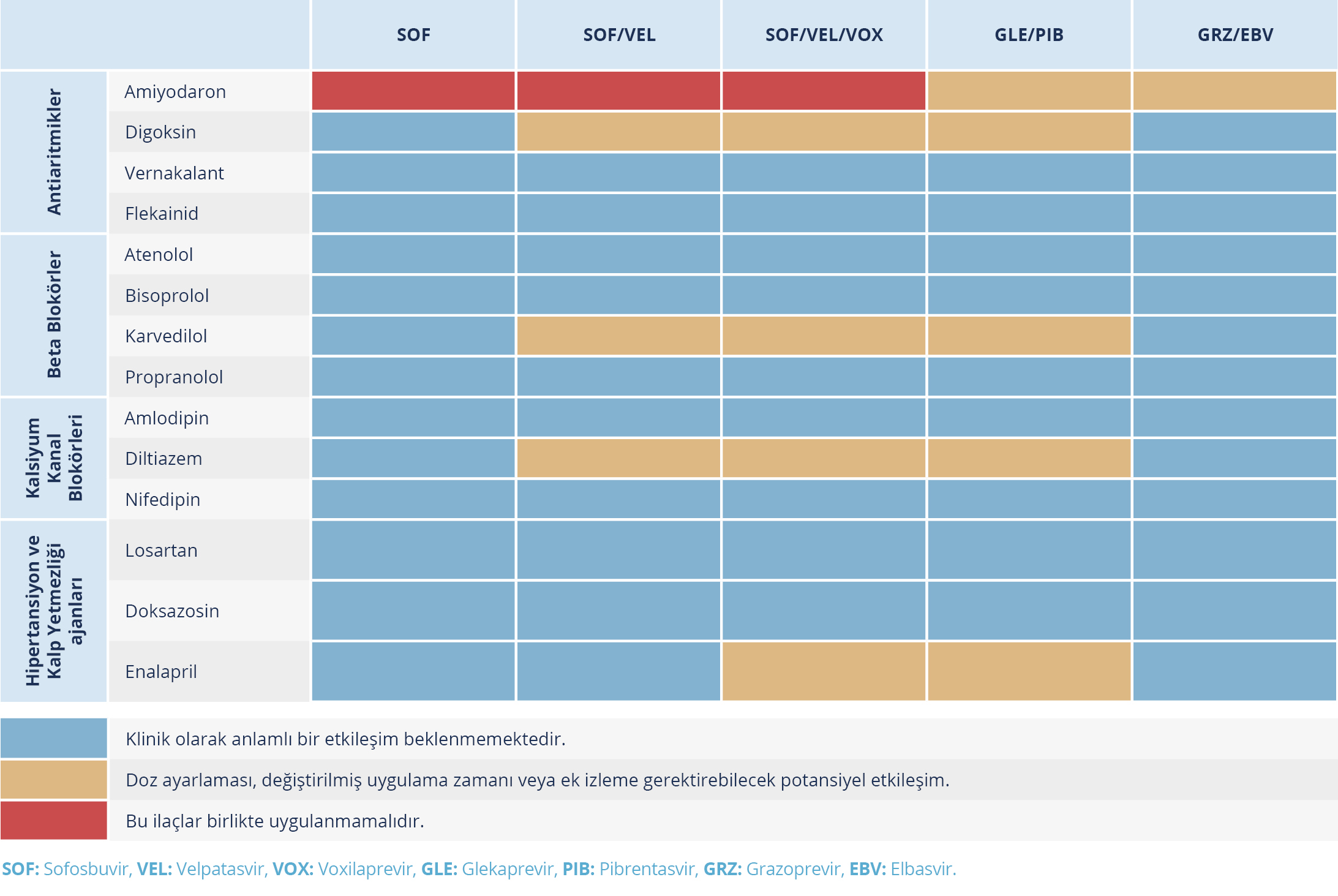
Tablo 4. Doğrudan Etkili Antiviral İlaçlar ile Kardiyovasküler İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
Sofosbuvir (SOF), CYP tarafından metabolize edilmez ancak P-gp tarafından taşınır. Güçlü P-gp indükleyicileri olan ilaçlar, SOF plazma konsantrasyonlarını önemli ölçüde azaltır ve terapötik etkinin azalmasına neden olabilir. Bu nedenle SOF; rifampisin, karbamazepin, fenobarbital, fenitoin veya sarı kantaron gibi bilinen P-gp indükleyici ilaçlar ile birlikte kullanılmamalıdır (24).
Sofosbuvirin ART’ler [efavirenz, tenofovir disoproksil fumarat (TDF), emtristabin, rilpivirin, ritonavir destekli darunavir ve raltegravir dahil] ile olan ilaç etkileşim çalışmaları, klinik olarak anlamlı herhangi bir etkileşim tanımlamamıştır (Tablo 3) (64).
Sofosbuvirin bazlı rejimler, yaşamı tehdit eden aritmi riski nedeniyle antiaritmik bir ilaç olan amiyodaron kullanan hastalarda kontrendikedir. Doğrudan etkili antivirallere başladıktan sonraki saatler içinde bradikardi gözlenebilmektedir; olguların çoğunda ise bu etki HCV tedavisi başladıktan sonra ikinci haftada ortaya çıkmaktadır (Tablo 4) (65). Amiyodaronun yarı ömrünün uzun olması nedeniyle kalp pili olmayan hastalarda, amiyodaron kesilerek SOF içeren bir tedavi rejimi başlanacaksa üç ay beklenmesi önerilir.
Sofosbuvir ve Velpatasvir
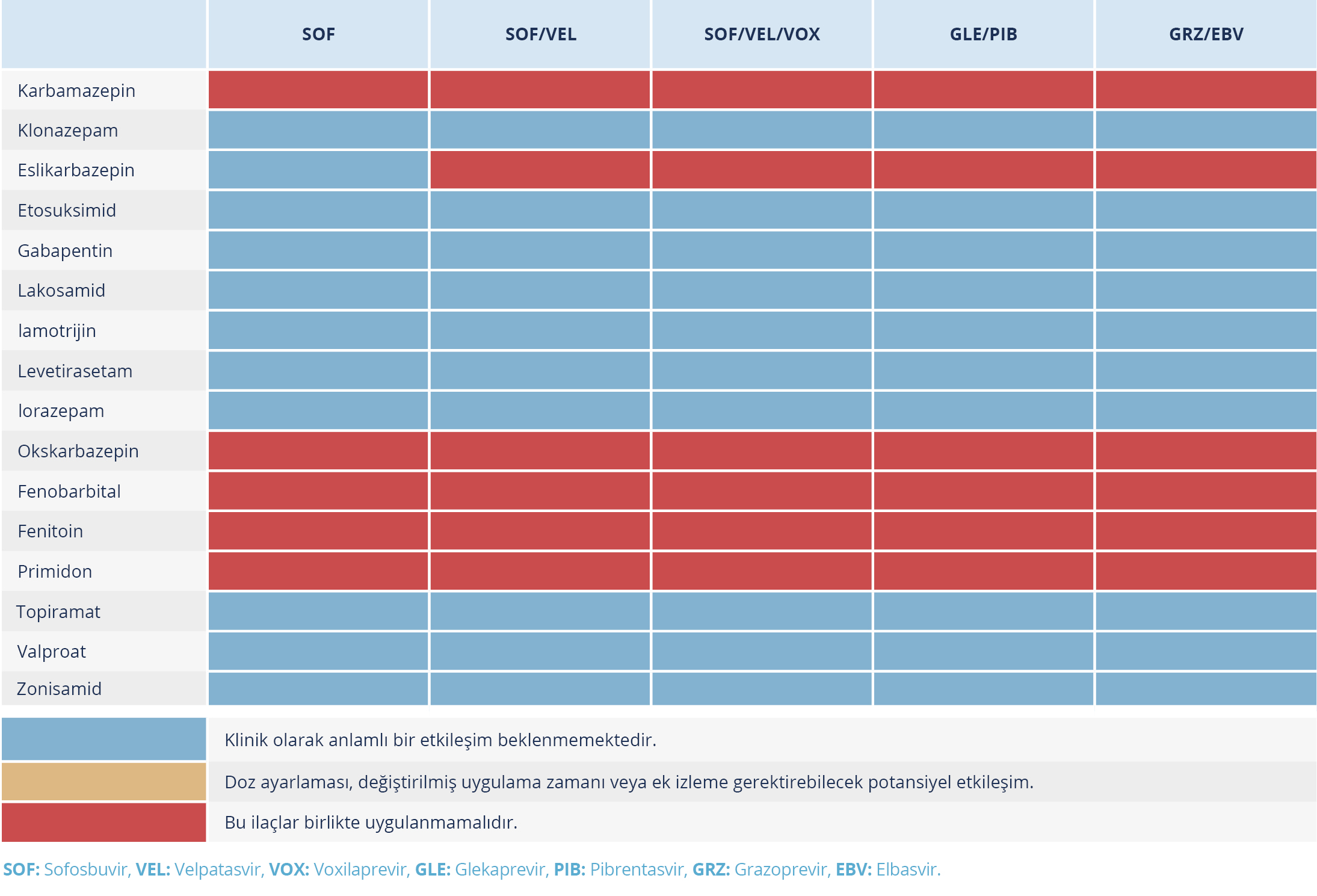
Tablo 5. Doğrudan Etkili Antiviral İlaçlar ve Antikonvülsan İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
Velpatasvir (VEL) TDF ile birlikte uygulandığında TDF maruziyetini artırabilir ve glomerüler filtrasyon hızı 60 m/dk’nın altında olan veya TDF ile birlikte ritonavir veya kobisistat içeren ART kullanan hastalarda sorun teşkil edebilir. Ritonavir veya kobisistat içeren ART rejimi kullanan hastalarda TDF yerine tenofovir alafenamid (TAF) içeren tedavi rejimleri kullanılmalıdır (Tablo 3) (63). TDF’nin ritonavir veya kobisistat ile kombinasyonu gerekliyse, hasta SOF/VEL alırken böbrek parametreleri başlangıçta ve sonrasında düzenli olarak kontrol edilmelidir (24,66).
Rifampisin, rifabutin, karbamazepin, fenobarbital, fenitoin gibi güçlü P-gp veya güçlü CYP indükleyici ilaçlar, SOF ve/veya VEL maruziyetindeki azalma ve etkinlikte potansiyel bir kayıp nedeniyle kontrendikedir (Tablo 5).
VEL’in çözünürlüğü, mide sıvısının pH’sı arttıkça azalır. Bu nedenle antasitlerin, H2 reseptör antagonistlerinin ve proton pompası inhibitörlerinin VEL ile birlikte kullanılmasından kaçınılmalıdır. Gerekli görülürse SOF/VEL yemeklerle birlikte kullanılmalı ve proton pompa inhibitörü kullanmadan önce iki ilaç arasında en az dört saat olmalıdır (24,66).
Sofosbuvir, Velpatasvir ve Voksilaprevir
SOF/VEL/VOX, darunavir haricindeki diğer HIV proteaz ilaçları ile etkileşime girmektedir. Atazanavir, lopinavir inhibitör etkisi nedeniyle VOX maruziyetinde belirgin bir artışa, SOF/VEL maruziyetinde ise orta derecede artışa yol açtığından birlikte kullanımı önerilmemektedir. Elvitegravir/emtristabin/TAF ile kombinasyon halinde SOF/VEL/VOX kobisistat ile birlikte uygulanması önemli etkileşimlere yol açmamıştır; kobisistat ve atazanavir ile birlikte kullanılması ise önerilmemektedir. TDF içeren rejimlerde ise hastalar, akut böbrek hasarı ve kemik mineral yoğunluğu kaybı gibi TDF ile ilişkili yan etkiler açısından yakından izlenmelidir (Tablo 3) (63).

Tablo 6. Doğrudan Etkili Antiviral İlaçlar ve Lipit Düşürücü İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
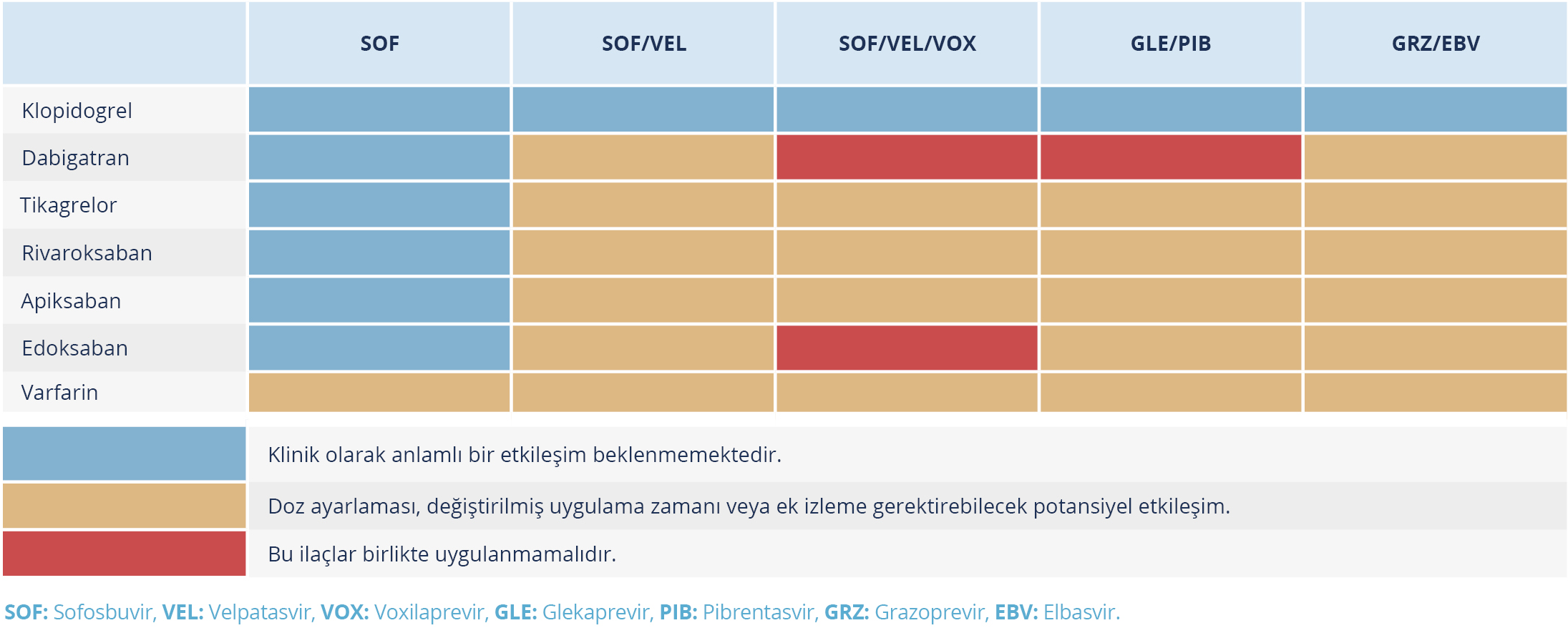
Tablo 7. Doğrudan Etkili Antiviral İlaçlar ve Antikoagülan veya Antiagregan İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
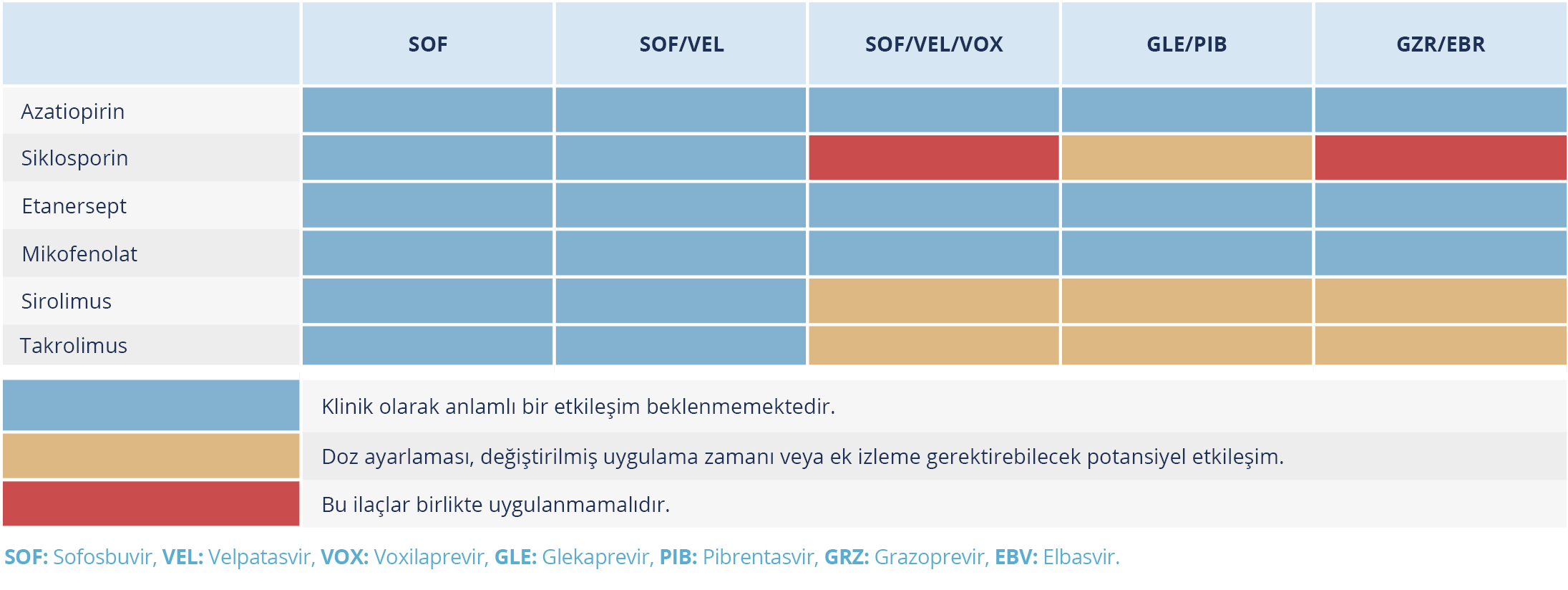
Tablo 8. Doğrudan Etkili Antiviral İlaçlar ve İmmünosüpresanlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
Hem VEL hem de VOX P-gp inhibe ettiği için lipid düşürücü rosuvastatin, atorvastatin, fluvastatin, lovastatin, pitavastatin ve simvastatinin plazma maruziyetinde 19 kat artışa yol açar (Tablo 4) (24). Bu nedenle birlikte kullanımı kontrendikedir. Ayrıca metotreksat, mitoksantron, imatinib, irinotekan, lapatinib, sülfasalazin ve topotekan gibi ilaçlarla da birlikte kullanımı önerilmemektedir. Yine dabigatran farmakokinetik olarak eğri altında kalan alanda yaklaşık üç kat artış nedeniyle kontrendikedir (Tablo 7) (24).
Digoksin, tikagrelor ve karvedilol dozunun ayarlanması veya artan maruziyet nedeniyle yakın izlem gerekebilir. VOX, plazma maruziyeti 19 kat arttığı için siklosporin, edoksaban kombinasyonlarının hiçbiri ile önerilmez (Tablo 8) (24).
Doğurganlık çağındaki kadınlar için, ALT yükselme riski nedeniyle, etinilöstradiyol içeren kontroseptiflerle birlikte kullanımı kontrendikedir. Bunun yerine progesteron içeren kontrasepsiyon yöntemi kullanılabilir (63,24).
Glekaprevir ve Pibrentasvir
Glekaprevir (GLE)/pibrentasvir (PİB) ve tüm HIV proteaz inhibitörlerinin birlikte uygulanması hem GLE hem de PIB maruziyetinin belirgin şekilde artması ve ALT düzeyinde yükselme riski nedeniyle kontrendikedir. Ayrıca elvitegravir/kobisistat/emtristabin/TAF ile birlikte uygulanması, GLE maruziyetini kabul edilebilir sınırlar içinde artırmaktadır (Tablo 3) (63,24).
Rifampisin, karbamazepin, sarı kantaron veya fenitoin gibi güçlü P-gp ve CYP3A’yı indükleyen ilaçlar GLE/PIB konsantrasyonunu azaltır ve terapötik etkinin azalmasına veya virolojik yanıtın kaybına yol açabilir. Bu ilaçlar veya diğer güçlü P-gp ve CYP3A’yı indükleyen ilaçlar ile birlikte kullanılması kontrendikedir. Bununla birlikte okskarbazepin ve eslikarbazepin gibi orta derece indükleyiciler ile reçetelenmesi önerilmez (Tablo 5) (63,24).
GLE zayıf bir CYP3A inhibitörüdür ve CYP3A tarafından metabolize edilen dar bir terapötik indekse sahip olan takrolimus veya ketiyapin gibi geniş doz aralıklarına sahip ilaçlar birlikte uygulanırken dikkatli olunmalıdır (24,63).
SOF/VEL/VOX kombinasyonunda olduğu gibi doğurganlık çağındaki kadınlarda etinilöstradiyol içeren kontraseptiflerle birlikte kullanımı kontrendikedir. Bunun yerine progesteron içeren kontrasepsiyon yöntemleri kullanılabilir (63,24).
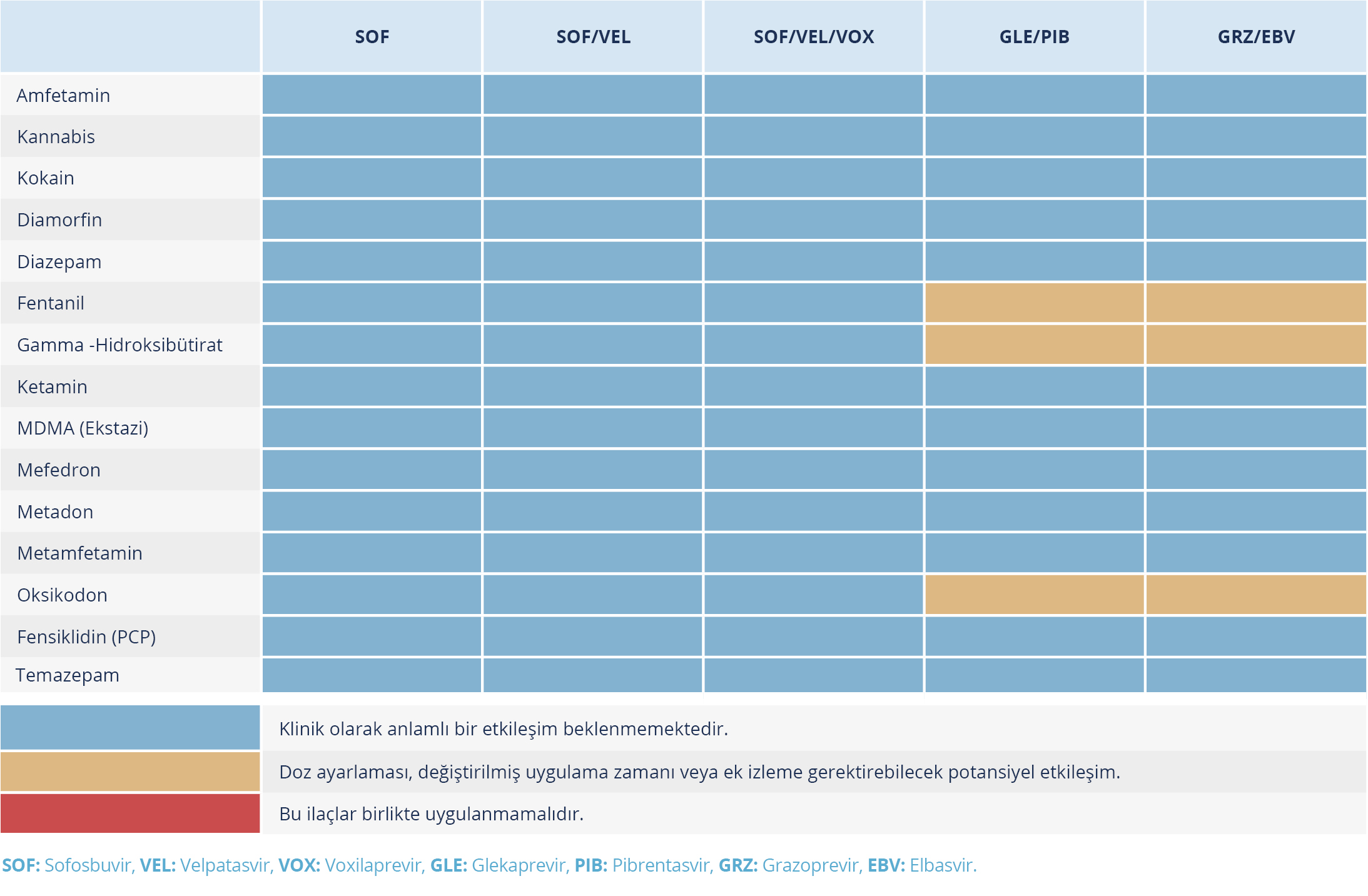
Tablo 9. Doğrudan Etkili Antiviral İlaçlar Yasadışı/Keyif Verici İlaçlar veya Kötüye Kullanılan İlaçlar Arasındaki Etkileşimler (Kaynak 24’ten uyarlanmıştır.)
Diğer DEA ilaçlara benzer şekilde GLE/PIB tedavisi sırasında mide sıvısının pH’si yükseldikçe GLE’nin çözünürlüğü azalır (24,66). Yapılan çalışmalarda bu azalmanın KVY sonucunu etkilemediği belirtilmekle birlikte söz konusu çalışmalarda omeprazol 20 mg dozundadır. Daha yüksek dozlarda omeprozol kullanımı durumunda, GLE konsantrasyonlarında daha büyük bir düşüş olduğu gözlenmiştir. Bu nedenle diğer DEA ilaçlarda olduğu gibi proton pompası inhibitörü ihtiyacının gözden geçirilmesi önerilmektedir (24,66).
Grazoprevir ve Elbasvir
Grazoprevir (GRZ)/elbasvir (EBV), CYP3A ve P-gp substratları olduğu için ve efavirenz, etravirin, fenitoin, karbamazepin, bosentan, modafinil ve sarı kantaron gibi ilaçlar plazma maruziyetinde belirgin bir azalmaya neden olabildiğinden birlikte kullanılmaları kontrendikedir. Proteaz inhibitörleri veya bazı azol grubu antifungal ilaçlar gibi CYP3A inhibitörleri GRZ/EBV plazma konsantrasyonlarını belirgin şekilde artırabildiği için birlikte kullanılması kontrendikedir. Bununla birlikte, mide asit azaltıcı ilaçların emilim üzerinde hiçbir etkisi yoktur (24) Antiretroviral tedavi seçimleri açısından abakavir, lamivudin, TDF veya TAF içeren rejimlerin yanı sıra emtristabin, rilpivirin, raltegravir, dolutegravir, maravirok, doravirin, biktegravir ve kabotegravir GRZ/EBV birlikte kullanılabilir (Tablo 3) (24).
Öneriler
- DEA ile tedavi öncesi, tüm reçeteli veya reçetesiz satılan ilaçlar, bitkisel veya vitamin preparatları ile her türlü yasa dışı uyuşturucu kullanımı açısından hastalardan ayrıntılı bir ilaç öyküsü alınmalıdır.
- KVY elde edilemeyen hastalar için ilaç uyumunun yanı sıra ilaç-ilaç etkileşimleri gözden geçirilmelidir.
- SOF bazlı rejimler, yaşamı tehdit eden aritmi riski nedeniyle amiyodaron kullanan hastalarda kontrendikedir.
- Amiyodaron kesilerek SOF içeren bir tedavi rejimi başlanacaksa üç ay beklenmesi önerilir.
- VEL bazlı rejimler TDF ile birlikte uygulandığında TDF maruziyetini artırabilir.
- Glomerüler filtrasyon hızı 60 ml/dk’nın altında olan veya ritonavir veya kobisistat içeren ART rejimi kullanan hastalarda VEL kullanılacak ise TDF yerine TAF içeren tedavi rejimleri seçilmelidir.
- Rifampisin, rifabutin, karbamazepin, fenobarbital, fenitoin, sarı kantaron gibi güçlü P-gp veya güçlü CYP indükleyici ilaç kullanan hastalarda, SOF/VEL veya SOF/VEL/VOX veya GLE/PIB konsantrasyonunda azalma nedeniyle KVY kaybı ile karşılaşılabilir.
- VEL bazlı rejimler antiasitler, H2 reseptör antagonistleri ve proton pompası inhibitörleri ile birlikte kullanılmamalıdır. Bu ilaçların kullanılması gerekli ise iki ilaç arasında en az dört saat olmalı ve DEA yemekle birlikte kullanılmalıdır.
- Hem VEL hem de VOX’un bazı lipid düşürücüler (rosuvastatin, atorvastatin, fluvastatin, lovastatin, pitavastatin, simvastatinin) ile birlikte kullanımı kontrendikedir.
- Doğurganlık çağındaki kadınlarda SOF/VEL/VOX veya GLE/PIB kombinasyonlarının etinilöstradiyol içeren kontraseptiflerle birlikte kullanımı kontrendikedir. Progesteron içeren kontraseptifler tercih edilmelidir.
NAİF HASTALARDA KRONİK HEPATİT C TEDAVİSİ
Kronik HCV infeksiyonunun tedavisinin temel taşı olan antiviral tedavinin yanında semptom yönetimi, ilaçların doz ayarlaması ve varsa siroz komplikasyonlarının önlenmesi çok önemlidir. Antiviral tedavinin amacı, tedavi bitiminden 12 hafta sonra saptanamayan bir HCV RNA seviyesi olarak tanımlanan KVY elde edilmesidir. Kalıcı viral yanıt, uzun süreli takip sırasında HCV RNA’nın %97-100 oranında negatif olması ile ilişkilidir ve bu nedenle HCV infeksiyonunun kesin tedavisi yani kür elde edilmesi olarak kabul edilebilir (49). Kalıcı viral yanıt elde edilmesi, ilerlemiş karaciğer fibrozisi olan hastalar arasında bile tüm nedenlere ve karaciğere bağlı ölümlerde, karaciğer nakli ihtiyacında, HSK oranlarında ve karaciğerle ilişkili komplikasyonlarda azalma ile ilişkilendirilmiştir (67-70).
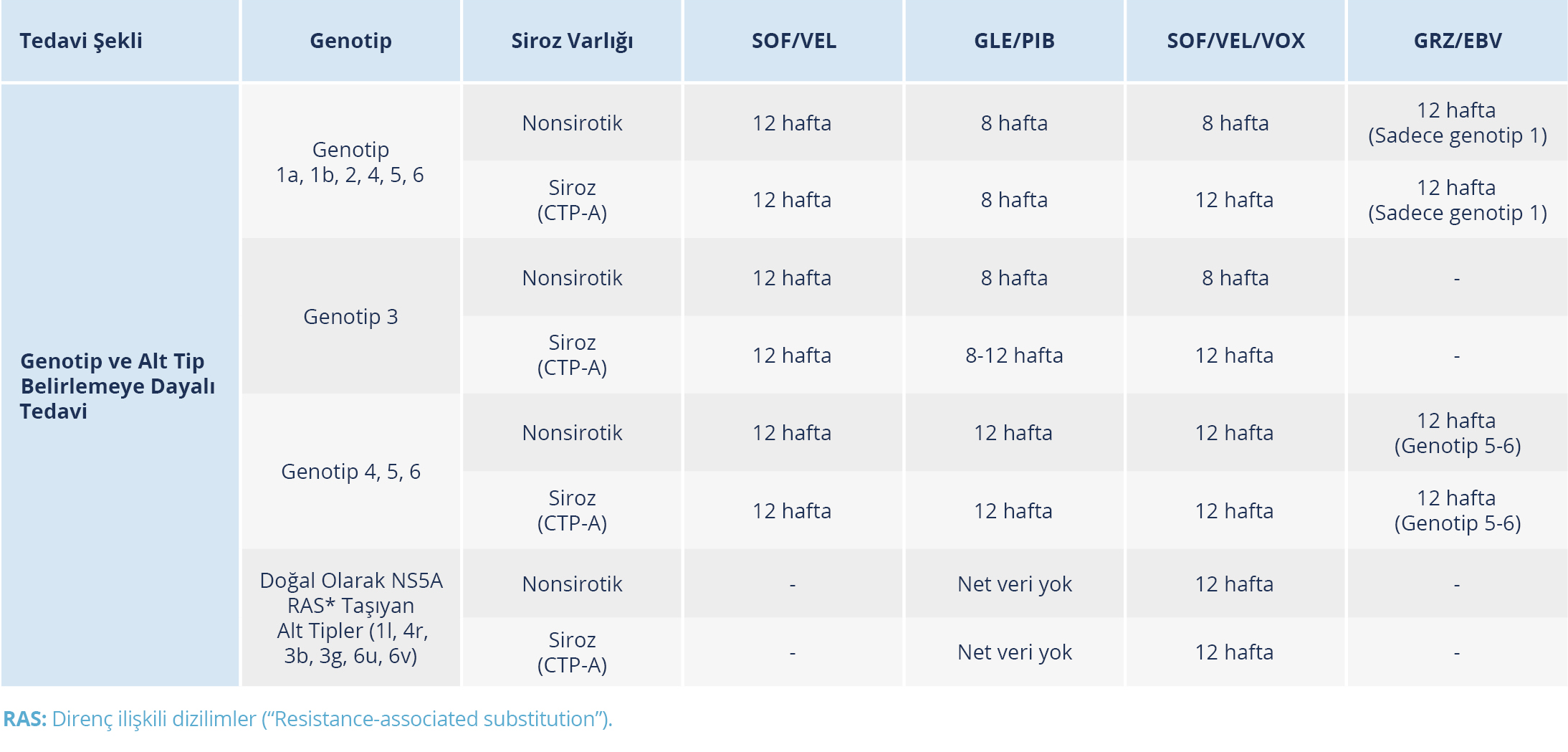
Tablo 10. Tedavi Naif Sirotik Olmayan veya Kompanse Sirozu Olan Erişkin Kronik Hepatit C Hastalarının Genotip Bağımlı Tedavisi (Kaynak 24’ten uyarlanmıştır.)
Yaygın olarak kullanılan bazı DEA rejimleri pangenotipik etkilidir ve bu nedenle tedavi kararlarının verilmesinde HCV genotipinin bilinmesi daha az önemli hale gelmiştir. Tedavi görmemiş ve siroz kanıtı olmayan hastalarda genotipin rutin olarak tetkik edilmesine gerek olmamakla birlikte, belirli rejimlerle tedavi kararları için bazı hasta popülasyonlarında (sirozlu veya daha önce tedavi başarısızlığı olanlar, vb.) genotipin bilinmesi önerilmektedir (71) (Tablo 10). Hastalar için rejim seçimi yapılırken rejimin etkililiği, süresi, yan etki profili, potansiyel ilaç etkileşimleri ve karaciğerdeki fibrozis derecesi de dikkate alınmalıdır.
Genotip 1’le İnfekte Hastalarda Tedavi
Sofosbuvir/Ledipasvir
NS5A inhibitörü ledipasvir (LDV) (90 mg) ve NS5B inhibitörü SOF (400 mg) günde bir kez sabit doz kombinasyon tableti halinde mevcut olup bu kombinasyon genotip 1 infeksiyonu olan ve tedavi naif hastaların tedavisinde de önerilmektedir. Tedavinin süresi viral yüke ve siroz varlığına bağlıdır. Viral seviyeleri <6 milyon İÜ/ml olan, tedavi naif, sirotik olmayan hastalar için sekiz haftalık tedavi yeterli görünmektedir. Viral yükü >6 milyon İÜ/ml olan veya sirozu olan tedavi naif hastalar için ise SOF/LDV 12 hafta süreyle verilmelidir. Sirozu olan ve olmayan hastalarda, bu rejimlerle tedavi %95’in üzerinde KVY oranları ile sonuçlanır. SOF/LDV’nin etkinliği, tedaviye ribavirin (RBV) eklenmesiyle önemli ölçüde artmış gibi görünmemekle birlikte, gerçek yaşam verilerini içeren gözlemsel çalışmalarda yüksek etkinlik gözlenmiştir (72-76).
Sofosbuvir/Velpatasvir
SOF/VEL’in pangenotipik rejimi, KHC’li hastaların büyük çoğunluğu için tercih edilebilecek antiviral rejimlerden biridir. NS5B inhibitörü SOF (400 mg) ve NS5A inhibitörü VEL (100 mg) günde bir kez sabit doz kombinasyon tableti halinde mevcuttur; 12 haftalık tedavi siroz olup olmadığına bakılmaksızın genotip 1 infeksiyonu olan, tedavi naif hastalarda oldukça etkilidir. Bu rejim, yaklaşık %99’luk KVY oranlarına sahiptir (77-79). On iki hafta boyunca SOF/VEL alan 328 genotip 1 ile infekte hastayı içeren randomize, plasebo kontrollü bir çalışmada, genotip 1a ve 1b ile infekte hastaların sırasıyla %98 ve %99’unun KVY elde ettiği görülmüştür (77). Yanıt oranları, tedavi öyküsünden veya siroz varlığından bağımsız olarak benzer bulunmuştur (77-79).
Sofosbuvir/Velpatasvir/Voksilaprevir
Tek bir tablette 400 mg SOF, 100 mg VEL ve 100 mg VOX içeren üç ilaçlı sabit doz pangenotipik etkili kombinasyon halinde mevcuttur. Günde bir kez, yemekle birlikte, ağızdan tek tablet şeklinde alınması önerilmektedir (80). Bu kombinasyon genotip 1a ve 1b hastaları için son derece etkili bir seçenektir.
VOX in vitro olarak CYP3A4 tarafından metabolize edilir ve plazmadaki ilacın büyük çoğunluğu ana ilaçtır. VEL ve VOX ilaç taşıyıcıları olan P-gp, BCRP, OATP1B1 ve OATP1B32ün inhibitörleridir. Biliyer atılım VOX için ana eliminasyon yoludur. SOF/VEL/VOX uygulamasını takiben VOX’un medyan terminal yarılanma ömrü yaklaşık 33 saattir. Kompanse sirozu (CTP-A) olan hastalarda ve böbrek yetmezliği (diyaliz hastaları dahil) durumunda doz ayarlaması gerekli değildir; orta (CTP-B) veya şiddetli (CTP-C) karaciğer yetmezliği olan hastalarda ise kullanılmamalıdır (80).
SOF/VEL/VOX ile virolojik başarısızlık, NS3 ve NS5A proteinlerinde değişikliklerin ortaya çıkmasıyla ilişkilendirilmesine rağmen, bu proteinlerde veya NS5B proteininde önceden var olan değişiklikler daha düşük KVY oranları ile ilişkili bulunmamıştır (80).
Glekaprevir/Pibrentasvir
NS3/4A proteaz inhibitörü GLE (300 mg) ve NS5A inhibitörü PIB (120 mg); pangenotipik günde bir kez sabit doz kombinasyonu, tedavi naif, nonsirotik ve kompanse sirotik, genotip 1 ile infekte hastalar için tercih edilen rejimlerden biridir. Tedavi naif hastalara siroz olup olmadığına bakılmaksızın GLE/PIB sekiz hafta süreyle verilir. Kompanse sirozu olan hastalar için bu süre daha önce 12 hafta olarak önerilirken, güncellenen veriler bu popülasyon için de sekiz haftanın yeterli olduğunu göstermektedir. Söz konusu rejim yaklaşık %98-99’luk KVY oranlarına sahiptir (81-84).
Farmakolojik sorunlar bu rejimin kullanımını sınırlayabilir. GLE/PIB herhangi bir derecede böbrek yetmezliği olan hastalarda kullanılabilmesine rağmen, orta ila şiddetli (CTP-B veya C) sirozu olan hastalarda kontrendikedir.
Grazoprevir/Elbasvir
NS5A inhibitörü EBV ve NS3/4A proteaz inhibitörü GRZ’nin günde bir kez sabit doz kombinasyonu, tedavi naif, genotip 1 ile infekte, sirozu olan ve olmayan hastalarda oldukça etkilidir. Bununla birlikte EBV’ye yüksek düzeyde direnç sağlayan belirli NS5A RAS’ları (Direnç ilişkili dizilimler :“Resistance-associated substitution”), 12 haftalık bir rejimin etkinliğini azaltır. Bu nedenle tedavi süresi ve rejime RBV eklenmesi, alt tipe ve önceden var olan herhangi bir RAS’ın varlığına bağlıdır. Tedavi naif, genotip 1 ile infekte hastalar GRZ/EBV almadan önce NS5A RAS’ları için test edilmelidir; RAS’ı olmayanlar için rejim 12 hafta süreyle ve RAS’ları olanlar için ise kombinasyon tedavisi, kilo bazlı olarak RBV (günlük doz <75 kg olanlar için 1000 mg ve ≥75 kg olanlar için 1200 mg) ile 16 hafta boyunca verilir. Tedavi naif, genotip 1b hastalarına bu tedavi kombinasyonu 12 hafta süreyle önerilmektedir. Sirozlu ve sirozsuz hastalarda süre aynıdır ve KVY oranları %95’in üzerindedir (85-87). Bu kombinasyon tedavisi CTP- B ve C sirozda kontrendikedir. Ek olarak GRZ/EBV tedavisi HIV/HCV koinfekte hastalar, metadon veya buprenorfin gibi damar içi madde kullananlar ve hemodiyaliz bağımlı şiddetli böbrek yetmezliği olan hastalar gibi belirli popülasyonlarda da güvenli ve etkili görünmektedir (88-91).
Genotip 1a infeksiyonu olan hastalar arasında, sadece 12 haftalık tedavi ile KVY oranları, NS5A geninde önceden RAS’ları (M28, Q30, L31 ve Y93 pozisyonlarındaki polimorfizmler) olan hastalarda daha düşük bulunmuştur; bunların genotip 1a virusların yaklaşık %11’inde meydana geldiği tahmin edilmektedir (87).
Farmakolojik sorunlar bu rejimin kullanımını sınırlayabilir. Herhangi bir derecede böbrek yetmezliği olan hastalarda kullanılabilmesine rağmen, orta ila şiddetli (CTP-B veya C) sirozu olan hastalarda kontrendikedir.
Simeprevir/Sofosbuvir
Protease inhibitörü (PI) olan simeprevir (SMV) oral olarak günde bir kez 150 mg ile SOF’un kombinasyonu, KHC olan hastaların çoğunluğu için son derece etkili görünmektedir; ancak kullanımını destekleyecek veriler diğer seçeneklere göre biraz daha sınırlıdır. Bu kombinasyon sirozu olmayanlara 12 hafta, sirozu olanlara 24 hafta süreyle verilir. SMV+ SOF tedavisine kilo bazlı RBV (<75 kg ise 1000 mg/gün veya ≥75 kg ise 1200 mg/gün) eklenmesinin net bir etkinlik yararı yoktur. Bu rejimin kullanımına ilişkin kanıtlar COSMOS ve OPTIMIST çalışmalarından gelmektedir. OPTIMIST-1 çalışmasında, sirozu olmayan 310 genotip 1 ile infekte hasta, SMV+SOF ile 8 ile 12 haftalık tedaviye rastgele ayrılmıştır (92). Genel KVY oranları 12 haftalık tedavide 8 haftalık tedaviye kıyasla daha yüksek bulunmuştur (%97 vs %83). Alt tip 1a infeksiyonu olan hastalar arasında, SMV+pegile interferon(PEG-IFN) ve RBV’ye azalmış yanıt oranları ile ilişkilendirilmiş olan Q80K viral varyantının varlığı, değişken KVY oranları ile ilişkili bulunmamıştır. Buna karşılık, sirozu olan 103 hastayla yapılan OPTIMIST-2 çalışmasında, 12 haftalık SMV+SOF ile genel KVY oranları daha düşük (tedavi görmemiş hastalarda %88) saptanmıştır (93). Özellikle Q80K varyantı ile alt tip 1a ile infekte olmuş 34 hasta arasında KVY oranının sadece %74 olduğu görülmüştür. Önceki sınırlı veriler, sirozlu hastalarda 24 haftalık tedavinin daha etkili olabileceğini düşündürmüştür. COSMOS çalışmasında elde edilen sonuçlarla ayrıca RBV eklenmesinin bir yararı olmadığı öne sürülmüştür (93). OPTIMIST çalışmalarında RBV değerlendirilmemiştir (92,93). Bu çalışmalarda rejimin, kompanse sirozu (CTP-A) olan hastalarda bile iyi tolere edildiği bildirilmiştir.
SMV ile ilgili farmakolojik sorunlar bu rejimin kullanımını sınırlayabilir. SMV’nin eliminasyonu karaciğer tarafından yapılır ve orta (CTP- B) veya şiddetli (CTP-C) karaciğer bozukluğu olan hastalarda kullanılmamalıdır.
Genotip 2 ile İnfekte Hastalarda Tedavi
Sofosbuvir/Velpatasvir
Tedavi naif, genotip 2 ile infekte hastalar için SOF/VEL (tüm hastalar için 12 hafta) veya GLE/PIB (sekiz hafta süreyle) tedavileri önerilmektedir. Bu rejimler genotip 2’ye karşı son derece etkilidir ve tedaviye RBV eklenmesini gerektirmez. Aralarındaki seçim, öncelikle ilaç etkileşimi potansiyeline ve dozla ilgili hasta tercihine bağlıdır (örneğin GLE/PIB, yemeklerle birlikte günde bir kez üç tablet kullanılır; ancak siroz yokluğunda 12 hafta yerine sekiz hafta verilebilir) (77,78,94).
İlk çalışmalarda, 12 hafta boyunca SOF/VEL ile tedavi edilen genotip 2 ile infekte hastalarda virolojik alevlenme veya nüks olgusu bildirilmemiştir (77,78,94). Randomize, plasebo kontrollü bir çalışma, 10’u sirozlu ve çoğunluğu tedavi naif olan 104 genotip 2 ile infekte hastanın %100’ünde KVY bildirmiştir (77). Genotip 2 infeksiyonu olan 266 hastayı içeren (çoğunluğu tedavi naif) bir diğer çalışmada, 12 haftalık SOF/VEL ile KVY oranı %99 iken bu oran 12 hafta boyunca SOF+RBV ile %95 olmuştur (94).
Sofosbuvir/Velpatasvir/Voksilaprevir
POLARIS-2 çalışmasında kompanse sirozu olan veya olmayan, tedavi naif hastalar sekiz hafta SOF/VEL/VOX veya 12 hafta SOF/VEL alacak şekilde randomize edilmiş ve SOF/VEL/VOX tedavi grubunda genotip 2 ile infekte hastalar için %97 oranında KVY elde edilmiştir (95).
Glekaprevir/Pibrentasvir
Sirozu olmayan ve genotip 2 infeksiyonu olan 145 hasta üzerinde yapılan bir çalışmada, sekiz haftalık GLE/PIB tedavisi ile %98’lik KVY elde edilmiştir (96). Bu hasta grubunda 12 haftalık tedavi, daha yüksek KVY oranı ile ilişkili bulunmamıştır (82). Bir diğer çalışmada daha önce tedavi görmemiş, kompanse sirozu ve genotip 2 infeksiyonu olan 26 hastada sekiz haftalık tedavi ile %100’lük bir KVY oranı elde edilmiştir (97).
Genotip 3’le infekte Hastalarda Tedavi
Sofosbuvir/Velpatasvir
Tedavi görmemiş genotip 3 ile infekte hastalar için SOF/VEL tedavisi önerilmektedir. Bir çalışmada sirozu olmayan, tedavi naif 163 hastaya 12 hafta boyunca SOF/VEL kombinasyonu verilmiş ve KVY oranı %98 olarak saptanmıştır (94).
Daha önce tedavi görmemiş kompanse sirozu olan hastalar, SOF/VEL’e olumsuz tedavi yanıtıyla ilişkilendirilen Y93H varyantı için test edilmelidir (84,97). Y93H varyantı olmayan, kompanse sirozlu 43 hastada 12 haftalık SOF/VEL tedavisi ile %93’lük bir KVY oranı bildirilmiştir; Y93H varyantı olanlarda bu yanıtın %84’e kadar düştüğü tespit edilmiştir (94).
Glekaprevir/Pibrentasvir
Tedavi görmemiş genotip 3 ile infekte hastalar için GLE/PIB tedavisi de önerilmektedir. Sirozu olmayan, tedavi naif 157 hastada sekiz hafta GLE/PIB tedavisiyle %95 KVY elde edilmiştir. Aynı kombinasyonun 12 hafta uygulandığı 233 hastada, benzer şekilde %95’lik bir KVY gözlenmiştir (81). GLE/PIB kesin olarak kullanılacaksa Y93H varyant testi gerekli değildir (84,97).
Daklatasvir+Sofosbuvir
Sirozu olmayan hastalar için daklatasvir (DCV)+SOF diğer seçeneklerle eşit derecede etkili bir alternatiftir ve öncelikle başka seçeneklere erişimi olmayan bölgelerde kullanılabilir. Aralarındaki seçim öncelikle ilaç etkileşimi potansiyeline, RBV ilavesinin gerekli olup olmadığına, geri ödeme önceliklerine ve dozla ilgili hasta tercihine bağlıdır. Her rejimin uygulanması siroz varlığına bağlıdır. Daha önce tedavi almamış, sirozu olmayan hastalar için tedavide kullanılacak ilaç rejimleri ve süreleri ile ilgili değişik veriler mevcuttur. Yapılan bir çalışmada, 115 hastanın 12 haftalık DCV+SOF kombinasyonu ile tedavisi sonucunda KVY oranı %97 olarak tespit edilmiş ve GLE/PIB tedavi yanıtı ile arasında istatistiksel olarak anlamlı düzeyde fark bulunmamıştır (81).
Daha önce tedavi görmemiş kompanse sirozu olan hastalar, DCV+SOF’a olumsuz tedavi yanıtıyla ilişkilendirilen Y93H varyantı için test edilmelidir (84,97).
Tedavi sürelerinin daha uzun ve yan etkilerinin daha fazla olması nedeniyle SOF+RBV de dahil olmak üzere tedavideki diğer seçenekler daha az tercih edilmektedir. Söz konusu tedaviler; etkililik veya güvenlik artışı olmaksızın daha yüksek maliyete neden olur ve yeterince araştırılmamıştır (98-103).
Y93H varyantı varsa SOF/VEL yerine SOF/VEL/VOX kullanılması önerilmekte olup bu tedavi sirozu olan hastalar için oldukça etkilidir (95). Optimal süre belirsiz olmakla birlikte genel olarak 12 haftalık tedavi önerilmektedir (24,43). Bir diğer alternatif, suboptimal KVY oranını iyileştirmeye çalışmak için Y93H varyantı mevcut olduğunda SOF/VEL’e 12 hafta boyunca kilo bazlı RBV eklemektir (104). POLARIS-2 ve 3 çalışmalarında HCV genotip 3 ile infekte olan hastalar, SOF/VEL/VOX ile tedavi edilmiştir. Hastaların yaklaşık %75’inin tedavi naif olduğu POLARIS-2 çalışmasında, sekiz haftalık tedaviden sonra KVY oranı %99, POLARIS 3 çalışmasında ise %96 olarak bulunmuştur (95).
Genotip 4’le İnfekte Hastalarda Tedavi
SOF/LDV, SOF/VEL, SOF/VEL/VOX, GLE/PIB, GRZ/EBV ve SOF+RBV genotip 4’e karşı yüksek etkinliğe sahiptir. Aralarındaki seçim öncelikle ilaç etkileşimi potansiyeline ve maliyetine bağlıdır. Bunlar sorun değilse, RBV’den kaçınmak ve bu rejimlerle uygulama kolaylığı (günde bir kez dozlama) için SOF/LDV, SOF/VEL veya GLE/PIB tercih edilebilir (24,43).
Sofosbuvir/Ledipasvir
SOF/LDV kombinasyonu, tedavi öyküsü veya siroz varlığına bakılmaksızın 12 hafta boyunca günde bir kez verilebilir. Dokuzunda ilerlemiş fibrozis veya siroz (METAVIR F3-4) bulunan ve sekizinde daha önceki PEG-IFN+RBV tedavisinin başarısız olduğu, genotip 4 ile infekte 21 hasta üzerinde yapılan bir çalışmada, 12 haftalık SOF/LDV tedavisi ile %95 KVY elde edildiği bildirilmiştir (105). Benzer bir çalışmada, daha önce tedavi almamış, genotip 4 ile infekte 22 hastanın %96’sında KVY elde edilmiştir (106).
Sofosbuvir/Velpatasvir
Genotip 4 infeksiyonu için tedavi öyküsü veya siroz varlığına bakılmaksızın, 12 hafta boyunca günde bir kez SOF/VEL kullanılabilir. Bu rejimin kullanıldığı, çoğunluğu tedavi naif ve genotip 4 infeksiyonu olan 116 hastanın tamamının tedavisinin KVY ile sonuçlandığı bildirilmiştir (77). POLARIS-2 çalışmasında tedavi naif hastalarda sekiz haftalık SOF/VEL/VOX ile KVY oranı genotip 4 için %94 bulunmuştur (95).
Glekaprevir/Pibrentasvir
GLE/PIB sabit doz kombinasyonu (günde bir kez üç tablet) sirozu olmayan hastalara ve daha önce tedavi görmemiş kompanse sirozu olan hastalara sekiz haftalık bir tedavi rejimi şeklinde verilebilir. Bu rejimin, genotip 4 infeksiyonu olan hastalarla yapılan çalışmalarda %93-100 arasında KVY oranları ile sonuçlandığı bildirilmiştir (83,84,107). Bu kombinasyon diyaliz hastaları da dahil olmak üzere herhangi bir derecede böbrek yetmezliği olan hastalarda kullanılabilir; ancak CTP-B ve C sirozu olan hastalarda kontrendikedir (83,84,107).
Grazoprevir/Elbasvir
GRZ/EBV genotip 4 infeksiyonu için, daha önce tedavi görmemiş hastalara 12 hafta boyunca ve kilo bazlı RBV ile 16 hafta boyunca verilebilir (108). Bu rejim, diyaliz hastaları da dahil olmak üzere herhangi bir derecede böbrek yetmezliği olan hastalarda kullanılabilir ancak CTP-B ve C sirozu olan hastalarda kontrendikedir (108).
Sofosbuvir ve Ribavirin
SOF, tedavi ve siroz geçmişine bakılmaksızın 24 hafta boyunca günde bir kez RBV ile birlikte verilir. Açık etiketli bir çalışmada, Mısır kökenli genotip 4 ile infekte olmuş hastalarda 12 veya 24 haftalık SOF+RBV tedavisi değerlendirilmiş ve 24 hafta tedavi alan, naif 14 hastanın tamamında KVY alındığı bildirilmiştir; 12 haftalık tedavi ile KVY oranları genel olarak daha düşük (%79) olarak saptanmıştır (109).
Simeprevir ve Sofosbuvir
İkinci kuşak PI olan SMV, genotip 4’e karşı aktiviteye sahiptir. Genotip 4 ile infekte hastalarda SMV+SOF bazlı rejimlere verilen yanıtların genotip 1’de görülenlere benzer olduğu göz önüne alındığında, 12 ila 24 haftalık SMV+SOF rejiminin genotip 4 için oldukça etkili olması beklenebilir (110).
Genotip 5’le İnfekte Hastalarda Tedavi
Genotip 5 infeksiyonunun tedavisine ilişkin veriler sınırlıdır. Mevcut seçenekler; her biri 12 hafta boyunca günde bir kez verilen SOF/LDV, SOF/VEL’in sabit doz kombinasyonu veya GLE/PIB’dir (siroz olmayanlar ve daha önce tedavi görmemiş kompanse sirozlu hastalar için sekiz hafta süreyle verilir). Bu kombinasyonlar az sayıda genotip 5 ile infekte olmuş hastayla yapılan çalışmalara dayalı olarak son derece etkili görünmektedir. Genotip 5 ile infekte olmuş ve daha önce tedavi görmemiş 21 hastayı içeren bir çalışmada, 12 hafta boyunca SOF/LDV tedavisiyle %95 oranında KVY elde edildiği bildirilmiştir (106).
Genotip 6’yla İnfekte Hastalarda Tedavi
Genotip 6’nın tedavisine ilişkin veriler sınırlıdır. Genotip 6 infeksiyonu için önerilen tedavi seçenekleri 12 hafta süreyle SOF/LDV, SOF/VEL veya GLE/PIB’dir (siroz olmayanlar ve daha önce tedavi görmemiş hastalar için sekiz hafta süreyle verilir). Tüm seçenekler az sayıda genotip 6 ile infekte olmuş hastayla yapılan çalışmalara dayalı olarak son derece başarılı görünmektedir. Genotip 6 ile infekte altısı sirotik ve üçü tedavi deneyimli olan 41 hastanın dahil edildiği bir çalışmada, 12 hafta süreyle SOF/VEL kombinasyonu ile %100 KVY elde edildiği bildirilmiştir (77). GLE/PIB ile yapılan çalışmalarda, sirozu olmayan genotip 6 ile infekte 30 hasta sekiz hafta süre ile, daha önce tedavi görmemiş genotip 6 ile infekte dokuz hasta yine sekiz hafta süre ile ve sirozu olan genotip 6 ile infekte 7 hasta 12 hafta süre ile GLE/PIB tedavisi almış ve hastaların tümünde KVY elde edilmiştir (83,84,96).
Pangenotipik İlaç Rejimleriyle Kronik Hepatit C’nin Basitleştirilmiş Tedavisi
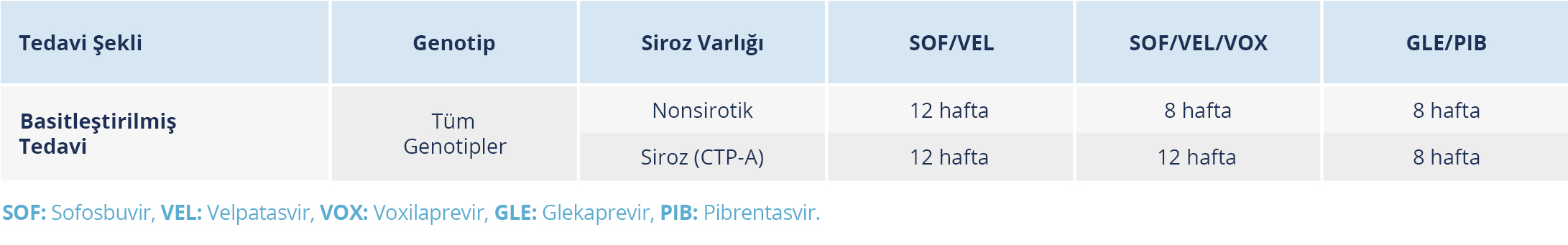
Tablo 11. Tedavi Naif Sirotik Olmayan veya Kompanse Sirozu Olan Erişkin Kronik Hepatit C Hastalarının Genotip Bağımsız Tedavisi (Kaynak 24’ten uyarlanmıştır.)
Genotip tayininin mevcut olmadığı veya karşılanabilir olmadığı durumlarda ya da tedavi basamaklarını kolaylaştırmak için HCV genotipi ve alt tipi bilgisi olmadan basitleştirilmiş tedavi yöntemleri kullanılabilir. Sirozu olmayan veya kompanse sirozu (CTP-A) olan hastalarda, hastanın tedavi deneyimi olup olmadığına bakılmaksızın SOF/VEL veya GLE/PIB ile tedaviye başlamak için HCV replikasyonunu (HCV RNA) görmek yeterlidir. Belirli HCV genotipleri ve rejimleri tedavi süresini (8 veya 12 hafta) ve hastanın tedavi sonrası gözetime ihtiyacı olup olmadığını belirleyeceği için tedaviden önce ilerlemiş fibrozis (F3) veya sirozun (F4) varlığı kontrol edilmelidir (Tablo 11). Bu amaçla FIB-4 veya APRI gibi basit bir invazif olmayan belirteç kullanılabilir. Bu bilgi mevcut değilse, kullanılan tedavi rejiminden bağımsız olarak 12 haftalık genel bir süre tercih edilebilir (23,43).
Tedavi Naif, Kompanse Sirozlu Hastalarda Tedavi
Virolojik etkinlikleri, kullanım kolaylıkları, güvenlikleri ve tolere edilebilirlikleri nedeniyle, IFN ve RBV içermeyen, pangenotipik DEA bazlı rejimler, kompanse (CTP-A) sirozlu, tedavi naif hastalarda öncelikle tercih edilmelidir. SOF/VEL, GLE/PIB ve SOF/VEL/VOX kullanılabilecek pangenotipik rejimler olarak karşımıza çıkmaktadır (Tablo11) (24,43).
Tedavi Naif, Dekompanse Sirozlu Hastalarda Tedavi
Dekompanse sirozu olan hastalar için tedavi seçenekleri sınırlıdır ve antiviral tedavi yalnızca tercihen bir nakil merkezinde yapılmalıdır. Dekompanse sirozlu veya “model for end-stage lider disease” (MELD) skoru 10’dan büyük olan hastalar, HCV tedavisine başlamadan önce karaciğer nakli için değerlendirilmelidir. Bu tür hastalarda kılavuzlar PEG-IFN kullanımını tavsiye etmemektedir (24,43). GLE/PIB, GRZ/EBV, SOF/VEL/VOX ve SMV CTP-B ve C sirozu olan hastalarda karaciğer yetmezliğine bağlı ilaç seviyelerinde artış nedeniyle kontrendikedir (24,43). Bu hastalarda sadece PI içermeyen SOF bazlı rejimler güvenle kullanılabilir (111).
Sofosbuvir/Ledipasvir
SOLAR-1 çalışmasının bir kohortunda, dekompanse karaciğer hastalığı ve karaciğer nakli sonrası HCV genotip 1 veya 4 infeksiyonu olan yetişkinler, 12 veya 24 haftalık bir SOF/LDV+RBV tedavisi almak üzere randomize edilmiş ve 12 haftalık rejimi alan hastalarda KVY oranı %86-87, 24 haftalık tedavi alanlarda ise %87-89 olarak bulunmuştur. Çalışmanın diğer bir kohortunda ise karaciğer nakli sonrası dekompanse karaciğer hastalığı olanlarda, 12 haftalık rejimle %60-85 ve 24 haftalık rejimle %75-88 olmak üzere daha düşük KVY oranları elde edilmiştir (112).
Sofosbuvir/Velpatasvir
Dekompanse sirozlu, HCV genotip 1-6 infeksiyonu olan erişkinlerde yapılan ASTRAL-4 çalışmasında olgular; 12 hafta SOF/VEL, 12 hafta SOF/VEL+ RBV ve 24 hafta SOF/VEL olarak 3 grup halinde randomize edilmiş ve genel KVY oranı sırasıyla %83, %94 ve %86 olarak bulunmuştur. Özellikle HCV genotip 3 tedavisinde, RBV içermeyen tedavi gruplarında %50 gibi daha düşük KVY oranı elde edilmiştir (77).
Öneriler
HCV Genotip 1a İnfeksiyonu
- Naif, sirotik olmayan hastalarda; SOF/LDV HCV RNA <6 milyon İÜ/ml ise sekiz hafta, HCV RNA >6 milyon İÜ/ml ise 12 hafta, SOF/VEL 12 hafta, SOF/VEL/VOX sekiz hafta, GLE/PIB sekiz hafta, GRZ/EBV 12 hafta (EBV için NS5A RAS yoksa), GRZ/EBV+ RBV 16 hafta (EBV için NS5A RAS varlığında), SMV+SOF 12 hafta veya DCV+SOF 12 hafta süreyle kullanılmalıdır.
- Naif, sirotik hastalarda; SOF/LDV 12 hafta, SOF/VEL 12 hafta (duruma göre RBV eklenebilir), SOF/VEL/VOX 12 hafta, GLE/PIB sekiz hafta, GRZ/EBV 12 hafta (EBV NS5A RAS yok), GRZ/EBV+RBV 16 hafta (EBV NS5A RAS var) veya SMV+SOF±RBV 24 hafta (Q80K mutasyonu yoksa) süreyle kullanılmalıdır.
HCV Genotip 1b İnfeksiyonu
- Naif, sirotik olmayan hastalarda; SOF/LDV HCV RNA <6 milyon İÜ/ml ise sekiz hafta, HCV RNA >6 milyon İÜ/ml ise 12 hafta, SOF/VEL 12 hafta (duruma göre RBV eklenebilir), SOF/VEL/VOX sekiz hafta, GLE/PIB sekiz hafta, GRZ/EBV 12 hafta (EBV NS5A RAS yok), GRZ/EBV+RBV 16 hafta (EBV NS5A RAS var), SMV+SOF 12 hafta veya DCV+SOF 12 hafta süreyle kullanılmalıdır.
- Naif, sirotik hastalarda; SOF/LDV12 hafta, SOF/VEL 12 hafta (duruma göre RBV eklenebilir), SOF/VEL/VOX 12 hafta, GLE/PIB sekiz hafta, GRZ/EBV 12 hafta (EBV NS5A RAS yok), GRZ/EBV+RBV 16 hafta (EBV NS5A RAS var) veya SMV+SOF±RBV 24 hafta (Q80K mutasyonu yoksa) süreyle kullanılmalıdır.
HCV Genotip 2 İnfeksiyonu
- Tedavi naif hastalar için 12 hafta süreyle SOF/VEL, sekiz hafta süreyle SOF/VEL/VOX veya GLE/PIB önerilmektedir.
- Tedavi rejimi seçimi öncelikle ilaç etkileşimi potansiyeline ve dozla ilgili olarak hasta tercihine bağlıdır.
HCV Genotip 3 İnfeksiyonu
- Tedavi naif hastalar için SOF/VEL, GLE/PIB veya SOF/VEL/VOX önerilmektedir.
- Tedavi rejimi seçimi siroz varlığına ve bir Y93H varyantının varlığına bağlıdır.
- GLE/PIB daha önce tedavi görmemiş hastalara sekiz hafta süreyle verilmelidir.
- SOF/VEL/VOX sekiz hafta süreyle verilmelidir.
HCV Genotip 4 İnfeksiyonu
- SOF/LDV 12 hafta, SOF/VEL 12 hafta, SOF/VEL/VOX 12 hafta, GLE/PIB sekiz hafta (siroz olmayan hastalar ve daha önce tedavi görmemiş kompanse sirozu olan hastalar için) veya 12 hafta (tedavi görmüş kompanse sirozu olan hastalar), GRZ/EBV 12 hafta (daha önce tedavi görmemiş olanlar için) veya SOF+ kilo bazlı RBV 24 hafta süreyle kullanılabilir.
- Tedavi seçimi; öncelikle ilaç etkileşimi potansiyeline, mevcudiyetine ve maliyetine bağlıdır.
- Bunlar sorun değilse SOF/LDV, SOF/VEL, SOF/VEL/VOX veya GLE/PIB önerilmektedir.
HCV Genotip 5-6 İnfeksiyonu
SOF/LDV 12 hafta, SOF/VEL12 hafta, SOF/VEL/VOX 12 hafta veya GLE/PIB sekiz hafta (siroz olmayan hastalar ve daha önce tedavi görmemiş kompanse sirozu olan hastalar için) önerilmektedir.
TEDAVİ DENEYİMLİ HASTALARDA KRONİK HEPATİT C TEDAVİSİ

Tablo 12. Tüm Genotipler İçin veya Genotip Değerlendirilmesi Yapılmadığında Tedavi Deneyimli* Sirozu Olmayan ve Kompanse Sirotik Hastalarda Tedavi Önerileri (Kaynak 24’ten uyarlanmıştır.)
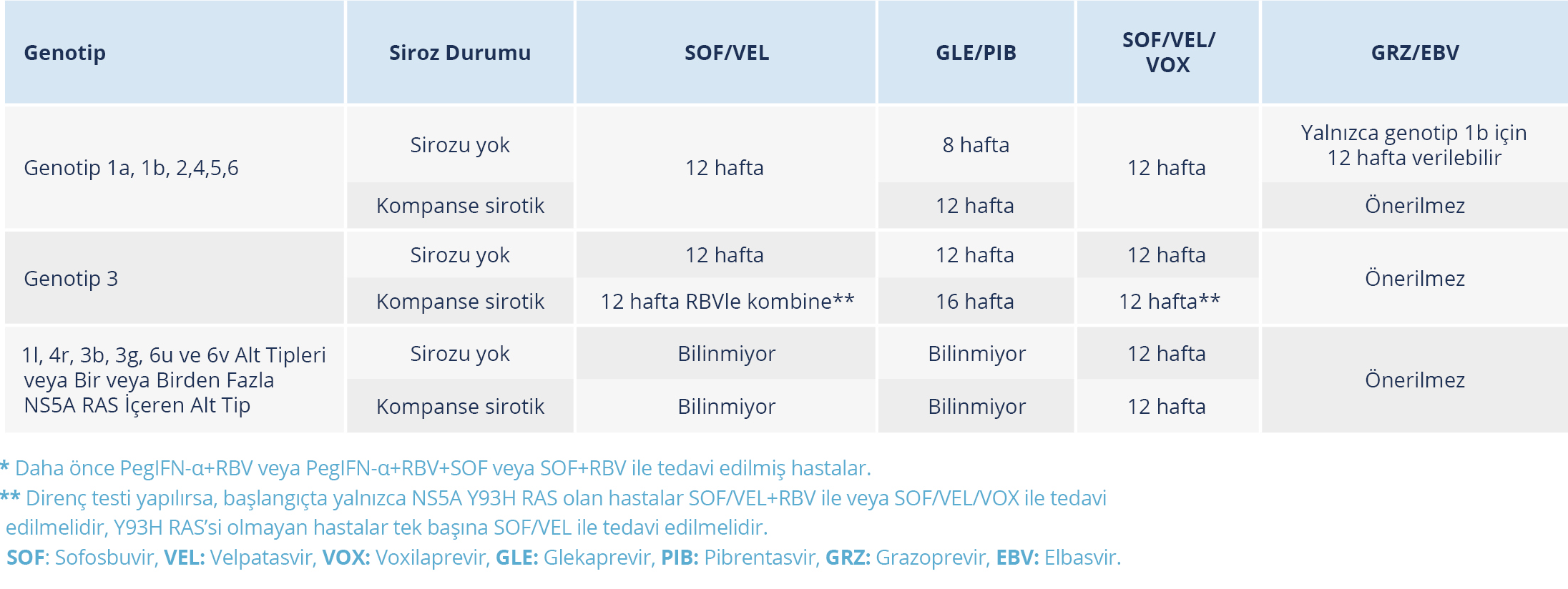
Tablo 13. Genotiplere Göre Tedavi Deneyimli* Sirozu Olmayan ve Kompanse Sirotik Hastalarda
Tedavi Önerileri (Kaynak 24’ten uyarlanmıştır.)
Virolojik etkinlikleri, kullanım kolaylıkları, güvenlikleri ve tolere edilebilirlikleri nedeniyle, pangenotipik DEA bazlı rejimler (SOF/VEL, GLE/PIB veya SOF/VEL/VOX), tedavi deneyimli (daha önce PEG-IFN-alfa +RBV; PEG-IFN-alfa+RBV+SOF veya SOF+RBV ile tedavi edilmiş hastalar), sirozu olmayan HCV ile infekte hastalarda ve kompanse sirozlu hastalarda önerilen seçeneklerdir (24,43,113). Tedavi deneyimli hastalarda DEA ile tedavi rejimleri tedavi naif hastalar ile aynıdır; ancak tedavi deneyimli, sirozu olmayan genotip 3 ile infekte hastalarda GLE/PIB kombinasyonu ile tedavi süresinin 12 haftaya, kompanse sirozu olan genotip 3 ile infekte hastalarda ise tedavi süresi 16 haftaya uzatılması gerekir. Benzer şekilde, kompanse sirozu olan genotip 3 dışı genotiplere sahip, tedavi deneyimli hastalarda GLE/PIB kombinasyonu ile tedavi süresi 12 haftaya uzatılmalıdır (Tablo 12, 13) (24,43,113).
Öneriler
- Tedavi deneyimli hastalarda genotip tayini yapılmadığında sirozu olmayan veya kompanse sirozu olan hastalarda SOF/VEL, SOF/VEL/VOX, GLE/PIB verilebilir. Tedavi süresi sirozu olmayan hastalarda GLE/PIB ile sekiz hafta, diğer durumlarda 12 haftadır.
- Genotip 1a, 1b, 2, 4, 5, 6 sirozu olmayan tedavi deneyimli hastalarda SOF/VEL ve SOF/VEL/VOX 12 hafta, GLE/PIB sekiz hafta süreyle verilebilir. Kompanse sirozu olan hastalarda her üç ilaç için tedavi süresi 12 haftadır.
- Genotip 3 ile infekte, sirozu olmayan, tedavi deneyimli hastalarda SOF/VEL, SOF/VEL/VOX ve GLE/PIB ile tedavi süresi 12 haftadır. Kompanse sirozu olan hastalarda SOF/VEL 12 hafta süreyle RBV ile kombine olarak, GLE/PIB 16 hafta süreyle veya SOF/VEL/VOX 12 hafta süreyle verilir.
- 1l, 4r, 3b, 3g, 6u ve 6v alt tipleri veya bir veya birden fazla NS5A RAS içeren alt tip içeren sirozu olamayan veya kompanse sirozu olan hastalarda SOF/VEL/VOX 12 hafta süreyle verilir.
DİREKT ETKİLİ ANTİVİRALLER İLE TEDAVİ BAŞARISIZLIĞI DURUMUNDA YENİDEN TEDAVİ
Mevcut pangenotipik DEA rejimleri ile tedavi başarısızlığı nadirdir. Başarısız olunan hastaların yeniden tedavisi, RAS testine dayalı olarak optimize edilebilir. Direnç testi mevcut değilse, önceki tedavi bilgisi veya direnç testi yapılıyorsa, gözlemlenen direnç profiline, tedavi ekibinin deneyimine ve yanıt olasılıklarına göre yeniden tedavi yönlendirilmelidir (24,95,114,115). Faz çalışmaları, SOF/VEL/VOX üçlü kombinasyonunun, proteaz ve/veya NS5A inhibitörlerine maruz kalan hastalar da dahil olmak üzere, DEA bazlı bir rejimle KVY’ye ulaşamayan hastalarda 12 hafta süreyle güvenliğini ve etkinliğini göstermiştir (81). Yapılan bir çalışmada NS5A inhibitörü içeren bir tedavi ile başarısız olan, sirozu olmayan ve kompanse sirozu olan hastalarda KVY oranları sırasıyla %99 ve %93 olarak bildirilmiştir. NS5A inhibitörü içermeyen bir tedavi ile KVY elde edilemeyen hastalarda (sirozu olmayan ve kompanse sirotik), SOF/VEL/VOX kombinasyonu ile KVY oranı %98’dir. HCV genotipi ve yeniden tedavi başlangıcındaki RAS profilinin yanıt üzerinde bir etkisi olmadığı gösterilmiştir (81). Doğrudan etkili antiviral içeren rejim başarısızlıklarının tekrar tedavisinde SOF/VEL/VOX üçlü kombinasyonunun etkinliğini değerlendiren gerçek yaşam çalışmalarında; hastanın cinsiyetinden, vücut kitle indeksinden, HCV genotipinden ve başlangıçtan bağımsız olarak bu rejimle elde edilen yüksek KVY oranları doğrulanmıştır (116-118). Bu durumun tek istisnası genotip 3 kompanse sirotik hastalardır; SOF/VEL tedavi yanıtsızlığı sonrası yeniden tedavide SOF/VEL/VOX kombinasyonunun RBV ile kombine edilmesi önerilmektedir (43).
Daha önce bir NS5A inhibitörüne maruz kalmış hastalarda, SOF ile bir NS3 proteaz inhibitörü ve bir NS5A inhibitörünün üçlü bir kombinasyonunun, DEA’ya maruz kalan hastaların yeniden tedavisi için daha uygun olduğu bildirilmiştir. Bu hastalarda SOF ile GLE/PIB üçlü kombinasyonu önerilmekte olup PIB in vitro olarak diğer tüm onaylı NS5A inhibitörlerinden daha yüksek bir direnç bariyerine sahiptir (119-122). Ancak yapılan bir faz 3 çalışmasında daha önce SOF/NS5A inhibitörü kombinasyonu tedavisi alan hastalarda tedavi yanıtsızlığı durumunda GLE/PIB kombinasyonunun 16 hafta süreyle verilmesinin de etkili olduğunu gzölenmiş ve Amerikan Karaciğer Hastalıkları Araştırma Derneği (AASLD) önerilerinde de yer almıştır (43,123). Daha önce NS5A inhibitörlerine maruz kalmış, özellikle tedavisi zor olan hastalarda; SOF/VEL/VOX ve SOF/GLE/PIB’e RBV ekleyerek ve/veya tedavi süresi 16 ila 24 haftaya uzatılarak yeniden tedavi önerilir (24).
Sofosbuvir İçeren Tedaviye Yanıtsızlık Sonrası Yeniden Tedavi
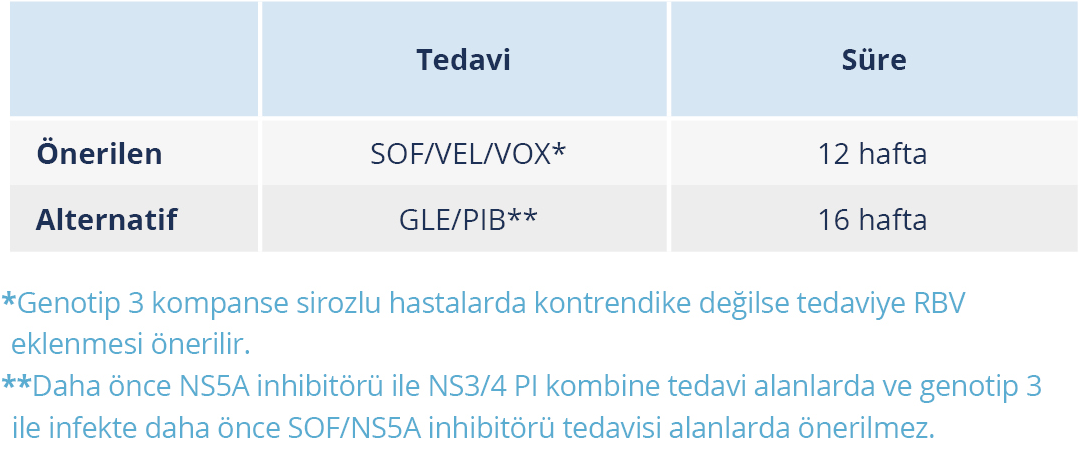
Tablo 14. SOF Bazlı Tedaviler ile Yanıt Alınamayan Sirozu olmayan ve Kompanse Sirotik Hastalarda Yeniden Tedavi Önerileri (Kaynak 43’ten uyarlanmıştır.)
SOF bazlı tedavi sonrası yanıt alınamayan hastalarda 12 hafta süreyle SOF/VEL/VOX kombinasyonu verilebilir. Durumun tek istisnası genotip 3 ile infekte ve sirotik olan hastalar olup tedaviye RBV eklenmesi önerilir. GLE/PIB kombinasyonu da 16 hafta süreyle SOF bazlı tedavilerde yanıt alınamayan hastalar için bir alternatiftir (daha önce NS5A inhibitörü ile NS3/4 PI kombine tedavi alanlarda ve genotip 3 ile infekte daha önce SOF/NS5A inhibitörü tedavisi alanlarda önerilmez). GRZ/EBV tedavisi sonrası yanıt alınamayan hastalarda da 12 haftalık SOF/VEL/VOX kombinasyonu verilebilir; GLE/PIB bu hastalar için alternatif tedavide yer almaz (43). SOF bazlı tedaviler ile yanıt alınamayan hastalarda (sirozu olmayan ve kompanse sirotik) yeniden tedavi önerileri Tablo 14’te verilmiştir.
Glekaprevir/Pibrentasvir Tedavi Yanıtsızlığı Sonrası Yeniden Tedavi
GLE/PIB tedavisi sonrası yanıt alınamayan hastalarda SOF+GLE/PIB+RBV 12-16 hafta süreyle önerilmektedir. GLE/PIB öncesi PI/NS5A inhibitörü deneyimi olmayan genotip 1, 2, 4, 5, 6 hastalarda tedavi süresi 12 hafta olmalıdır. Genotip 3 ile infekte hastalar ve/veya kompanse sirozu olanlar ve/veya PI/NS5A inhibitörü deneyimi olan hastalarda GLE/PIB tedavisi sonrası tedavi yanıtsızlığı durumunda SOF+GLE/PIB+RBV kombinasyonunun 16 hafta verilmesi önerilmektedir (43,124). GLE/PIB tedavi yanıtsızlığı sonrası SOF/VEL/VOX 12 hafta süreyle önerilir (kompanse sirozu olan hastalarda tedaviye RBV eklenmelidir) (125). GLE/PIB tedavi yanıtsızlığı sonrası yeniden tedavi önerileri Tablo 15’te verilmiştir.
Çoklu DEA Tedavi (Sofosbuvir/Velpatasvir Voksilaprevir ve Sofosbuvir+Glekaprevir/Pibrentasvir Dahil) Yanıtsızlığı Sonrası Yeniden Tedavi
DEA tedavisine yanıtsız hastalarda yeniden tedaviye (SOF+GLE/PIB ve/veya SOF/VEL/VOX) yanıt vermeyen hastalar ile ilgili veri kısıtlıdır. Bu hastalara ait yapılmış klinik çalışma sonuçları yoktur; ancak SOF+GLE/PIB+RBV kombinasyonunu gösteren olgu sunumları vardır (124).
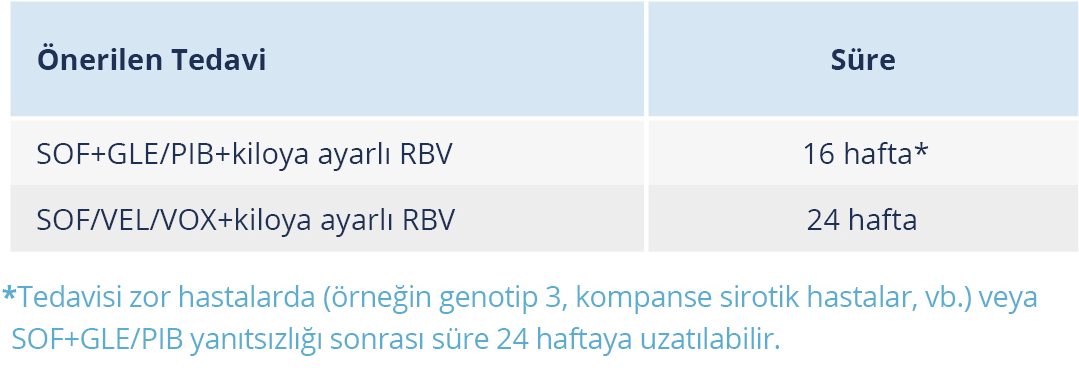
Tablo 16. SOF/VEL/VOX veya SOF/GLE/PIB ile Yeniden Tedavi Yanıtsızlığı Sonrası Tedavi (Kaynak 43’ten uyarlanmıştır.)
SOF/VEL/VOX yeniden tedavisi sonrası yanıtsızlık mevcut ise SOF+GLE/PIB+RBV tedavisinin 24 hafta ve SOF/VEL/VOX+RBV tedavisinin 24 hafta süreyle verilebileceğini gösteren olgu örnekleri mevcuttur (81,124,126-129). Çoklu DEA tedavi yanıtsızlığı sonrası yeniden tedavi önerileri Tablo 16’da verilmiştir.
Öneriler
- DEA içeren herhangi bir tedavi rejiminden sonra başarısızlık olan hastalarda, yeniden tedavi kararı öncesi HCV direnç testi yapılması ve hastanın yeni tedavi seçeneklerine yanıt olasılığının değerlendirilmesi önerilmektedir.
- SOF bazlı tedavi sonrası yanıt alınamayan hastalarda 12 hafta süreyle SOF/VEL/VOX kombinasyonu verilebilir, bu durumun tek istisnası genotip 3 ve sirozu olan hastalardır. Bu hastalarda tedaviye RBV eklenmesi önerilir. GLE/PIB kombinasyonunun 16 hafta süreyle uygulanması da diğer bir alternatiftir.
- DEA (proteaz inhibitörü ve/veya NS5A inhibitörü) içeren bir rejimden sonra başarı elde edilemeyen ve sirozu olmayan hastalarda 12 hafta boyunca SOF/VEL/VOX kombinasyonu ile yeniden tedavi önerilir. Kompanse sirozu olan hastalarda tedaviye RBV eklenebilir.
- DEA içeren bir rejimden sonra başarı elde edilemeyen ve tedavisi zor hastalarda (siroz varlığı, çok sayıda DEA bazlı tedavi, genotip 3 infeksiyonu, PI ve/veya NS5A inhibitörü deneyimi) SOF+GLE/PIB kombinasyonu+RBV (<75 kg veya >75 kg hastalarda sırasıyla 1000 veya 1200 mg) ile 16 hafta süreyle verilebilir. Siroz yokluğu, genotip 3 dışı genotiplerde ve PI ve/veya NS5A inhibitörü deneyimi olmayan hastalarda tedavi süresi 12 hafta önerilir.
- SOF/VEL/VOX veya SOF+GLE/PIB kombinasyonu ile yeniden tedavi sonrası yanıtsız olan hastalarda, SOF/VEL/VOX+RBV veya SOF+GLE/PIB+RBV 16-24 hafta verilebilir.
DOĞRUDAN ETKİLİ ANTİVİRALLERİN DİRENÇ SORUNU VE ANTİVİRAL DİRENCİNİN KLİNİK YÖNETİMİ
HCV replikasyon siklusunun tamamını sitoplazmada geçirmektedir ve konak genomuna entegre olmamaktadır. Replikasyona farklı basamaklarda etki eden DEA ilaçlar hem tedavi süresini kısaltmakta hem de hastalarda tam bir kür şansı doğurmaktadır. HCV infeksiyonu bu farklardan dolayı özellikle HBV infeksiyonundan ayrılır; ancak buradaki en önemli kaygı nedeni ilaçlara karşı direnç gelişmesi olasılığıdır (130).
DEA ilaç kombinasyonu tedavileri sırasında vahşi suşlar kaybolmakta ve HCV genomunun farklı bölgelerinde yer alan aminoasitlerde mutasyonlar oluşabilmektedir. Bu mutasyonların bulunduğu aminoasit bölgesine RAS adı verilir (131). Günümüzde klinik kullanım için onaylanan tüm DEA ilaçlar için in vitro RAS bölgeleri tanımlanmıştır. NS3 ve NS5A RAS’ları, hata eğilimli HCV RNA polimeraz nedeniyle kendiliğinden ortaya çıkabilir hatta tedavi öncesinde bile mevcut olabilir. NS5B RAS’ları da mevcut olmakla birlikte çok nadir görülür (66,131).
Ülkemizde HCV’de DEA ilaç direnci hakkında veriler çok kısıtlıdır. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu (VHÇG)’nun 2013 yılında yaptığı bir çalışmada Türkiye’de doğal DEA direnci mutasyonlarının oranı %6-15 arasında bildirilmiştir (132). Türkiye popülasyonunda HCV RAS sıklığı düşüklüğü, RAS testini yapabilecek merkez sayısının azlığı ve testin geri ödeme kapsamında olmaması da dikkate alınarak tedavi naif hastalarda DEA ilaçlarla tedaviden önce rutin direnç testi önerilmemektedir.
NS3, NS5B ve NS5A RAS’ları için direnç testi, kombinasyon DEA tedavisi başarısız olduktan sonra düşünülmelidir. Direnç testi, HCV genomunun doğrudan dizilenmesini içerir ve HCV sekanslaması sayesinde, nüks ile yeniden infeksiyonun da ayırt edilmesine olanak sağlar.
HCV Direnç Testi
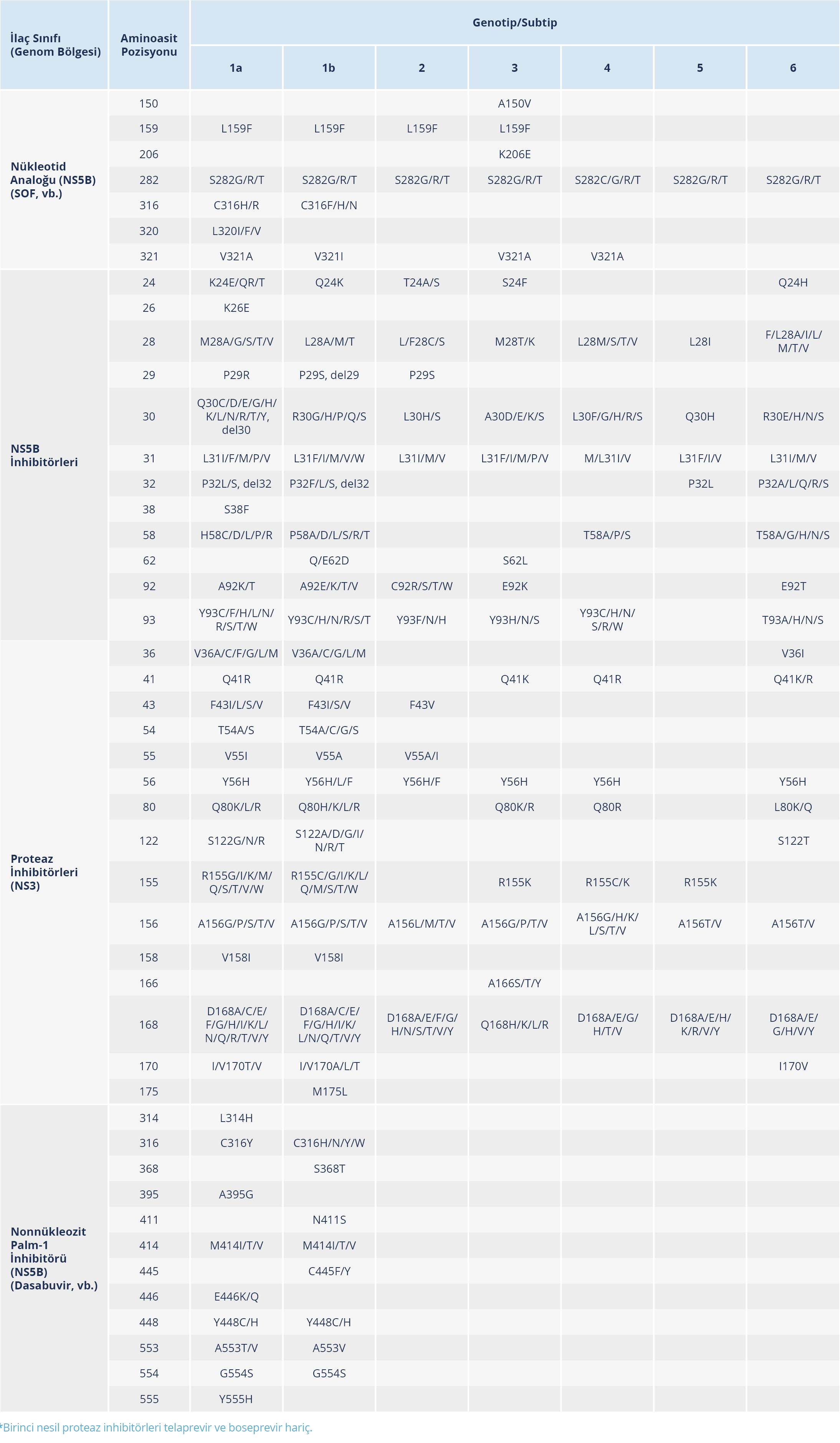
Tablo 17. Doğrudan Etkili Antiviraller ile Kalıcı Virolojik Yanıt Elde Edilemeyen Hastalardaki (IFN kullanmamış)
RAS Bölgeleri ile İn Vitro Çalışmalarda İlaç Sınıflarına Göre Azalmış Duyarlılık Kazandıran RAS Bölgeleri*
(Birinci nesil proteaz inhibitörleri telaprevir ve boseprevir hariç). (Kaynak 24’ten uyarlanmıştır.)
DEA ilaçlara karşı HCV direncini tespit etmek için piyasada bulunan, standardize edilmiş ve onaylı olan tek bir test kiti mevcuttur; yarı otomatik ve derin dizilemeye dayalıdır. Söz konusu test kiti; HCV genotipleri 1a, 1b ve 3a’nın NS3 (proteaz), NS5A ve NS5B (polimeraz) bölgelerinin direnç testi için CE-IVD onaylıdır (133). Alternatif direnç testi, popülasyon dizilimine (Sanger dizilimi) veya derin dizilime dayalı tekniklere dayanır (134). Sınırlı sayıda laboratuvar bu testleri yapabilmektedir ve özellikle genotip 1 ve 4 dışındaki genotipler için teknik olarak çalışılması daha zordur.
Direnç testlerine erişimin zorluğunun yanı sıra bu testlerin teknikleri, yorumlanması ve raporlanması konusunda tam bir fikir birliği de yoktur. Bu nedenle, daha önce DEA tedavisi almamış hastalarda tedaviden önce HCV direnç testleri önerilmemektedir (24). In vitro çalışmalarda ve doğrudan etkili antiviraller ile tedavi edilen ve KVY elde edilemeyen hastalarda en sık azalmış duyarlılık kazandıran RAS bölgeleri Tablo 17’de detaylı bir şekilde sunulmuştur.
Sofosbuvir/Velpatasvir
Batı ülkelerinde daha az yaygın olduğunu belirten NS5A inhibitörlerine doğal olarak dirençli olan “alışılmadık” HCV alt tiplerine sahip hastalarda SOF/VEL sabit doz kombinasyonunun etkinliğine ilişkin sınırlı veri mevcuttur. Yapılan bir faz 3 çalışmasında, elde edilen havuzlanmış direnç analizinde, 1778 hastanın 20 (%1.1)’sinde virolojik başarısızlık gözlenmiştir. Bu hastalarda; genotip 1 %1 (7/694), genotip 2 %0 (0/316), genotip 3 %2.5 (12/478), genotip 4 %0.5 (1/197) ve genotip 5 ila 7 %0 (0/93) oranlarında tespit edilmiştir (135).
Asya kıtasından beş ülkenin katıldığı, HCV genotipleri 1 ila 6 olan hastalarda gerçekleştirilen tek kollu, açık etiketli faz 3 çalışmasında, %96’lık (362/375) genel 12. hafta kalıcı viral yanıt (KVY12) oranı elde edilmiştir. Söz konusu 375 hastanın 42 (%11)’sinin genotip 3b ile infekte olduğu bildirilmiştir. Çok merkezli bu çalışmadaki hastaların HCV NS5A bölgesinde, genellikle A30K + L31M olmak üzere başlangıç RAS’larına sahip olduğu belirtilmiştir (136).
Viral genomun NS5A bölgesinde Y93H RAS taşıyan HCV genotip 3a ile infekte kompanse sirozlu hastalarda SOF/VEL’in RBV olmadan kombinasyonu optimal değildir. Hücre kültüründeki in vitro direnç çalışmaları ve klinik verilere göre VEL’e karşı tek başına Y93H RAS tarafından orta düzey bir direnç söz konusudur. Ayrıca Y93H’ün diğer NS5A RAS bölgesindeki özellikle L31 birlikteliğinde yüksek düzeyde direnç ile karşılaşılabilir (24,121). Bu nedenle, SOF/VEL tedavi rejimi seçilen kompanse sirozlu genotip 3a ile infekte hastalar ya 12 haftalık SOF/VEL+RBV (<75 kg 1000 mg veya >75 kg ise 1200 mg) kombinasyonu ile tedavi edilmeli veya 12 haftalık SOF/VEL/VOX üçlü sabit doz kombinasyonu tercih edilmelidir (24).
Eğer NS5A direnç testi çalışılabiliyorsa, genomlarında sadece Y93H RAS olan hastalara 12 haftalık SOF/VEL ve RBV (<75 kg 1000 mg veya >75 kg ise 1200 mg) kombinasyonu veya 12 haftalık SOF/VEL/VOX üçlü sabit doz kombinasyonu verilmelidir (24).
Glekaprevir/Pibrentasvir
NS5A inhibitörlerine doğal olarak dirençli “alışılmadık” HCV alt tiplerine sahip hastalarda GLE/PIB sabit doz kombinasyonunun etkinliğine ilişkin çok az veri mevcuttur. PIB, bu virusların genomunda doğal olarak bulunan birkaç NS5A RAS’a karşı diğer NS5A inhibitörlerinden daha yüksek bir direnç bariyerine sahiptir (24).
GLE/PIB ile yapılan faz 2 ve 3 çalışmalarından elde edilen birleştirilmiş direnç analizinde, 2256 hastanın 22 (%1)’sinde virolojik başarısızlık gözlenmiştir. Bu çalışmada genotip 1 infeksiyonu %0.2 (2/889), genotip 2 infeksiyonu %0.4 (2/46), genotip 3 infeksiyonu %2.8 (18/643) ve genotip 4 ila 6 infeksiyonu %0 (0/258) bulunmuştur (122). Genotip 3 ile infekte hastalarda bu yüksek GLE/PIB yanıtsızlığı, 17 çalışma ve 3302 hastayı içeren bir meta-analizde de doğrulanmıştır (137). Bu meta-analizde virolojik başarısızlığı olan 50 hastanın %48’i genotip 3 ile infekte bulunmuştur. Ayrıca bu hastaların %44’ünün genotip 1 ile infekte oldukları belirtilmektedir. Başlangıç RAS’ları hastaların %88’inde (44/50) tespit edilmiş olup NS5A bölgesinde RAS Y93H ve A30K varlığının genotip 3 ile infekte hastalarda KVY12 oranlarını önemli ölçüde etkilediği gösterilmiştir. Bunun tersine genotip 1 ile infekte olan hastalarda başlangıçta NS5A RAS varlığının KVY12’ye hiçbir etkisi olmadığı belirtilmiştir (137).
GLE/PIB, SOF+RBV tedavisinin başarısız olduğu genotip 2 veya 3 HCV infeksiyonu olan kişilerde kurtarma tedavisi olarak değerlendirilmemiştir. Bu konu tedaviyle KVY alınamayan hastaların takip ve tedavisi bölümünde detaylı bir şekilde ele alınmıştır.
Sofosbuvir/Velpatasvir/Voksilaprevir ve Genotip 3 İnfeksiyonu
Klinik çalışma veya gerçek dünya verilerinin yokluğunda; 1l, 4r, 3b, 3g, 6u ve 6v alt tipleri ile infekte olan hastalar ile NS5A inhibitörlerine direnç sağladığı bilinen ve ≥1 RAS barındıran diğer seyrek alt tiplerle infekte olan hastaların birinci basamakta SOF/VEL/VOX sabit doz kombinasyonu ile tedavi edilmesi önerilmektedir (24).
HCV genotip 3 ile infekte hasta içeren, iki farklı faz 3 çalışmasında (POLARIS-2 ve POLARIS-3) olgular SOF/VEL/VOX ile tedavi edilmiştir (95,137). Çalışmaya dahil edilen hastaların %20’sinin siroz ve yaklaşık dörtte üçünün tedavi naif olduğu POLARIS-2 çalışmasında sekiz haftalık tedavi sonrası KVY12 oranı %99 bulunmuştur (91/92; virolojik başarısızlık yok). Tedavi naif ve deneyimli hastaların yer aldığı POLARIS-3 çalışmasında ise sekiz haftalık tedavi sonrası %96 KVY12 oranı (106/110; 2 nüks) elde edilmiştir. Söz konusu faz 3 çalışmalarının 12 haftalık tedavi grupları olmadığı için bu kapsamda yorum yapılamamakla birlikte yüksek KVY elde edilebileceği öngörülmektedir.
SOF/VEL/VOX tedavisine yanıt vermeyen kişilerden; tedavi uyumunun yanı sıra diğer sosyal faktörler, yan etkiler veya yanlışlıkla yetersiz dozlamaya yol açmış olabilecek olası ilaç-ilaç etkileşimleri açısından dikkatli bir öykü alınmalıdır. Ayrıca yeniden infeksiyon açısından risk faktörleri araştırılmalıdır (95,137).
Grazoprevir/Elbasvir ve Genotip 1b İnfeksiyonu
C-EDGE-TN faz 3 çalışmasında, tedavi naif, genotip 1b ile infekte KHC hastaları 12 hafta boyunca GRZ/EBV ile tedavi edilmiş olup KVY12 oranı %98 (129/131 ve 1 nüks) olarak tespit edilmiştir (88).
Rusya ve Asya-Pasifik bölgesinde gerçekleştirilen C-CORAL çalışmasında, GRZ/EBV rejimiyle KVY12 oranı %98 (382/389 ve 5 nüks) olarak bulunmuştur (138). Hastaların yaklaşık üçte birinin kompanse siroz olduğu ve tedavi deneyimli hastaların dahil edildiği C-EDGE-TE faz 3 çalışmasında genotip 1b hastalarında KVY12 oranı, 12 haftalık GRZ/EBV sonrasında %100 (34/34) olarak bulunmuştur (139).
Tüm faz 2 ve 3 çalışmalarının birleştirilmiş bir analizinde; GRZ/EBV rejimiyle 12 hafta tedavi edilen genotip 1b ile infekte hastalarda %97’lik bir KVY12 oranı (1040/1070, 15 nüks ve 15 virolojik olmayan başarısızlık) gösterilmiştir (140).
Öneriler
- Birinci basamak tedaviden önce HCV direnci testi yapılması önerilmez.
- Tedavi öncesi direnç testine dayalı optimizasyon gerektiren rejimlerin mevcut olduğu alanlarda ve NS5A inhibitörlerine (24 ila 93 amino asitleri kapsayan) karşı HCV direncini değerlendiren güvenilir bir teste kolayca erişebilir ise direnç testinin yapılması önerilir.
- Kompanse (CTP-A) sirozlu, genotip 3 ile infekte, tedavi naif veya tedavi deneyimli hastalara başlangıçta direnç testi yapılırsa ve sadece NS5A Y93H RAS tespit edilirse bu hastaların SOF/VEL+RBV veya SOF/VEL/VOX ile 12 hafta tedavi edilmesi önerilir. Y93H RAS’ı olmayan hastaların 12 hafta boyunca tek başına SOF/VEL ile tedavi edilmesi önerilir.
- Tedavi naif veya deneyimli genotip 3 ile infekte ve kompanse (CTP-A) sirozlu hastaların SOF/VEL+ kiloya göre RBV kombinasyonu ile 12 hafta veya SOF/VEL/VOX sabit doz kombinasyonu 12 hafta veya GLE/PIB sabit doz kombinasyonu ile 12 hafta boyunca tedavi edilmesi önerilir.
- Popülasyon veya derin dizileme yoluyla NS5A bölgesinin dizi analizinin yapıldığı merkezlerde 1l, 4r, 3b, 3g, 6u ve 6v alt tipleri ile infekte olan hastaların ≥ 1 RAS ile diğer seyrek alt tiplerle infekte hastaların SOF/VEL/VOX sabit doz kombinasyonu ile 12 haftalık tedavi edilmesi önerilir.
- DEA (PI ve/veya NS5A inhibitörü) rejimden sonra tedavi başarısız, sirozu olmayan veya kompanse (CTP-A) sirozlu ve daha düşük tedavi yanıtlı (ilerlemiş karaciğer hastalığı, çok sayıda DEA bazlı tedavi alan, karmaşık NS5A RAS profilli) hastaların 12 hafta süreyle SOF+sabit doz GLE/PIB kombinasyonu ile tedavi edilmesi önerilir.
- Tedavisi çok zor olan hastalarda (bir PI ve/veya bir NS5A inhibitörü içeren bir kombinasyon rejiminden sonra KVY elde etmekte birden fazla kez başarısız olunan NS5A RAS’lı hastalar) SOF/VEL/VOX üçlü kombinasyonu veya SOF+GLE/PIB+kiloya göre RBV (<75 kg 1000 mg veya ≥75 kg ise 1200 mg) kombinasyonu ile 12 haftalık tedavi önerilir. Bu tedavi süresi 16 ila 24 haftaya kadar uzatılabilir.
HASTALARDA TEDAVİ SÜRECİ İZLEMİ
Doğrudan etkili antiviral rejimlerle tedavi sürecinde klinik değerlendirme öncelikle tedavi uyumuna ve yan etkilerin tanımlanmasına odaklanmalıdır; tedavi etkinliği, güvenlik ve ilaç-ilaç etkileşimlerinin izlenmesi de önemlidir (141).
Uyum İzlemi
Her kontrolde hastanın tedavi uyumu hakkında bir görüşme yapılması gereklidir. Bu görüşmeler yargılayıcı olmamalıdır. Hastaların ilaç alma zamanlamalarını diş fırçalama gibi diğer günlük aktiviteleri ile ilişkilendirmelerine yardımcı olarak uygun program yapmalarına olanak tanımak faydalı olabilir (141).
Tedavi Etkinliği İzlemi / Viral izlem
Doğrudan etkili antiviral rejimlerle tedavi sırasında viral seviyelerin izlenmesinin minimum prognostik değeri vardır. Çünkü IFN içermeyen tedavilerle ilgili büyük klinik deneylerde sirozu olmayan hastaların neredeyse tamamında dört haftalık tedaviyle HCV RNA negatifleşir (142,143). Bu nedenle tedavi sırasında viral seviyeleri kontrol etmenin temel amacı; tedavi uyumunu değerlendirmek, relapsı saptamak ve yeniden tedavi endikasyonunu belgelemektir. İlaçların maliyeti ve uygun olmayan kullanıma bağlı potansiyel viral direnç riski göz önüne alındığında, klinik uygulamada 4. haftada HCV RNA kantitatif testi ile viral düzey değerlendirilmelidir. Kılavuzlar; 4. haftada HCV RNA pozitifse 6. haftada testin tekrarlanması gerektiğini ve HCV RNA düzeyinin >1 log artması durumunda tedavinin kesilmesi gerektiğini bildirmektedir. Kalıcı viral yanıt için tedavinin kesilmesini takip eden 12. ve 24. haftalarda HCV RNA testi yapılmalıdır (24,43).
Tedavi Güvenliği İzlemi
Yeni DEA rejimlerinde ilacın kesilmesine yol açabilecek ciddi istenmeyen etki sıklığı düşüktür. Tedavi sürecinde istenmeyen etkiler nedeniyle tedaviyi kalıcı olarak bırakan hastaların oranı; 12 hafta boyunca SOF/VEL alan hastalarda %1’in altında, GLE/PIB alan hastalarda ise %0.5’in altında bulunmuştur (95,144). GRZ/EBV alan hastaların sadece %2’sinde ciddi yan etkiler gözlenmiş ve %0.1 oranındaki hastada tedavinin kesilmesi gerekmiştir (85). SOF/VEL alan hastalarda en sık yorgunluk, baş ağrısı, tedaviye VOX eklenenlerde hafif diyare, GLE/PIB alan hastalarda yorgunluk ve baş ağrısı, GRZ/EBV alanlarda ise yorgunluk, baş ağrısı ve mide bulantısı görülmüştür (85,95,144). Ciddi istenmeyen etki veya tedavi sırasında hepatit tablosunun alevlenmesi durumunda tedavi durdurulmalıdır.
RBV alan dekompanse sirozu (CTP- B veya C) olan hastalarda belirgin anemi oluşursa (hemoglobin <10 g/dl), RBV dozu kademeli olarak 200 mg azaltılarak ayarlanmalıdır. Hemoglobini hızla düşen hastalarda ve özellikle başlangıç hemoglobini düşükse, dozun daha hızlı azaltılması gerekebilir. Hemoglobin düzeyi 8.5 g/dl’nin altına düşerse RBV tedavisi durdurulmalıdır. Hemoglobin düzeyinde sonradan bir artış olursa günde 200 mg dozlarla kademeli doz artırılması denenebilir (145,146).
Doğrudan etkili antiviral kombinasyonları ile ilaç toksisitesi yaygın olmamakla birlikte, özellikle belirli kombinasyonları alanlarda, HBV koinfeksiyonu olanlarda, dekompanse sirozlu hastalar veya karaciğer nakli alıcılarında (veriler az olduğu için) aralıklı olarak laboratuvar değerlerinin izlenmesi önerilmektedir. Tedavinin 4. haftasında temel laboratuvar testlerinin (tam kan sayımı, tahmini glomerüler filtrasyon hızı hesaplamasıyla birlikte kreatinin değeri, karaciğer enzimleri ve bilirubin seviyeleri) yapılması önerilmektedir (24,43). Laboratuvar testleri için ek endikasyonlar rejime özeldir. GRZ/EBV alan hastalarda 8. haftada (tedavi süresi 16 hafta ise 12. haftada) karaciğer enzimleri ve bilirubin düzeylerinin kontrol edilmesi önerilmektedir. ALT düzeylerinde başlangıç seviyesinin 10 katını geçen artış olması durumunda veya bu tabloya semptomlar veya hiperbilirubinemi eşlik ediyorsa tedavi kesilmelidir (85).
RBV içeren bir rejim alan, doğurganlık çağındaki kadınlar için tedavi sırasında ve tedaviden sonraki altı ay boyunca doğum kontrol yöntemi önerilmeli ve gerekliyse gebelik testi yapılmalıdır. RBV içeren bir rejim alan ve doğurganlık çağındaki bir kadınla seks yapan erkeklere tedavi sırasında ve tedaviden sonraki altı ay boyunca kontrasepsiyon yöntemleri konusunda danışmanlık yapılmalıdır (147).
Doğrudan etkili antiviral tedavi verilen ve HBV infeksiyonu kanıtı olan, HBV için antiviral tedavi almayan hastaların HBV reaktivasyonu riskinden dolayı dikkatle takip edilmeleri gerekir. HBsAg pozitif olanlarda HCV tedavisinden önce bir temel HBV DNA düzeyi bakılmalı ve HBV antiviral tedavisi için kriterleri karşılayanlarda HCV tedavisinden önce veya HCV tedavisiyle aynı zamanda HBV tedavisine başlanmalıdır. HBV tedavisi kriterlerini karşılamayanların düzenli aralıklarla (genellikle dört haftada bir) HBV DNA düzeyleri izlenmelidir. HBsAg negatif olup anti-HBc pozitif olan kişilerde optimal izlemi tanımlayacak veriler yetersizdir. HCV tedavisi sırasında dört haftalık aralıklarla karaciğer enzimlerini kontrol ederek HBV reaktivasyonunun izlenmesi önerilmektedir. Karaciğer enzimlerinde açıklanamayan artışlar olması durumunda ve HCV tedavisi sırasında ve/veya sonrasında HBsAg testi ve HBV DNA tekrarlanmalıdır. HBV reaktivasyonu, negatif olan HBV DNA’nın pozitifleşmesi veya HBV DNA seviyesinde 2 logaritmanın üzerinde artış olarak tanımlanır. Bu durum HBV infeksiyonu için antiviral tedaviyi gerektirir. HCV tedavisi ile HBV reaktivasyonu arasındaki bu ilişkinin tanımlanmasının ardından, Amerikan Gıda ve İlaç Dairesi (FDA)’ne bir yıl içinde 524 karaciğer yetmezliği olgusu rapor edilmiştir. Benzer bir zaman diliminde 250 000 kişi tedavi edilmiştir. Bunların ne kadarında karaciğer yetmezliği riskinin genel popülasyondan daha yüksek olduğu, ilerlemiş karaciğer hastalığı (dekompanse hastalığı olan hastalarda proteaz inhibitörlerinin uygunsuz kullanımı dahil) olan hastalardaki HBV reaktivasyonu veya komplikasyonlarını temsil ettiği açık değildir (148,149).
İlaç-ilaç Etkileşiminin İzlemi
Tedavi sırasında komorbiditeler ve potansiyel ilaç-ilaç etkileşimleri için verilen eş zamanlı ilaçların etkinliği ve toksisitesi izlenmelidir. Reçetesiz ilaçlar, narkotik ilaçlar ve keyif verici ilaçlar da dahil olmak üzere hastanın aldığı tüm ilaçları gözden geçirmek önemlidir (24).
Öneriler
- Her klinik ziyarette uyumun önemini vurgulamak gereklidir.
- Tedavi sırasında viral seviye izleminin amacı öncelikle uyumu değerlendirmek ve tedavi sürecini belgelemektir.
- Tipik olarak tedavinin 4. haftasında kantitatif bir HCV RNA testi ile viral düzey kontrol edilebilir.
- KVY tedavinin kesilmesini takip eden 12. ve 24. haftada viral yük kontrol edilerek değerlendirilmelidir.
- Yeni DEA rejimlerinde ilacın kesilmesine yol açabilecek ciddi istenmeyen etki sıklığı düşük olmakla birlikte, hastalar yan etkiler açısından mutlaka bilgilendirilmelidir.
- Özellikle belirli DEA kombinasyonunu (GRZ/EBV gibi) kullanan hastalar, HBV ile koinfekte olanlar, dekompanse sirotik hastalar veya karaciğer nakli alıcılarında aralıklı olarak laboratuvar değerlerinin izlenmesi önerilmektedir.
- Tedavinin 4. haftasında tam kan sayımı, glomerüler filtrasyon hızı hesaplamasıyla birlikte kreatinin değeri, karaciğer enzimleri ve bilirubin seviyelerinin kontrol edilmesi önerilmektedir.
- Tedavi sırasında hastanın kullandığı tüm reçeteli ve reçetesiz ilaçlar ilaç-ilaç etkileşimleri açısından kontrol edilmelidir.
KALICI VİROLOJİK YANIT ELDE EDİLEN HASTALARDA TEDAVİ SONRASI İZLEM
Sirozu olmayan hastalarda KVY elde edildiğinde HCV infeksiyonunun kür olduğu kabul edilebilir. Aşırı alkol alımı öyküsü, obezite, tip 2 diyabet, metabolik sendrom, alkole bağlı olmayan karaciğer yağlanması gibi eşlik eden hastalıkları olan kişilerde karaciğer hasarının devam etme riski sürdüğü için periyodik olarak takip edilmeleri gerekir. Sirotik hastalarda KVY elde edildikten sonra devam eden takip çalışmaları, tedavi edilmemiş hastalara veya KVY’ye ulaşamayan hastalara oranla önemli ölçüde azalmakla beraber HSK gelişme riskinin sürdüğünü göstermiştir (24,51,150,151). Bu nedenle ilerlemiş fibrozisi olan (METAVIR skoru F3) ve KVY elde edilen sirotik hastalar ultrasononografi ile (alfa-feto protein ölçümü ile veya olmadan) her altı ayda bir HSK açısından izlenmelidir (152). Ayrıca bu hasta grubunda risk durumuna göre belirlenecek aralıklarla endoskopi ile özofagus varisleri takip edilmelidir (153). Damar içi madde kullanan ve MSM gibi yüksek risk altındaki hastalarda başarılı HCV tedavisini takiben yeniden infeksiyon oranı yıl başına %1-8’dir. Yapılan sistematik bir derlemede HCV monoinfekte kişilerde beş yıllık reinfeksiyon riski %1 iken bu oran HCV monoinfekte yüksek riskli kişilerde (damar içi madde kullanan hastalar, mahkumlar, MSM, vb.) %11, HCV-HIV koinfekte kişilerde ise %15 olarak tespit edilmiştir (49). Bu hastaların da reinfeksiyon riski açısından tedavi sonu izleminin devamı önerilir (43,154).
Öneriler
- METAVIR skoru F0-F2 olan ve KVY elde edilen hastalarda, devam eden riskli davranışları ve/veya komorbiditeleri yoksa infeksiyonun kür olduğu kabul edilmelidir.
- İleri fibrozisi (F3) veya sirozu olan hastalarda KVY elde edilmiş olsa dahi her altı ayda bir HSK için izlem gereklidir.
- Yeniden infeksiyon için yüksek riskli davranışlara sahip kişiler için KVY elde edilmesi sonrasında izlemin (yılda 1-2 kez HCV RNA bakılması) devamı önerilir.
TEDAVİ VERİLEMEYEN VE TEDAVİYLE KALICI VİROLOJİK YANIT ALINAMAYAN HASTALARIN İZLEMİ
Tedavi verilemeyen ve tedaviyle KVY alınamayan hastaların düzenli olarak izlemi gereklidir. Bu hastalarda her altı ayda bir tam kan sayımı, INR takibi ve hepatik fonksiyonların değerlendirilmesi önerilir. Tedavi edilemeyen hastaların invazif olmayan bir yöntemle fibrozis yönünden bir ila iki yılda bir değerlendirilmesi önerilmektedir (55). İleri fibrozisi (METAVIR skoru F3) veya sirozu (METAVIR skoru F4) olan hastalar her altı ayda bir HSK yönünde takip edilmelidir; bu hastalar için özofagus varis mevcudiyeti ve hastanın eşlik eden risk faktörleri (alkol almaya devam, obezite, vb.) bir hepatolog tarafından değerlendirilerek endoskopik takip sıklığı belirlenmelidir (153).
Öneriler
- Önceki birkaç tedavi küründe başarısız olunan (tedavi edilemeyen) hastalar her 6 ayda bir tam kan sayımı, INR takibi ve hepatik fonksiyonları yönünden izlenmelidir.
- Bir ila iki yılda bir fibrozisi evrelemeye yönelik invazif olmayan yöntemlerle izlem önerilir.
- İlerlemiş fibrozisi (METAVIR F3) ve sirozu (METAVIR F4) olan hastalarda HSK sürveyansı altı ayda bir süresiz olarak sürdürülmelidir.
- Sirozu olan hastalar özofagus varisleri yönünden izlenmelidir.
YAKIN ZAMANDA EDİNİLMİŞ HEPATİT C TEDAVİSİ
Bulaşma Riski ve Zararın Azaltılması
Yakın zamanda edinilmiş HCV infeksiyonunun doğrulanması veya hatta bu tablodan şüphe edilmesi söz konusu ise son dönemdeki riskli temasların belirlenmesi ve devam eden risklerin değerlendirilmesi önemlidir. Özellikle damar içi madde kullanımı Kuzey Amerika ve Avrupa’da akut infeksiyonun en yaygın nedenidir. Bu hastalarda HCV tedavisine başlanırsa, zarar azaltma stratejileri ve yakın takip yapılması antiviral tedaviye katılımın yanı sıra uyum konusunda da yardımcı olabilir (155). Hastalar özellikle enjektör veya diğer uyuşturucu kullanım ekipmanlarını paylaşmak ve yüksek riskli cinsel temas gibi viral yayılma riskiyle ilişkili davranışlardan kaçınmak veya bunları azaltmak için güçlü bir şekilde teşvik edilmelidir. MSM’de, özellikle HIV ile infekte olanlarda, HCV’nin cinsel yolla bulaşma riski daha yüksektir. HIV infeksiyonunu önlemek için temas öncesi profilaksi kullanan erkekler arasında da yakın zamanda edinilmiş HCV olguları bildirilmiştir. Travmatik cinsel ilişki ve ilaçların etkisi altındaki cinsel ilişki viral bulaşma için önemli risk faktörleri olarak bildirilmiştir (156). Bu kişilere ayrıca, jilet ve diş fırçası paylaşımından kaçınmak gibi standart önlemler de önerilmelidir.
Yakın zamanda edinilmiş HCV infeksiyonu durumunda karaciğer yetmezliği çok nadir olmakla birlikte, hastalara ek hepatotoksik etkenlerden (alkol veya yüksek doz asetaminofen gibi) kaçınmaları tavsiye edilmelidir (43).
Yeniden İnfeksiyon Riski
Tedaviden sonra spontan viral temizlenme veya KVY elde eden hastalar, HCV’ye maruz kalmaları durumunda yeniden infeksiyon riski taşıdıklarının farkında olmalıdır. Devam eden riskli davranışlarda bulunanlar için her altı ila 12 ayda bir HCV taramasının tekrarlanması önerilir. Daha önce infekte olmuş kişiler, ömür boyu anti-HCV pozitif kalacağından reinfeksiyon taramasında HCV antikor testi yerine HCV RNA testi kullanılmalıdır (24,43).
Antiviral Tedavi
HCV ile infekte olan hastalar ya virusu kendiliğinden temizler ya da kronik infeksiyon geliştirmeye devam eder. Yakın zamanda edinilmiş HCV infeksiyonunun kronikleşip kronikleşmediğini belirlemek amacıyla tedavi kararı için altı ay beklemek yerine, potansiyel olumlu etkileri ve halk sağlığı açısından erken tedavinin uygulanmasının tercih edilebilecek bir yöntem olduğu bildirilmektedir. Bununla birlikte, bazı hastalar spontan iyileşme olup olmadığını görmek için beklemeyi ve gereksiz tedaviden kaçınmayı tercih edebilir. Bu durumda spontan iyileşme ve viral temizlenme 12 hafta içinde gerçekleşeceği için olası infeksiyon tarihini takip eden 12. haftada (veya infeksiyon tarihi bilinmiyorsa tanıyı takiben 12. haftada) HCV RNA yeniden kontrol edilmeli ve saptanabilir düzeyde ise tedaviye başlanmalıdır (24,43,157). Yapılan yeni birkaç araştırmada yaklaşık %50 oranında spontan viral temizlenme olduğu gösterilmiştir (158-163). Spontan viral temizlenme görülen hastalarda, bundan emin olmak için tekrarlayan HCV RNA ölçümleri yapılmalıdır (en az 12 hafta arayla ve olası maruz kalma tarihinden en az altı ay sonra en az iki negatif HCV RNA testi şeklinde) (157).
Kronik infeksiyon doğrulanana kadar tedavi ertelenirken, şiddetli infeksiyon potansiyeli, izlem süreçlerine uymama olasılıkları ve etkenin bulaşması açısından riskli davranışlara devam etme endişesi varsa hastalar mutlaka erken veya acil tedavi için değerlendirilmelidir. Modelleme çalışmaları riskli davranışları devam eden kişilerin tedavisinin popülasyon düzeyinde HCV insidansını ve prevalansını azaltabileceğini ileri sürmektedir (164).
Hasta akut olarak tedavi edilmeyecekse, spontan temizlenmenin belirlenmesine izin vermek için altı ay boyunca HCV RNA izlemi yapılabilir. Altı ay içinde HCV RNA’sı negatif olanlarda spontan temizlenme olasıdır. Altı ay sonra HCV RNA’sı pozitif olanların kronik HCV infeksiyonu olduğu kabul edilir; ancak akut infeksiyonun geç temizlenmesi tanımlandığı için, özellikle aminotransferaz seviyeleri normale dönerse, HCV RNA’yı altı ay sonra yeniden kontrol etmek mantıklı olabilir. Yüksek seyreden HCV RNA ve ALT seviyeleri, kronik infeksiyona işaret eder ve bu noktada spontan temizlenmenin meydana gelmesi pek olası değildir (157).
Tedavi Rejimi Seçimi
Yakın zamanda edinilmiş HCV infeksiyonunun tedavisinde KHC’de kullanılan DEA’lar önerilmektedir. Tedavi süresinin kronik infeksiyona göre daha kısa olması gerektiğine vurgu yapılmakla beraber, optimal rejimler henüz belirlenmemiştir (164,165). Kronik infeksiyonda olduğu gibi SOF/VEL 12 hafta veya GLE/PIB sekiz hafta tedavileri önerilmektedir. Hastanın genotip 1 ile infekte olduğu biliniyorsa bir diğer seçenek 8 ila 12 hafta süreyle SOF/LDV ile tedavi edilmesidir (166).
Akut infeksiyon sırasında kullanılan DEA tedavisinin sonuçlarına ilişkin veriler sınırlı olmakla birlikte, çalışmaların sonuçları ve gerçek yaşam verileri yavaş yavaş ortaya çıkmaktadır. Kısaltılmış rejimler yakın zamanda edinilmiş HCV infeksiyonu için değerlendirilmiş ancak kronik infeksiyon için kullanılan standart süreli rejimler kadar etkili olmadıkları bildirilmiştir (167-172). Randomize, kontrollü, uluslararası çok merkezli REACT çalışmasında, infeksiyonun 12. ayı içinde başvuran hastalara altı hafta veya standart 12 hafta boyunca SOF/VEL verilmiş, altı haftalık tedavi grubunda daha düşük tedavi yanıtı nedeniyle çalışma erken durdurulmuştur (172). Araştırmada KVY oranları altı haftalık tedavi ile %81 (76/93) ve 12 haftalık tedavi ile %91 (86/95) bulunmuştur. Virolojik nedenler dışı tedavi başarısızlığı olanlar (ölüm, yeniden infeksiyon, takipte kayıp) dışında KVY oranları 6 ve 12 haftalık tedavi kollarında sırasıyla %90 ve %98 olarak saptanmıştır. Kalıcı viral yanıt oranındaki asıl farkın, kısa süreli tedavideki daha yüksek nüks oranından kaynaklandığı bildirilmiştir (sırasıyla %10 ve %2). Buna karşın nüksün klinik veya virolojik belirteçleri tanımlanmamıştır. Bu nedenle yakın zamanda edinilmiş HCV infeksiyonunun tedavisinde SOF/VEL kombinasyonunun 12 hafta süreyle kullanılması önerilmektedir (172).
Yakın zamanda edinilmiş HCV infeksiyonu olan 30 hasta üzerinde yapılan açık etiketli, tek kollu bir çalışmada, altı haftalık GLE/PIB tedavisiyle %90 KVY elde edildiği ve yalnızca bir hastada virolojik başarısızlık gözlendiği bildirilmiştir (167). Çalışmanın sonucunda yakın zamanda HCV infeksiyonu olan hastalarda GLE/PIB tedavisinin sekiz hafta yerine altı hafta süreyle uygulanmasının uygun bir alternatif olabileceğine vurgu yapılmıştır. Tek kollu, kontrollü olmayan birkaç çalışmada, altı veya sekiz haftalık SOF/LDV tedavisi ile yüksek KVY oranları bildirilmiştir. Sonuçlar çalışmalar arasında biraz fark gösterse de HCV RNA seviyesinin >7 log İÜ/ml olması viral nüks ile ilişkili bulunmuştur. Bu nedenle, HCV RNA seviyeleri >7 log İÜ/ml olan hastalarda tedavi süresinin 12 haftadan daha kısa olmaması gerektiği bildirilmiştir (168-171). Genotip 1 ile infekte 20 hastanın dahil edildiği bir çalışmada, hastaların tümünde altı haftalık SOF/LDV tedavisi ile KVY elde edilmiştir (167). HIV ve çoğunlukla asemptomatik akut genotip 1a veya genotip 4 HCV infeksiyonu olan 26 MSM hastada yapılan bir başka çalışmada, altı haftalık SOF/LDV ile %77 oranında KVY elde edilmiştir; KVY elde edilemeyen altı hastanın üçünde virolojik nüks belgelenmiş ve bunların tümünün viral seviyelerinin >6.9 log İÜ/ml olduğu görülmüştür (169).
Yapılan araştırmalar DEA ilaç tedavisinin kronik hepatitte olduğu gibi yakın zamanda edinilmiş HCV infeksiyonu tedavisinde de güvenle kullanılabileceğini ve hastalar tarafından iyi tolere edilebileceğini ortaya koymuştur. Bu hasta grubunda DEA ilaçlar ile yapılan tedaviye alınan yanıtın değerlendirilmesi için tedavinin kesilmesini takip eden 12. haftada HCV RNA testinin yapılması önerilmektedir. Tedavi sırasında veya sonunda bu testi yapmanın gerekli veya yararlı olup olmadığı açık değildir ve KVY alınmayan hastaların ise yeniden tedavi için değerlendirilmesi gerekir.
Öneriler
- Yakın zamanda edinilmiş HCV infeksiyonu olan, daha önce tedavi almamış veya almış tüm hastalara gecikmeden tedavi önerilmelidir.
- Hastaya antiviral tedavi başlanmadıysa spontan viral temizlenme ve kronikleşme açısından izlemi sürdürülmelidir.
- Tedavi kararı verilen, ancak gereksiz tedaviden kaçınmak ve spontan temizlenmeyi görmek için beklemek isteyen hastalarda teması takip eden 12. haftada (veya infeksiyon tarihi bilinmiyorsa tanıyı takiben 12. haftada) HCV RNA testi yapılmalıdır.
- Spontan viral temizlenme görülen hastalarda, bundan emin olmak için tekrarlayan HCV RNA düzeyi ölçümleri yapılmalıdır.
- Tedavide DEA ilaçlar tercih edilmelidir Tüm genotiplerde etkili olan SOF/VEL/VOX, HCV genotip 1 ile infekte olanlarda SOF/LDV rejimi 8-12 hafta süre ile kullanılabilir. Bu tedaviler hastalar tarafından iyi tolere edilmektedir ve güvenlidir.
- Tedavi bitiminden 12 hafta sonra KVY açısından HCV RNA testi yapılmalıdır.
HEPATİT C’DEN KORUNMA
HCV ile infekte kişiler için olan aşı çalışmaları, HCV infeksiyonunda spontan iyileşmenin gösterildiği ilk gözlemlerden bu yana küresel bir hedef olmuştur. HCV infeksiyonunun kalıcılığını önlemek için güçlü bir immün yanıtın gerekli olduğu ve spontan iyileşen kişilerde güçlü ve kalıcı olarak HCV’ye özgü T hücre yanıtı gözlendiği bildirilmiştir (173-175). B lenfositleri ve çapraz, reaktif, nötralize edici antikor yanıtlarının hızlı indüksiyonu, HCV infeksiyonunun spontan iyileşmesinde aktif bir rol oynar (176,177).
HCV’ye karşı farklı koruyuculukta ve terapötik olan aşı formları (peptit aşıları, rekombinant protein aşıları, HCV benzeri partikül aşıları, DNA aşıları ve viral vektör aşıları) ile ilgili çalışmalar devam etmektedir (173,178). HCV’nin NS5B RNA bağımlı polimerazının düzeltme aktivitesinin olmaması nedeniyle sık görülen mutasyonlar, kısa viral yarı ömür ve hızlı bölünme ile birlikte türümsüler olarak bilinen HCV varyantlarının oluşumuna yol açar (179). Oluşan yüksek genetik değişkenliğin başarılı aşı geliştirilmesinin önünde önemli bir engel teşkil ettiği düşünülmektedir (173). Günümüzde HCV infeksiyonundan korunmak için çalışmaları tamamlanmış ve onaylanmış bir aşı bulunmamaktadır. Temas öncesi ya da temas sonrası profilakside kullanılacak immünoglobülin ya da antiviral önerisi de bulunmamaktadır (24,180,181). HCV infeksiyonundan korunmak için temel strateji bulaşma yollarından kaçınmaktır. HCV infeksiyonundan korunmanın başlıca yolları şu şekilde özetlenebilir (182);
- Enjeksiyonların güvenli ve uygun kullanımı,
- Kesici-delici atıkların güvenli bir şekilde taşınması ve imha edilmesi,
- Damar içi madde kullanan kişilere kapsamlı zarar azaltma hizmetlerinin (ücretsiz enjektör dağıtımı gibi) sağlanması,
- Kan ve kan ürünü vericilerinin HCV açısından taranması (bu kişiler ayrıca HBV, HIV ve sifilis açısından da taranmalıdır),
- Sağlık personelinin eğitimi,
- Cinsel ilişki sırasında kan maruziyetinin önlenmesi.

Tablo 19. HCV ile İnfekte Kişilere Hastalığı Başkalarına Bulaştırmamaları İçin Öneriler (Kaynak 52’den uyarlanmıştır.)
Günümüzde etkili DEA’ların yaygın kullanımıyla HCV ile infekte popülasyonun tedavi edilmesinin yanı sıra etkenin bulaşması da azalmaktadır (183). HCV ile infekte damar içi madde kullanıcıları ve mahkumlar gibi riskli grupların DEA ile etkili bir şekilde tedavi edilmesinin, HCV mikroeliminasyonunda en etkili faktör olduğu gösterilmiştir (184-186). Tablo 18’de HCV yönünden taranması önerilen kişiler ve Tablo 19’da infekte hastaların başkalarına hastalığı bulaştırmalarını önlemek için takip eden hekimlerin hastalarına verebileceği danışmanlık önerileri yer almaktadır.
Öneriler
- HCV infeksiyonundan korunmak için kişiler bulaşma yollarının farkında olarak riskli davranışlardan kaçınmalıdır.
- Enjeksiyonların güvenli kullanımı sağlanmalıdır.
- Kesici-delici atıklar güvenli bir şekilde taşınmalı ve imha edilmelidir
- Damar içi madde kullanan kişilere kapsamlı zarar azaltma hizmetleri sağlanmalıdır.
- Kan ve kan ürünü vericileri HCV açısından taranmalıdır.
- Cinsel ilişki sırasında kan maruziyeti önlenmelidir.
- Tüm erişkinler ömürleri boyunca bir kez ve kadınlar her gebeliklerinde HCV açısından test edilmelidir.
- HIV ile yaşayan kişiler, eskiden damar içi madde kullanmış olanlar, daha önce hemodiyalize girenler, ALT düzeyi sürekli yüksek olanlar, HCV pozitif bir donörden Temmuz 1992’den önce kan-kan ürünü ya da solid organ nakli alıcısı olanlar, HCV pozitif kanla temas edenler ve HCV pozitif anneden doğan bebekler en az bir kez HCV açısından test edilmelidir. Damar içi madde kullananlar ve MSM’ler ideal olarak yılda iki kez ve bu sağlanamıyorsa en azından yılda bir kez HCV açısından taranmalıdır. Hemodiyaliz hastalarına diyalize girmeden önce ve her altı ayda bir HCV taraması yapılmalıdır.
HEPATİT C VİRUSUYLA TEMAS SONRASINDA YAPILMASI GEREKENLER
Temas sonrası HCV infeksiyonu gelişmesi en fazla iğne batması yoluyla olmaktadır. Müköz membrandan HCV bulaşma riski çok düşüktür. Amerika Birleşik Devletleri’nde 2017 yılında yapılmış bir çalışmada anti-HCV pozitif kaynaktan iğne batması sonrası HCV infeksiyonu gelişme riski %0.2 olarak bildirilmiştir. Aynı çalışmada 458 sağlık çalışanının müköz membran teması sonrası takiplerinde HCV infeksiyonu gelişmediği bildirilmiştir (187). Bütünlüğü tam ya da bozulmuş deri yolu ile temas sonrası HCV infeksiyonunun bulaştığına dair bir sonuç bildirilmemiştir (188,189).
Yeni kazanılmış HCV infeksiyonunda ilk belirteç HCV-RNA pozitifliğidir. Temas sonrası hastaların çoğunda 1-2 hafta içerisinde HCV RNA saptanabilir düzeylere ulaşır. Anti-HCV temas sonrası 8-11. haftalarda pozitifleşmektedir. İmmünosüpresif kişilerde pozitifleşme süresi daha da uzayabilmektedir (190). ALT düzeyleri ise temastan 4-12 hafta sonra yükselmektedir (191).
HCV için temas sonrası profilakside antiviral tedavi ya da immünoglobülin kullanımı önerilmemektedir (24,189,192). Sağlık çalışanlarında temas sonrası iki haftalık DEA profilaksisi için pilot bir çalışma başlatılmış ancak katılımcı olmaması nedeniyle araştırma durdurulmuştur (193). Temaslı kişi HCV infeksiyonu açısından yakın takip edilmelidir. HCV infeksiyonu gelişirse DEA ile tedavi önerilmektedir (24,192). İlk değerlendirmede temaslı ve kaynağın durumu ile temas şekli değerlendirilmelidir (192,194). Kaynak ilk 48 saat içerisinde değerlendirilmelidir. Amerika Birleşik Devletleri Hastalık Kontrol ve Önleme Merkezleri (CDC) önerilerine göre kaynak değerlendirmesinde iki yol izlenebilir; ilk seçenek, HCV RNA istenmesi, ikinci seçenek ise anti-HCV testi istenmesi ve pozitiflik saptanması durumunda HCV RNA testi yapılmasıdır. HCV RNA erken dönemde pozitif olmasına karşın kullanılan test kitinin saptama limitinin altında olabileceği akılda tutulmalıdır. Bu durumda tetkik sonucu negatif yazılmamalı ve birim (örneğin <15 İÜ/ml) olarak raporlanmalıdır. Kaynağın yakın zamanda HCV infeksiyonu için riskli davranış taşıdığı biliniyorsa veya şüpheleniliyorsa (önceki 4 ay içinde damar içi madde kullanımı, vb.) ya da HCV riski güvenilir bir şekilde değerlendirilemiyorsa ilk istenmesi gereken test HCV RNA olmalıdır. Kaynakta yakın zamanda kazanılmış bir HCV infeksiyonu varsa HCV RNA testi 1-2 hafta içinde saptanabilir düzeyde olacaktır (192). Amerika İnfeksiyon Hastalıkları Derneği (IDSA) rehberine göre de ilk istenecek test anti-HCV olmalı, HCV RNA yalnız immünosüpresif hastada anti-HCV ile birlikte istenmelidir (194).
Kaynak hastada, HCV RNA pozitifliği ya da anti-HCV pozitifliği ile birlikte saptama limitinin altında HCV RNA varsa ya da kaynak bilinmiyorsa temaslı takibine başlanmalıdır. Anti-HCV pozitif veya negatif ve HCV RNA negatif kaynak ile temaslılarda ise başlangıç testleri önerilmekle birlikte takip testleri önerilmemektedir (192,194). Bununla birlikte test sonuçları ile ilgili endişe varsa (numunenin saklama ve taşıma koşulları, vb.) ya da temaslıda HCV infeksiyonunun klinik bulguları gelişirse temaslı takibi yapılmalıdır (192).
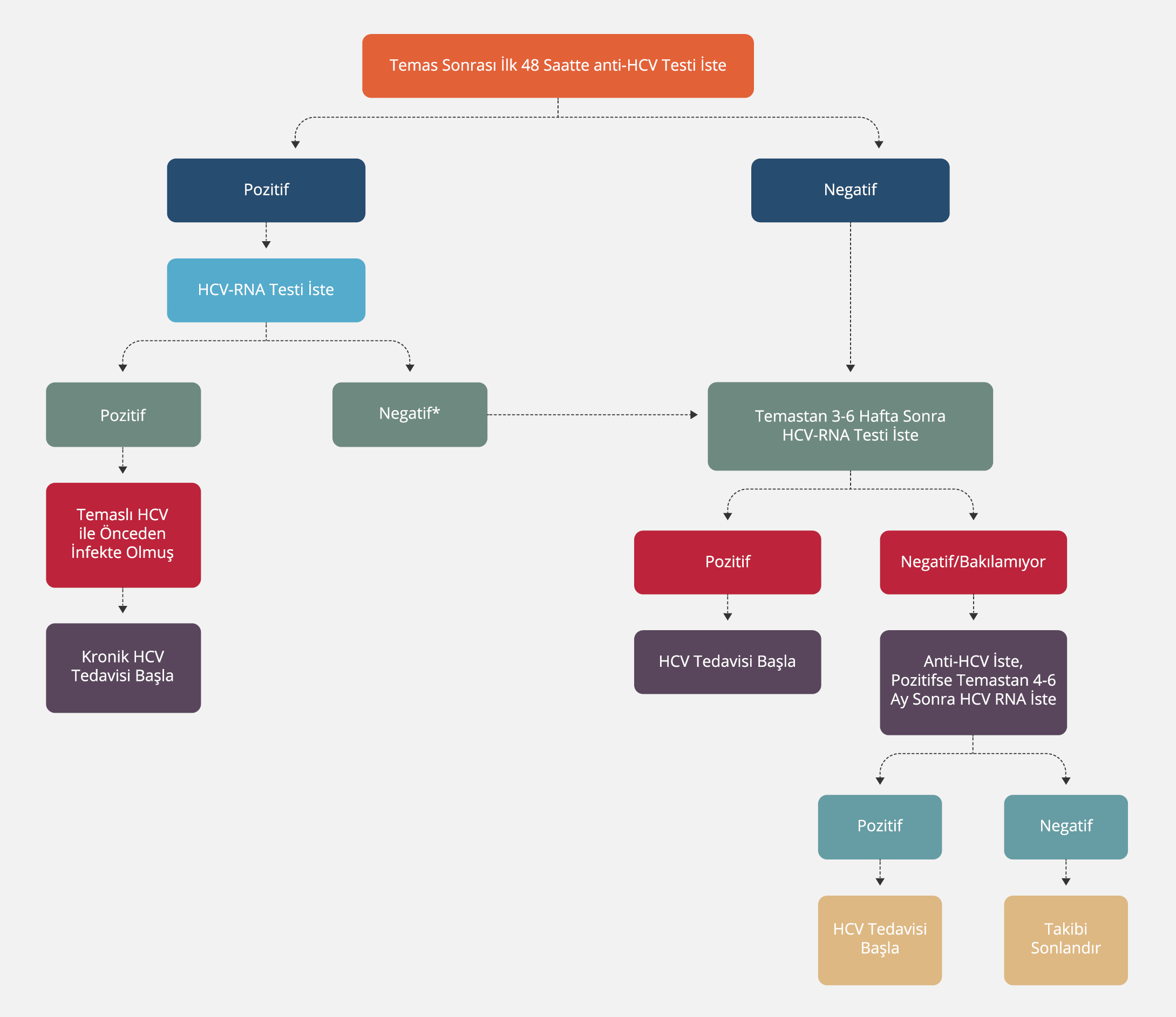
Şekil 2. Hepatit C Virusuyla Temas Sonrasında Temaslı Takibinde Yapılması Gerekenler
(Kaynak 192’den uyarlanmıştır)
Temaslıdan 48 saat içerinde anti-HCV testi istenmelidir. Pozitiflik saptanırsa HCV RNA istenmelidir (192,194). Amerika İnfeksiyon Hastalıkları Derneği rehberinde ek olarak ALT testi istenmesi de önerilmektedir (194). HCV RNA pozitifliği halinde temaslıda daha önceden edinilmiş HCV infeksiyonu olduğu düşünülmeli ve antiviral tedavi verilmelidir. Anti-HCV pozitif, ancak HCV RNA negatif saptanmışsa bu geçirilmiş infeksiyon ya da yanlış pozitifliği göstermektedir (43,192). Bu durumda kaynağın durumuna göre temaslı takibi gerekliyse, takiplerde yalnız HCV RNA kullanılmalıdır (192). Takibe devam edilen temaslılarda 3-6 hafta sonra HCV RNA istenmelidir (192,194). HCV RNA pozitifliği yeni kazanılmış HCV infeksiyonu olarak değerlendirilmeli ve antiviral tedavi verilmelidir (192). IDSA rehberinde ise 4-6 hafta sonra anti HCV, HCV RNA ve ALT testlerinin birlikte istenmesi önerilmektedir (194). HCV-RNA negatif saptanan ya da bakılamayan hastalardan temastan 4-6 ay sonra anti-HCV istenmelidir (192). IDSA rehberinde ise anti HCV ile birlikte HCV RNA ve ALT testlerinin de istenmesi önerilmektedir (194). Temaslı immünosüpresif ise ya da altta yatan karaciğer hastalığı varsa anti-HCV negatif olsa da HCV RNA testi istenmelidir (43,190). Anti-HCV pozitif saptanıp HCV RNA düzeyi saptama limitinin altında tespit edilenlerde ise HCV infeksiyonu belirtileri varsa HCV RNA testi tekrar çalışılmalıdır (195). Temaslı takibi Şekil 2’de gösterilmiştir (192).
Öneriler
- Kaynak, temas sonrası ilk 48 saatte anti-HCV ile test edilmeli, pozitiflik saptanırsa HCV RNA istenmelidir.
- Anti-HCV pozitif veya negatif ve HCV RNA negatif kaynak ile temaslılarda başlangıç testleri önerilmekle birlikte takip testleri önerilmemektedir.
- Temaslıda, temas sonrası ilk 48 saatte anti-HCV testi yaptırılmalı, negatiflik saptanırsa temastan 3-6 hafta sonra HCV RNA istenmeli, tekrar negatiflik saptanırsa 4-6 ay sonra anti-HCV istenmelidir. Pozitiflik saptanırsa HCV RNA testi yaptırılmalıdır
- Temas sonrası 4. ve 6. ayda test sonuçları negatifse takip sonlandırılmalıdır.
- HCV RNA pozitifliği saptandığında DEA ilaçlarla tedavi başlanmalıdır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – B.A., N.D.; Tasarım – B.A., Y.G., N.D.; Denetleme – N.D., B.A.; Kaynak ve Fon Sağlama – N.D.; Malzemeler/Hastalar – B.A., Y.G., R.A.Ç., G.Ç., Ü.K., B.Ö., P.K., E.T.Y., N.D.; Veri Toplama ve/veya İşleme – B.A., Y.G., R.A.Ç., G.Ç., Ü.K., B.Ö., P.K., E.T.Y., N.D.; Analiz ve/veya Yorum – B.A., Y.G., R.A.Ç., G.Ç., Ü.K., B.Ö., P.K., E.T.Y., N.D.; Literatür Taraması – B.A., Y.G., R.A.Ç., G.Ç., Ü.K., B.Ö., P.K., E.T.Y., N.D.; Makale Yazımı – B.A., Y.G., N.D.; Eleştirel İnceleme – B.A., Y.G., N.D.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Global hepatitis report 2017 [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Haziran 2023]. https://www.who.int/publications/i/item/9789241565455
- Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus infection [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Haziran 2023]. https://www.who.int/publications/i/item/9789241550345
- Spearman CW, Dusheiko GM, Hellard M, Sonderup M. Hepatitis C. Lancet. 2019;394(10207):1451-66. [CrossRef]
- Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, et al. Oral direct-acting agent therapy for hepatitis c virus infection: A systematic review. Ann Intern Med. 2017;166(9):637-48. [CrossRef]
- Han R, Zhou J, François C, Toumi M. Prevalence of hepatitis C infection among the general population and high-risk groups in the EU/EEA: a systematic review update. BGo Infect Dis. 2019;19(1):655. [CrossRef]
- Thrift AP, El-Serag HB, Kanwal F. Global epidemiology and burden of HCV infection and HCV-related disease. Nat Rev Gastroenterol Hepatol. 2017;14(2):122-32. [CrossRef]
- Guntipalli P, Pakala R, Kumari Gara S, et al. Worldwide prevalence, genotype distribution and management of hepatitis C. Acta Gastroenterol Belg. 2021;84(4):637-56. [CrossRef]
- Borgia SM, Hedskog C, Parhy B, et al. Identification of a novel hepatitis C virus genotype from Punjab, India: Expanding classification of hepatitis C virus into 8 genotypes. J Infect Dis. 2018;218(11):1722-9. [CrossRef]
- Naggie S, Wyles DL. Management of hepatitis C. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 9th ed. Philadelphia: PA: Churchill Livingstone Elsevier, 2019: 2040-71.
- Grady GF, Chalmers TC. Risk of post-transfusion viral hepatitis. N Engl J Med. 1964;271:337-42. [CrossRef]
- Tobler LH, Busch MP. History of posttransfusion hepatitis. Clin Chem. 1997;43(8 Pt 2):1487-93.
- Sartori M, La Terra G, Aglietta M, Manzin A, Navino C, Verzetti G. Transmission of hepatitis C via blood splash into conjunctiva. Scand J Infect Dis. 1993;25(2):270-1. [CrossRef]
- Nelson PK, Mathers BM, Cowie B, et al. Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews. Lancet. 2011;378(9791):571-83. [CrossRef]
- Wicker S, Cinatl J, Berger A, Doerr HW, Gottschalk R, Rabenau HF. Determination of risk of infection with blood-borne pathogens following a needlestick injury in hospital workers. Ann Occup Hyg. 2008;52(7):615-22. [CrossRef]
- Terrault NA, Dodge JL, Murphy EL, et al. Sexual transmission of hepatitis C virus among monogamous heterosexual couples: the HCV partners study. Hepatology. 2013;57(3):881-9. [CrossRef]
- Benova L, Mohamoud YA, Calvert C, Abu-Raddad LJ. Vertical transmission of hepatitis C virus: systematic review and meta-analysis. Clin Infect Dis. 2014;59(6):765-73. [CrossRef]
- McIntyre PG, Tosh K, McGuire W. Caesarean section versus vaginal delivery for preventing mother to infant hepatitis C virus transmission. Cochrane Database Syst Rev. 2006;2006(4):CD005546. [CrossRef]
- Bunchorntavakul C, Reddy KR. Management of hepatitis C before and after liver transplantation in the era of rapidly evolving therapeutic advances. J Clin Transl Hepatol. 2014;2(2):124-33. [CrossRef]
- Reid M, Price JC, Tien PC. Hepatitis C virus infection in the older patient. Infect Dis Clin North Am. 2017;31(4):827-38. [CrossRef]
- Lingala S, Ghany MG. Natural history of hepatitis C. Gastroenterol Clin North Am. 2015;44(4):717-34. [CrossRef]
- Kanda T, Yokosuka O, Imazeki F, Saisho H. Acute hepatitis C virus infection, 1986-2001: a rare cause of fulminant hepatitis in Chiba, Japan. Hepatogastroenterology. 2004;51(56):556-8.
- Fourati S, Feld JJ, Chevaliez S, Luhmann N. Approaches for simplified HCV diagnostic algorithms. J Int AIDS Soc. 2018;21(Suppl 2):e25058. [CrossRef]
- Kamili S, Drobeniuc J, Araujo AC, Hayden TM. Laboratory diagnostics for hepatitis C virus infection. Clin Infect Dis. 2012;55 Suppl 1:S43-8. [CrossRef]
- European Association for the Study of the Liver. Clinical Practice Guidelines Panel. EASL recommendations on treatment of hepatitis C: Final update of the series. J Hepatol. 2020;73(5):1170-218. Erratum in: J Hepatol. 2023;78(2):452. [CrossRef]
- Colin C, Lanoir D, Touzet S, Meyaud-Kraemer L, Bailly F, Trepo C; HEPATITIS Group. Sensitivity and specificity of third-generation hepatitis C virus antibody detection assays: an analysis of the literature. J Viral Hepat. 2001;8(2):87-95. [CrossRef]
- Freiman JM, Tran TM, Schumacher SG, et al. Hepatitis C core antigen testing for diagnosis of hepatitis C virus infection: a systematic review and meta-analysis. Ann Intern Med. 2016;165(5):345-55. [CrossRef]
- Khan H, Hill A, Main J, Brown A, Cooke G. Can hepatitis C virus antigen testing replace ribonucleic acid polymearse chain reaction analysis for detecting hepatitis C virus? A Systematic Review. Open Forum Infect Dis. 2017;4(2):ofw252. [CrossRef]
- Guidelines on hepatitis B and C testing [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Haziran 2023]. https://www.who.int/publications/i/item/9789241549981
- Vermehren J, Kau A, Gärtner BC, Göbel R, Zeuzem S, Sarrazin C. Differences between two real-time PCR-based hepatitis C virus (HCV) assays (RealTime HCV and Cobas AmpliPrep/Cobas TaqMan) and one signal amplification assay (Versant HCV RNA 3.0) for RNA detection and quantification. J Clin Microbiol. 2008;46(12):3880-91. [CrossRef]
- Greenman J, Roberts T, Cohn J, Messac L. Dried blood spot in the genotyping, quantification and storage of HCV RNA: a systematic literature review. J Viral Hepat. 2015;22(4):353-61. [CrossRef]
- Haydon GH, Jarvis LM, Blair CS, et al. Clinical significance of intrahepatic hepatitis C virus levels in patients with chronic HCV infection. Gut. 1998;42(4):570-5. [CrossRef]
- Wang TY, Kuo HT, Chen LC, Chen YT, Lin CN, Lee MM. Use of polymerase chain reaction for early detection and management of hepatitis C virus infection after needlestick injury. Ann Clin Lab Sci. 2002;32(2):137-41.
- Chevaliez S, Bouvier-Alias M, Brillet R, Pawlotsky JM. Overestimation and underestimation of hepatitis C virus RNA levels in a widely used real-time polymerase chain reaction-based method. Hepatology. 2007;46(1):22-31. [CrossRef]
- Messina JP, Humphreys I, Flaxman A, et al. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology. 2015;61(1):77-87. [CrossRef]
- Zarski JP, Sturm N, Guechot J, et al; ANRS HCEP 23 Fibrostar Group. Comparison of nine blood tests and transient elastography for liver fibrosis in chronic hepatitis C: the ANRS HCEP-23 study. J Hepatol. 2012;56(1):55-62. [CrossRef]
- Maheshwari A, Ray S, Thuluvath PJ. Acute hepatitis C. Lancet. 2008;372(9635):321-32. [CrossRef]
- Deterding K, Wiegand J, Grüner N, et al. The German Hep-Net acute hepatitis C cohort: impact of viral and host factors on the initial presentation of acute hepatitis C virus infection. Z Gastroenterol. 2009;47(6):531-40. [CrossRef]
- Loomba R, Rivera MM, McBurney R, et al. The natural history of acute hepatitis C: clinical presentation, laboratory findings and treatment outcomes. Aliment Pharmacol Ther. 2011;33(5):559-65. [CrossRef]
- Corey KE, Ross AS, Wurcel A, et al. Outcomes and treatment of acute hepatitis C virus infection in a United States population. Clin Gastroenterol Hepatol. 2006;4(10):1278-82. [CrossRef]
- Seeff LB, Everson GT, Morgan TR, et al; HALT–C Trial Group. Complication rate of percutaneous liver biopsies among persons with advanced chronic liver disease in the HALT-C trial. Clin Gastroenterol Hepatol. 2010;8(10):877-83. [CrossRef]
- Klibansky DA, Mehta SH, Curry M, Nasser I, Challies T, Afdhal NH. Transient elastography for predicting clinical outcomes in patients with chronic liver disease. J Viral Hepat. 2012 19(2):e184-93. [CrossRef]
- Boursier J, de Ledinghen V, Zarski JP, et al; multicentric groups from SNIFF 32, VINDIAG 7, and ANRS/HC/EP23 FIBROSTAR studies. Comparison of eight diagnostic algorithms for liver fibrosis in hepatitis C: new algorithms are more precise and entirely noninvasive. Hepatology. 2012;55(1):58-67. [CrossRef]
- AASLD-IDSA HCV Guidance Panel. Hepatitis C Guidance 2018 Update: AASLD-IDSA recommendations for testing, managing, and treating hepatitis C virus infection. Clin Infect Dis. 2018;67(10):1477-92. [CrossRef]
- McGovern BH, Birch CE, Bowen MJ, et al. Improving the diagnosis of acute hepatitis C virus infection with expanded viral load criteria. Clin Infect Dis. 2009;49(7):1051-60. [CrossRef]
- Fanning L, Kenny-Walsh E, Levis J, et al. Natural fluctuations of hepatitis C viral load in a homogeneous patient population: a prospective study. Hepatology. 2000;31(1):225-9. [CrossRef]
- Barreiro P, Labarga P, Fernández-Montero JV, et al. Longitudinal changes in viral RNA concentration in patients with chronic hepatitis C and/or HIV infection in the absence of antiviral therapy. J Clin Virol. 2013;58(2):391-5. [CrossRef]
- Arena U, Vizzutti F, Corti G, et al. Acute viral hepatitis increases liver stiffness values measured by transient elastography. Hepatology. 2008;47(2):380-4. [CrossRef]
- Simmons B, Saleem J, Hill A, Riley RD, Cooke GS. Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response: a systematic review and meta-analysis. Clin Infect Dis. 2016;62(6):683-94. [CrossRef]
- Sarrazin C, Isakov V, Svarovskaia ES, et al. Late relapse versus hepatitis C virus reinfection in patients with sustained virologic response after sofosbuvir-based therapies. Clin Infect Dis. 2017;64(1):44-52. [CrossRef]
- Mauro E, Crespo G, Montironi C, et al. Portal pressure and liver stiffness measurements in the prediction of fibrosis regression after sustained virological response in recurrent hepatitis C. Hepatology. 2018;67(5):1683-94. [CrossRef]
- Carrat F, Fontaine H, Dorival C, et al; French ANRS CO22 Hepather cohort. Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: a prospective cohort study. Lancet. 2019;393(10179):1453-64. [CrossRef]
- Aygen B, Demirtürk N, Türker N, et al. Kronik hepatit C virusu infeksiyonunun yönetimi: Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu Uzlaşı Raporu-2017 Güncellemesi. Klimik Derg. 2017;30(Özel Sayı 1):2-36. [CrossRef]
- Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38(2):518-26. [CrossRef]
- Sterling RK, Lissen E, Clumeck N, et al; APRICOT Clinical Investigators. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology. 2006;43(6):1317-25. [CrossRef]
- European Association for Study of Liver; Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63(1):237-64. [CrossRef]
- Afdhal NH, Bacon BR, Patel K, et al. Accuracy of fibroscan, compared with histology, in analysis of liver fibrosis in patients with hepatitis B or C: a United States multicenter study. Clin Gastroenterol Hepatol. 2015;13(4):772-9.e1-3. [CrossRef]
- Goldberg E, Chopra S. Cirrhosis in adults: Overview of complications, general management, and prognosis [Internet]. Waltham, MA: Up To Date, Inc. [erişim 1 Aralık 2022]. https://www.uptodate.com/contents/cirrhosis-in-adults-overview-of-complications-general-management-and-prognosis
- Updated recommendations on treatment of adolescents and children with chronic HCV infection, and HCV simplified service delivery and diagnostics testing [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Haziran 2023]. https://www.who.int/publications/i/item/9789240052734
- FDA warns about rare occurrence serious liver injury use hepatitis C medicines mavyret, zepatier and vosevi in some patients with advanced liver disease [Internet]. Maryland: US Food and Drug Administration (FDA). [erişim 14 Haziran 2023]. https://www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-occurrence-serious-liver-injury-use-hepatitis-c-medicines-mavyret-zepatier-and
- Cacoub P, Desbois AC, Comarmond C, Saadoun D. Impact of sustained virological response on the extrahepatic manifestations of chronic hepatitis C: a meta-analysis. Gut. 2018;67(11):2025-34. [CrossRef]
- de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. Lancet Glob Health. 2020;8(2):180-90. [CrossRef]
- Graham CS, Baden LR, Yu E, et al. Influence of human immunodeficiency virus infection on the course of hepatitis C virus infection: a meta-analysis. Clin Infect Dis. 2001;33(4):562-9. [CrossRef]
- Hepatitis C Virus Infection Consensus Statement Working Group. Australian recommendations for the management of hepatitis C virus infection: a consensus statement (2022) [Internet]. Melbourne: Gastroenterological Society of Australia, 2022. [erişim 14 Haziran 2023]. https://www.hepcguidelines.org.au/wp-content/uploads/2023/02/hepatitis-C-virus-infection-a-consensus-statement-2022-100223.pdf
- Kirby B, Mathias A, Rossi, S, et al. GS-7977 & HIV ARTs PK-noclinically significant pharmacokinetic interactions between sofosbuvir (GS-7977) and HIV antiretrovirals atripla, rilpivirine, darunavir/ritonavir, orraltegravir in healthy volunteers [Abstract]. In: 63rd Annual Meeting of the American Association for the Study of Liver Diseases November 9-13, 2012, Boston, Massachusetts, United States 2012:9-12.
- Back DJ, Burger DM. Interaction between amiodarone and sofosbuvir-based treatment for hepatitis C virus infection: potential mechanisms and lessons to be learned. Gastroenterology. 2015;149(6):1315-7. [CrossRef]
- Mangia A, Milligan S, Khalili M, et al. Global real-world evidence of sofosbuvir/velpatasvir as simple, effective HCV treatment: Analysis of 5552 patients from 12 cohorts. Liver Int. 2020;40(8):1841-52. [CrossRef]
- Flemming JA, Kim WR, Brosgart CL, Terrault NA. Reduction in liver transplant wait-listing in the era of direct-acting antiviral therapy. Hepatology. 2017;65(3):804-12. [CrossRef]
- Belli LS, Berenguer M, Cortesi PA, et al; European Liver and Intestine Association (ELITA). Delisting of liver transplant candidates with chronic hepatitis C after viral eradication: A European study. J Hepatol. 2016;65(3):524-31. [CrossRef]
- Kanwal F, Kramer J, Asch SM, Chayanupatkul M, Cao Y, El-Serag HB. Risk of hepatocellular cancer in HCV patients treated with direct-acting antiviral agents. Gastroenterology. 2017;153(4):996-1005.e1. [CrossRef]
- Chhatwal J, Kanwal F, Roberts MS, Dunn MA. Cost-effectiveness and budget impact of hepatitis C virus treatment with sofosbuvir and ledipasvir in the United States. Ann Intern Med. 2015;162(6):397-406. [CrossRef]
- Knop V, Hoppe D, Welzel T, et al. Regression of fibrosis and portal hypertension in HCV-associated cirrhosis and sustained virologic response after interferon-free antiviral therapy. J Viral Hepat. 2016;23(12):994-1002. [CrossRef]
- Lawitz E, Poordad FF, Pang PS, et al. Sofosbuvir and ledipasvir fixed-dose combination with and without ribavirin in treatment-naive and previously treated patients with genotype 1 hepatitis C virus infection (LONESTAR): an open-label, randomised, phase 2 trial. Lancet. 2014;383(9916):515-23. [CrossRef]
- Gane EJ, Stedman CA, Hyland RH, et al. Efficacy of nucleotide polymerase inhibitor sofosbuvir plus the NS5A inhibitor ledipasvir or the NS5B non-nucleoside inhibitor GS-9669 against HCV genotype 1 infection. Gastroenterology. 2014;146(3):736-43.e1. [CrossRef]
- Charlton M, Everson GT, Flamm SL, et al; SOLAR-1 Investigators. Ledipasvir and sofosbuvir plus ribavirin for treatment of HCV infection in patients with advanced liver disease. Gastroenterology. 2015;149(3):649-59. [CrossRef]
- Terrault NA, Zeuzem S, Di Bisceglie AM, et al; HCV-TARGET Study Group. Effectiveness of ledipasvir-sofosbuvir combination in patients with hepatitis C virus infection and factors associated with sustained virologic response. Gastroenterology. 2016;151(6):1131-40.e5. [CrossRef]
- Buggisch P, Vermehren J, Mauss S, et al. Real-world effectiveness of 8-week treatment with ledipasvir/sofosbuvir in chronic hepatitis C. J Hepatol. 2018;68(4):663-71. [CrossRef]
- Feld JJ, Jacobson IM, Hézode C, et al; ASTRAL-1 Investigators. Sofosbuvir and velpatasvir for HCV genotype 1, 2, 4, 5, and 6 infection. N Engl J Med. 2015;373(27):2599-607. [CrossRef]
- Everson GT, Towner WJ, Davis MN, et al. Sofosbuvir with velpatasvir in treatment-naive noncirrhotic patients with genotype 1 to 6 hepatitis C Virus infection: A randomized trial. Ann Intern Med. 2015;163(11):818-26. [CrossRef]
- Pianko S, Flamm SL, Shiffman ML, et al. Sofosbuvir plus velpatasvir combination therapy for treatment-experienced patients with genotype 1 or 3 hepatitis C virus infection: A randomized trial. Ann Intern Med. 2015;163(11):809-17. [CrossRef]
- Bourlière M, Gordon SC, Flamm SL, et al; POLARIS-1 and POLARIS-4 Investigators. Sofosbuvir, velpatasvir, and voxilaprevir for previously treated HCV infection. N Engl J Med. 2017;376(22):2134-46. [CrossRef]
- Zeuzem S, Foster GR, Wang S, et al. Glecaprevir-pibrentasvir for 8 or 12 weeks in HCV genotype 1 or 3 infection. N Engl J Med. 2018;378(4):354-69. [CrossRef]
- Puoti M, Foster GR, Wang S, et al. High SVR rates with eight and twelve weeks of pangenotypic glecaprevir/pibrentasvir: Integrated efficacy analysis of genotype 1-6 patients without cirrhosis [Abstract]. In: Journal of Hepatology Abstract Book. The International Liver Congress 2017. Amsterdam, The Netherlands, April 19-23, 2017:721.
- Forns X, Lee SS, Valdes J, et al. Glecaprevir plus pibrentasvir for chronic hepatitis C virus genotype 1, 2, 4, 5, or 6 infection in adults with compensated cirrhosis (EXPEDITION-1): a single-arm, open-label, multicentre phase 3 trial. Lancet Infect Dis. 2017;17(10):1062-8. [CrossRef]
- Mavyret prescribing information [Internet]. North Chicago, IL: AbbVieInc. [erişim 3 şubat 2023]. https://www.mavyret.com/
- Zeuzem S, Ghalib R, Reddy KR, et al. Grazoprevir-elbasvir combination therapy for treatment-naive cirrhotic and noncirrhotic patients with chronic hepatitis C virus genotype 1, 4, or 6 infection: A randomized trial. Ann Intern Med. 2015;163(1):1-13. [CrossRef]
- Jacobson IM, Lawitz E, Kwo PY, et al. Safety and efficacy of elbasvir/grazoprevir in patients with hepatitis C virus infection and compensated cirrhosis: An integrated analysis. Gastroenterology. 2017;152(6):1372-82.e2. [CrossRef]
- Thompson A, Zeuzem S, Rockstroh J, et al. The combination of elbasvir and grazoprevir ± RBV is highly effective for the treatment of GT1a-infected patients [Abstract]. In: Abstracts of the American Association for the Study of Liver Diseases Liver Meeting, San Francisco CA, November 13-17, 2015.
- Sulkowski M, Hezode C, Gerstoft J, et al. Efficacy and safety of 8 weeks versus 12 weeks of treatment with grazoprevir (MK-5172) and elbasvir (MK-8742) with or without ribavirin in patients with hepatitis C virus genotype 1 mono-infection and HIV/hepatitis C virus co-infection (C-WORTHY): a randomised, open-label phase 2 trial. Lancet. 2015;385(9973):1087-97. [CrossRef]
- Rockstroh JK, Nelson M, Katlama C, et al. Efficacy and safety of grazoprevir (MK-5172) and elbasvir (MK-8742) in patients with hepatitis C virus and HIV co-infection (C-EDGE CO-INFECTION): a non-randomised, open-label trial. Lancet HIV. 2015;2(8):e319-27. Erratum in: Lancet HIV. 2015;2(8):e316. Erratum in: Lancet HIV. 2015;2(10):e416. [CrossRef]
- Dore GJ, Altice F, Litwin AH, et al; C-EDGE CO-STAR Study Group. Elbasvir-grazoprevir to treat hepatitis C virus infection in persons receiving opioid agonist therapy: A randomized trial. Ann Intern Med. 2016;165(9):625-34. [CrossRef]
- Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment-naive and treatment-experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C-SURFER study): a combination phase 3 study. Lancet. 2015;386(10003):1537-45. Erratum in: Lancet. 2015;386(10006):1824. [CrossRef]
- Kwo P, Gitlin N, Nahass R, et al. Simeprevir plus sofosbuvir (12 and 8 weeks) in hepatitis C virus genotype 1-infected patients without cirrhosis: OPTIMIST-1, a phase 3, randomized study. Hepatology. 2016;64(2):370-80. [CrossRef]
- Lawitz E, Matusow G, DeJesus E, et al. Simeprevir plus sofosbuvir in patients with chronic hepatitis C virus genotype 1 infection and cirrhosis: A phase 3 study (OPTIMIST-2). Hepatology. 2016;64(2):360-9. [CrossRef]
- Foster GR, Afdhal N, Roberts SK, et al; ASTRAL-2 Investigators; ASTRAL-3 Investigators. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 infection. N Engl J Med. 2015;373(27):2608-17. [CrossRef]
- Jacobson IM, Lawitz E, Gane EJ, et al. Efficacy of 8 weeks of sofosbuvir, velpatasvir, and voxilaprevir in patients with chronic HCV infection: 2 phase 3 randomized trials. Gastroenterology. 2017;153(1):113-22. [CrossRef]
- Hassanein T, Wyles D, Wang S, et al. Surveyor-II, Part 4: Glecaprevir/pibrentasvir demonstrates high SVR rates in patients with HCV genotype 2, 4, 5, or 6 infection without cirrhosis following an 8-week treatment duration [Abstract]. In: The American Association for the Study of Liver Diseases Liver Meeting, Boston, MA, November 11-15, 2016.
- Brown RS Jr, Buti M, Rodrigues L, et al. Glecaprevir/pibrentasvir for 8 weeks in treatment-naïve patients with chronic HCV genotypes 1-6 and compensated cirrhosis: The EXPEDITION-8 trial. J Hepatol. 2020;72(3):441-9. [CrossRef]
- Zeuzem S, Dusheiko GM, Salupere R, et al; VALENCE Investigators. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. N Engl J Med. 2014;370(21):1993-2001. [CrossRef]
- Foster GR, Pianko S, Brown A, et al; BOSON Study Group. Efficacy of sofosbuvir plus ribavirin with or without peginterferon-alfa in patients with hepatitis C virus genotype 3 infection and treatment-experienced patients with cirrhosis and hepatitis C virus genotype 2 infection. Gastroenterology. 2015;149(6):1462-70. [CrossRef]
- Alqahtani S, Zeuzem S, Manns M, et al. Safety and effectiveness of sofosbuvir-based regimens for the treatment of hepatitis C genotype 3 and 4 infections: Interim analysis of a prospective, observational study [Abstract]. In: The 50th Annual Meeting of the European Association for the Study of the Liver (EASL), Vienna Austria, April 22-26, 2015.
- Kowdley K, Bacon B, Dieterich D, et al. Efficacy evaluation of 24 week SOF + RBV in a heterogeneous, real-worldpopulation of genotype 3 HCV patients: Data fromthe TRIO network. In: The 50th Annual Meeting of the European Association for the Study of the Liver (EASL), ViennaAustria, April 22-26, 2015.
- Gane EJ, Hyland RH, An D, et al. Efficacy of ledipasvir and sofosbuvir, with or without ribavirin, for 12 weeks in patients with HCV genotype 3 or 6 infection. Gastroenterology. 2015;149(6):1454-61.e1. [CrossRef]
- Feld JJ, Ramji A, Shafran SD, et al. Ledipasvir-sofosbuvir plus ribavirin in treatment-naive patients with hepatitis C virus genotype 3 infection: An open-label study. Clin Infect Dis. 2017;65(1):13-9. [CrossRef]
- Esteban R, Pineda JA, Calleja JL, et al. Efficacy of sofosbuvir and velpatasvir, with and without ribavirin, in patients with hepatitis C virus genotype 3 infection and cirrhosis. Gastroenterology. 2018;155(4):1120-7.e4. [CrossRef]
- Kohli A, Kapoor R, Sims Z, et al. Ledipasvir and sofosbuvir for hepatitis C genotype 4: a proof-of-concept, single-centre, open-label phase 2a cohort study. Lancet Infect Dis. 2015;15(9):1049-54. [CrossRef]
- Abergel A, Asselah T, Metivier S, et al. Ledipasvir-sofosbuvir in patients with hepatitis C virus genotype 5 infection: an open-label, multicentre, single-arm, phase 2 study. Lancet Infect Dis. 2016;16(4):459-64. [CrossRef]
- Asselah T, Kowdley KV, Zadeikis N, et al. Efficacy of glecaprevir/pibrentasvir for 8 or 12 weeks in patients with hepatitis C virus genotype 2, 4, 5, or 6 infection without cirrhosis. Clin Gastroenterol Hepatol. 2018;16(3):417-26. [CrossRef]
- Asselah T, Reesink HW, Gerstoft J, et al. High efficacy of grazoprevir and elbasvir with or without ribavirin in 103 treatment-naive and experienced patients with HCV genotype 4 infection: A pooledanalysis [Abstract]. In: The American Association for the Study of Liver Diseases Liver Meeting, San Francisco CA, November 13-17, 2015.
- Ruane PJ, Ain D, Stryker R, et al. Sofosbuvir plus ribavirin for the treatment of chronic genotype 4 hepatitis C virus infection in patients of Egyptian ancestry. J Hepatol. 2015;62(5):1040-6. [CrossRef]
- Moreno C, Hezode C, Marcellin P, et al. Efficacy and safety of simeprevir with PegIFN/ribavirin in naïve or experienced patients infected with chronic HCV genotype 4. J Hepatol. 2015;62(5):1047-55. [CrossRef]
- Carrion AF. Treatment of HCV in individuals with decompensated cirrhosis. J Liver Res Disord Ther. 2017;3:81-2. [CrossRef]
- Curry MP, O’Leary JG, Bzowej N, et al; ASTRAL-4 Investigators. Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med. 2015;373(27):2618-28. [CrossRef]
- Sosyal Güvenlik Kurumu Sağlık Uygulama Tebliği [Internet]. Ankara: T.C. Cumhurbaşkanlığı Mevzuat Bilgi Sistemi. [erişim 21 Aralık 2022]. https://www.mevzuat.gov.tr/mevzuat?MevzuatNo=17229&MevzuatTur=9&MevzuatTertip=5
- Vermehren J, Susser S, Dietz J, et al. Retreatment of patients who failed DAA-combination therapies: real-world experience from a large hepatitis C resistance database. J Hepatol. 2016;64(Suppl 2):S188. [CrossRef]
- Sorbo MC, Cento V, Di Maio VC, et al. Hepatitis C virus drug resistance associated substitutions and their clinical relevance: Update 2018. Drug Resist Updat. 2018;37:17-39. Erratum in: Drug Resist Updat. 2018 Apr 1. [CrossRef]
- Degasperi E, Spinetti A, Lombardi A, et al; NAVIGATORE-Lombardia and Veneto Study Groups. Real-life effectiveness and safety of sofosbuvir/velpatasvir/voxilaprevir in hepatitis C patients with previous DAA failure. J Hepatol. 2019;71(6):1106-15. [CrossRef]
- Janjua N, Wilton J, Cook D, et al. Real-world effectiveness of sofosbuvir/velpatasvir/voxilaprevir as a hepatitis C virus infection salvage treatment. Hepatology. 2020;73(Supll 1):356-7. [CrossRef]
- Da BL, Lourdusamy V, Kushner T, Dieterich D, Saberi B. Efficacy of sofosbuvir/velpatasvir/voxilaprevir in direct-acting antiviral experienced patients with hepatitis C virus. Eur J Gastroenterol Hepatol. 2021;33(6):859-61. [CrossRef]
- Poordad F, Pol S, Asatryan A, et al. Glecaprevir/Pibrentasvir in patients with hepatitis C virus genotype 1 or 4 and past direct-acting antiviral treatment failure. Hepatology. 2018;67(4):1253-60. [CrossRef]
- Nguyen D, Smith D, Vaughan-Jackson A, Magri A; STOP-HCV Consortium; Barnes E, Simmonds P. Efficacy of NS5A inhibitors against unusual and potentially difficult-to-treat HCV subtypes commonly found in sub-Saharan Africa and South East Asia. J Hepatol. 2020;73(4):794-9. [CrossRef]
- Gottwein JM, Pham LV, Mikkelsen LS, et al. Efficacy of NS5A inhibitors against hepatitis C virus genotypes 1-7 and escape variants. Gastroenterology. 2018;154(5):1435-48. [CrossRef]
- Krishnan P, Pilot-Matias T, Schnell G, et al. Pooled resistance analysis in patients with hepatitis C virus genotype 1 to 6 infection treated with glecaprevir-pibrentasvir in phase 2 and 3 clinical trials. Antimicrob Agents Chemother. 2018;62(10):e01249-18. [CrossRef]
- Lok AS, Sulkowski MS, Kort JJ, et al. Efficacy of glecaprevir and pibrentasvir in patients with genotype 1 hepatitis C virus infection with treatment failure after NS5A inhibitor plus sofosbuvir therapy. Gastroenterology. 2019;157(6):1506-17.e1. [CrossRef]
- Wyles D, Weiland O, Yao B, et al. Retreatment of patients who failed glecaprevir/pibrentasvir treatment for hepatitis C virus infection. J Hepatol. 2019;70(5):1019-23. [CrossRef]
- Pearlman B, Perrys M, Hinds A. Sofosbuvir/velpatasvir/voxilaprevir for previous treatment failures with glecaprevir/pibrentasvir in chronic hepatitis C infection. Am J Gastroenterol. 2019;114(9):1550-2. [CrossRef]
- Trudeau S, Mendiratta V, Dababneh Y, Hollingsworth J, Gordon SC. Letter to the editor: Successful treatment of multidrug resistant hepatitis C after >12 months of continuous therapy with direct-acting antivirals. Hepatology. 2023;77(1):E9-E10. [CrossRef]
- Bernhard B, Stickel F. Successful fourth line treatment of a relapse patient with chronic hepatitis C virus infection genotype 3a using sofosbuvir, glecaprevir/pibrentasvir, and ribavirin: a case report. Z Gastroenterol. 2020;58(5):451-5. [CrossRef]
- Fierer DS, Wyles DL. Re-treatment of hepatitis C infection after multiple failures of direct-acting antiviral therapy. Open Forum Infect Dis. 2020;7(4):ofaa095. [CrossRef]
- Gane EJ, Shiffman ML, Etzkorn K, et al; GS-US-342-1553 Investigators. Sofosbuvir-velpatasvir with ribavirin for 24 weeks in hepatitis C virus patients previously treated with a direct-acting antiviral regimen. Hepatology. 2017;66(4):1083-9. [CrossRef]
- Chayama K, Hayes CN. HCV drug resistance challenges in Japan: The role of pre-existing variants and emerging resistant strains in direct acting antiviral therapy. Viruses. 2015;7(10):5328-42. [CrossRef]
- Pawlotsky JM. Hepatitis C virus resistance to direct-acting antiviral drugs in interferon-free regimens. Gastroenterology. 2016;151(1):70-86. [CrossRef]
- Sargin Altunok E, Sayan M, Akhan S, et al. Protease inhibitors drug resistance mutations in Turkish patients with chronic hepatitis C. Int J Infect Dis. 2016;50:1-5. [CrossRef]
- Rodriguez C, Mercier-Darty M, Soulier A, et al. Performance assessment of a fully automated deep sequencing platform for HCV resistance testing. Antivir Ther. 2019;24(6):417-23. [CrossRef]
- Fourati S, Pawlotsky JM. Virologic tools for HCV drug resistance testing. Viruses. 2015;7(12):6346-59. [CrossRef]
- Drysdale K, Townley C, Mahomed F, Foster GR. Effectiveness of therapy in 16,567 directly-acting antiviral treated people in England: High response rates in genotype 3 hepatitis C infection regardless of degree of fibrosis, but ribavirin improves response in cirrhosis. J Hepatol. 2019;70:e131. [CrossRef]
- Wei L, Lim SG, Xie Q, et al. Sofosbuvir-velpatasvir for treatment of chronic hepatitis C virus infection in Asia: a single-arm, open-label, phase 3 trial. Lancet Gastroenterol Hepatol. 2019;4(2):127-34. [CrossRef]
- Singh AD, Maitra S, Singh N, et al. Systematic review with meta-analysis: impact of baseline resistance-associated substitutions on the efficacy of glecaprevir/pibrentasvir among chronic hepatitis C patients. Aliment Pharmacol Ther. 2020;51(5):490-504. [CrossRef]
- Wei LJ, Zhdanov K, Burnevich E, Sheen IS, Heo J, Nguyen VK, et al. Efficacy and safety of elbasvir/grazoprevir in treatment-naïve patients with chronic HCV GT 1, GT 4 and GT 6 infection (C-CORAL): a phase III randomized multinational clinical trial. J Hepatol. 2017;66:S529.
- Kwo P, Gane EJ, Peng CY, et al. Effectiveness of elbasvir and grazoprevir combination, with or without ribavirin, for treatment-experienced patients with chronic hepatitis C infection. Gastroenterology. 2017;152(1):164-75.e4. [CrossRef]
- Zeuzem S, Serfaty L, Vierling J, et al. The safety and efficacy of elbasvir and grazoprevir in participants with hepatitis C virus genotype 1b infection. J Gastroenterol. 2018;53(5):679-88. [CrossRef]
- Eckhardt B, Mateu-Gelabert P, Aponte-Melendez Y, et al. Accessible hepatitis C care for people who inject drugs: a randomized clinical trial. JAMA Intern Med. 2022;182(5):494-502. [CrossRef]
- Wyles D, Nelson D, Swain M, et al. On-treatment HCV RNA as a predictor of virologic response in sofosbuvir-containing regimens for genotype 2/3 HCV infection: Analysis of the FISSION, POSITRON, and FUSION studies [Abstract]. In: Abstracts of 64th Annual Meeting of the American Association for the Study of Liver Diseases (Washington, DC, November 1-5, 2013) [Internet]. The National AIDS Treatment Advocacy Program-NATAP Website-Conference Reports for NATAP. [erişim 20 Aralık 2022]. https://www.natap.org/2013/AASLD/AASLD_72.htm
- Kowdley KV, Nelson DR, Lalezari JP, et al. On-treatment HCV RNA as a predictor of sustained virological response in HCV genotype 3-infected patients treated with daclatasvir and sofosbuvir. Liver Int. 2016;36(11):1611-8. [CrossRef]
- Dufour JF, Zuckerman E, Zadeikis N, et al. Safety of glecaprevir/pibrentasvir in adults with chronic genotype 1-6 hepatitis C virus infection: an integrated analysis. J Hepatol. 2017;66(Sup.1):1657-64. [CrossRef]
- Fried MW. Side effects of therapy of hepatitis C and their management. Hepatology. 2002;36(Suppl 1):S237-44. [CrossRef]
- Sulkowski MS, Poordad F, Manns MP, et al; SPRINT-2 Trial Investigators. Anemia during treatment with peginterferon alfa-2b/ribavirin and boceprevir: Analysis from the serine protease inhibitor therapy 2 (SPRINT-2) trial. Hepatology. 2013;57(3):974-84. [CrossRef]
- Hadziyannis SJ, Sette H Jr, Morgan TR, et al; PEGASYS International Study Group. Peginterferon-alpha2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med. 2004;140(5):346-55. [CrossRef]
- FDA Drug Safety Communication: FDA warns about the risk of hepatitis B reactivating in some patients treated with direct-acting antivirals for hepatitis C, April 2016 [Internet]. Maryland: US Food and Drug Administration (FDA). [erişim 14 Haziran 2023]. https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-warns-about-risk-hepatitis-b-reactivating-some-patients-treated
- Perspectives from new adverse event reports [Internet]. Institute for Safe Medication Practices Website – Quarter Watch. [erişim 14 Haziran 2023]. https://www.ismp.org/quarterwatch/perspectives-new-adverse-event-reports
- Arase Y, Kobayashi M, Suzuki F, et al. Effect of type 2 diabetes on risk for malignancies includes hepatocellular carcinoma in chronic hepatitis C. Hepatology. 2013;57(3):964-73. [CrossRef]
- van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA. 2012;308(24):2584-93. [CrossRef]
- Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68(2):723-50. [CrossRef]
- Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: Risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology. 2017;65(1):310-35. [CrossRef]
- Hajarizadeh B, Cunningham EB, Valerio H, et al. Hepatitis C reinfection after successful antiviral treatment among people who inject drugs: A meta-analysis. J Hepatol. 2020;72(4):643-57. [CrossRef]
- Akiyama MJ, Norton BL, Arnsten JH, Agyemang L, Heo M, Litwin AH. Intensive models of hepatitis C care for people who inject drugs receiving opioid agonist therapy: a randomized controlled trial. Ann Intern Med. 2019;170(9):594-603. [CrossRef]
- Werner RN, Gaskins M, Nast A, Dressler C. Incidence of sexually transmitted infections in men who have sex with men and who are at substantial risk of HIV infection – A meta-analysis of data from trials and observational studies of HIV pre-exposure prophylaxis. PLoS One. 2018;13(12):e0208107. Erratum in: PLoS One. 2019;14(12):e0226209. [CrossRef]
- Bulteel N, Partha Sarathy P, Forrest E, Stanley AJ, Innes H, Mills PR, Valerio H, Gunson RN, Aitken C, Morris J, Fox R, Barclay ST. Factors associated with spontaneous clearance of chronic hepatitis C virus infection. J Hepatol. 2016;65(2):266-72. [CrossRef]
- Nunnari G, Montineri A, Portelli V, Savalli F, Fatuzzo F, Cacopardo B. The use of peginterferon in monotherapy or in combination with ribavirin for the treatment of acute hepatitis C. Eur Rev Med Pharmacol Sci. 2012;16(8):1013-6.
- Pérez-Álvarez R, García-Samaniego J, Solá R, et al. Acute hepatitis C in Spain: a retrospective study of 131 cases. Rev Esp Enferm Dig. 2012;104(1):21-8. English, Spanish. [CrossRef]
- Morin T, Pariente A, Lahmek P; Investigator Group of ANGH, SPILF, FNPRH. Favorable outcome of acute occupational hepatitis C in healthcare workers: a multicenter French study on 23 cases. Eur J Gastroenterol Hepatol. 2011;23(6):515-20. [CrossRef]
- Grebely J, Pham ST, Matthews GV, et al; ATAHC Study Group. Hepatitis C virus reinfection and superinfection among treated and untreated participants with recent infection. Hepatology. 2012;55(4):1058-69. [CrossRef]
- Ferreira Ade S, Perez Rde M, Ferraz ML, et al; Acute Hepatitis C Study Group of The Brazilian Society of Hepatology. Acute hepatitis C in Brazil: results of a national survey. J Med Virol. 2011;83(10):1738-43. [CrossRef]
- Dirchwolf M, Marciano S, Mauro E, et al. Clinical epidemiology of acute hepatitis C in South America. J Med Virol. 2017;89(2):276-83. [CrossRef]
- Martin NK, Thornton A, Hickman M, et al. Can hepatitis C virus (HCV) direct-acting antiviral treatment as prevention reverse the HCV epidemic among men who have sex with men in the United Kingdom? Epidemiological and modeling insights. Clin Infect Dis. 2016;62(9):1072-80. [CrossRef]
- Corey KE, Mendez-Navarro J, Gorospe EC, Zheng H, Chung RT. Early treatment improves outcomes in acute hepatitis C virus infection: a meta-analysis. J Viral Hepat. 2010;17(3):201-7. [CrossRef]
- Matthews GV, Bhagani S, Van der Valk M, et al. Short duration sofosbuvir-velpatasvir is inferior to standard duration therapy in the treatment of recently acquired HCV infection: results from the REACT study [Abstract]. In: Abstracts of 69th Annual Meeting of the American Association for the Study of Liver Diseases (Boston, MA, November 8, 2019.) [Internet]. The National AIDS Treatment Advocacy Program-NATAP Website- Conference Reports for NATAP. [erişim 10 Aralık 2022]. https://www.natap.org/2019/AASLD/AASLD_23.htm
- Martinello M, Orkin C, Cooke G, et al. Short-duration pan-genotypic therapy with glecaprevir/pibrentasvir for 6 weeks among people with recent hepatitis C viral infection. Hepatology. 2020;72(1):7-18. [CrossRef]
- Deterding K, Spinner CD, Schott E, et al; HepNet Acute HCV IV Study Group. Ledipasvir plus sofosbuvir fixed-dose combination for 6 weeks in patients with acute hepatitis C virus genotype 1 monoinfection (HepNet Acute HCV IV): an open-label, single-arm, phase 2 study. Lancet Infect Dis. 2017;17(2):215-22. [CrossRef]
- Rockstroh JK, Bhagani S, Hyland RH, et al. Ledipasvir-sofosbuvir for 6 weeks to treat acute hepatitis C virus genotype 1 or 4 infection in patients with HIV coinfection: an open-label, single-arm trial. Lancet Gastroenterol Hepatol. 2017;2(5):347-53. [CrossRef]
- Palaniswami PM, El Sayed A, Asriel B, Carollo JR, Fierer DS; New York Acute Hepatitis C Surveillance Network. Ledipasvir and sofosbuvir in the treatment of early hepatitis C virus infection in HIV-infected men. Open Forum Infect Dis. 2018;5(10):ofy238. [CrossRef]
- Naggie S, Fierer DS, Hughes MD, et al; Acquired Immunodeficiency Syndrome Clinical Trials Group (ACTG) A5327 Study Team. Ledipasvir/sofosbuvir for 8 weeks to treat acute hepatitis C virus infections in men with human immunodeficiency virus infections: sofosbuvir-containing regimens without interferon for treatment of acute HCV in HIV-1 infected individuals. Clin Infect Dis. 2019;69(3):514-22. [CrossRef]
- Matthews GV, Bhagani S, Van der Valk M, et al; REACT study group; Protocol Steering Committee; Coordinating Centre; Site Principal Investigators. Sofosbuvir/velpatasvir for 12 vs. 6 weeks for the treatment of recently acquired hepatitis C infection. J Hepatol. 2021;75(4):829-39. [CrossRef]
- Guo X, Zhong JY, Li JW. Hepatitis C virus infection and vaccine development. J Clin Exp Hepatol. 2018;8(2):195-204. [CrossRef]
- Lanford RE, Bigger C, Bassett S, Klimpel G. The chimpanzee model of hepatitis C virus infections. ILAR J. 2001;42(2):117-26. [CrossRef]
- Xu X, Chen H, Cao X, Ben K. Efficient infection of tree shrew (Tupaia belangeri) with hepatitis C virus grown in cell culture or from patient plasma. J Gen Virol. 2007;88(Pt 9):2504-12. [CrossRef]
- Amako Y, Tsukiyama-Kohara K, Katsume A, et al. Pathogenesis of hepatitis C virus infection in Tupaia belangeri. J Virol. 2010;84(1):303-11. [CrossRef]
- García F Jr, García F, Roldán C, et al. Detection of HCV and GBV-CHGV RNA in peripheral blood mononuclear cells of patients with chronic type C hepatitis. Microbios. 2000;103(404):7-15.
- Barnes E, Cooke GS, Lauer GM, Chung RT. Implementation of a controlled human infection model for evaluation of HCV vaccine candidates. Hepatology. 2023;77(5):1757-72. [CrossRef]
- Yi M, Villanueva RA, Thomas DL, Wakita T, Lemon SM. Production of infectious genotype 1a hepatitis C virus (Hutchinson strain) in cultured human hepatoma cells. Proc Natl Acad Sci U S A. 2006;103(7):2310-5. [CrossRef]
- Schillie S, Wester C, Osborne M, Wesolowski L, Ryerson AB. CDC Recommendations for hepatitis C screening among adults – United States, 2020. MMWR Recomm Rep. 2020;69(2):1-17. [CrossRef]
- Hughes HY, Henderson DK. Postexposure prophylaxis after hepatitis C occupational exposure in the interferon-free era. Curr Opin Infect Dis. 2016;29(4):373-80. [CrossRef]
- Hepatitis C [Internet]. Geneva: World Health Organization (WHO). [erişim 14 Haziran 2023]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
- Prevention of hepatitis B and C in the EU/EEA [Internet]. Stockholm: European Center for Disease Prevention and Control (ECDC). [erişim 14 Haziran 2023]. https://www.ecdc.europa.eu/en/publications-data/prevention-hepatitis-b-and-c-eueea
- Rockstroh JK, Boesecke C. Hepatitis C virus treatment as prevention: challenges and opportunities in men who have sex with men. J Infect Dis. 2020;222(Suppl 9):782-8. [CrossRef]
- Lafferty L, Rance J, Dore GJ, Grebely J, Lloyd AR, Treloar C; SToP-C Study Group. Hepatitis C treatment as prevention in the prison setting: Assessments of acceptability of treatment scale up efforts by prison correctional and health personnel. Int J Drug Policy. 2021;98:103379. [CrossRef]
- Leask JD, Dillon JF. Review article: treatment as prevention – targeting people who inject drugs as a pathway towards hepatitis C eradication. Aliment Pharmacol Ther. 2016;44(2):145-56. [CrossRef]
- Egro FM, Nwaiwu CA, Smith S, Harper JD, Spiess AM. Seroconversion rates among health care workers exposed to hepatitis C virus-contaminated body fluids: The University of Pittsburgh 13-year experience. Am J Infect Control. 2017;45(9):1001-5. [CrossRef]
- Başağa M, Ulu Kılıç A, Alp Meşe E. Sağlık personelinde aşılama ve temas sonrası profilaksi [Internet]. Kayseri: T.C. Erciyes Üniversitesi Sağlık Uygulama ve Araştırma Merkezi. [erişim 14 Haziran 2023]. https://hastaneler.erciyes.edu.tr/Files/infectioncontrol/b34fcb77-28cd-4ec7-82e1-6dc6f4374c9d.pdf
- Chilaka VN, Hassan R, Konje JC. Post-exposure prophylaxis for blood-borne viral (BBV) infections. Eur J Obstet Gynecol Reprod Biol. 2020;255:83-91. [CrossRef]
- Interpretation of hepatitis C virus test results: Guidance for laboratories [Internet]. Silver Spring, MD: Association of Public Health Laboratories [erişim 3 Ocak 2023]. https://www.aphl.org/aboutAPHL/publications/Documents/ID-2019Jan-HCV-Test-Result-Interpretation-Guide.pdf
- Fox RK, Corcorran MA. Diagnosis of acute HCV infection [Internet]. Washington: Hepatitis C online [erişim 03 Ocak 2023]. https://www.hepatitisc.uw.edu/go/screening-diagnosis/acute-diagnosis/core-concept/all
- Moorman AC, de Perio MA, Goldschmidt R, et al. Testing and clinical management of health care personnel potentially exposed to hepatitis C virus – CDC Guidance, United States, 2020. MMWR Recomm Rep. 2020;69(6):1-8. [CrossRef]
- HCV post-exposure prophylaxis for healthcare workers [Internet]. Bethesda: National Library of Medicine. [erişim 2 Ocak 2023]. https://clinicaltrials.gov/ct2/show/NCT03313414?id=NCT03313414&rank=1&load=cart
- Naggie S, Holland DP, Sulkowski MS, Thomas DL. Hepatitis C virus postexposure prophylaxis in the healthcare worker: why direct-acting antivirals don’t change a thing. Clin Infect Dis. 2017;64(1):92-9. [CrossRef]
- Gruener NH, Heeg M, Obermeier M, et al. Late appearance of hepatitis C virus RNA after needlestick injury: necessity for a more intensive follow-up. Infect Control Hosp Epidemiol. 2009;30(3):299-300. [CrossRef]