En Çok Okunanlar
Özet
Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Derneği Viral Hepatit Çalışma Grubu tarafından, ilki 2014 yılında yayımlanan kronik hepatit B (KHB) yönetimine ilişkin uzlaşı raporunun, infeksiyonun seyrinde yeniden oluşturulan evrelendirmeler, tedavi endikasyonlarındaki değişiklikler, tanı ve tedavi takibinde kullanılan yeni biyobelirteçler ve henüz günlük kullanıma girmese de tedavisindeki yeni gelişmeler nedeni ile güncellenme ihtiyacı doğmuştur. Bu nedenle güncel literatür ve uluslararası kanıta dayalı rehberler gözden geçirilerek yeni bir uzlaşı raporu hazırlanmıştır. Güncellenen uzlaşı raporumuzun, halen ülkemizde önemli bir sorun olan KHB için başvurulabilecek yararlı bir kaynak olacağını umuyoruz.
EPİDEMİYOLOJİ
Hepatit B virusu (HBV) infeksiyonu aşıyla önlenebilir olmasına rağmen, tüm dünyada önemli bir halk sağlığı sorunu olmaya devam etmektedir. Dünya Sağlık Örgütü (DSÖ), 2019 yılında kronik hepatit B (KHB) infeksiyonu ile yaşayan kişi sayısını 296 milyon, yeni olgu sayısını yılda 1.5 milyon ve HBV infeksiyonuna bağlı siroz ve hepatoselüler kanser (HSK) nedeniyle ölüm sayısını ise 820 milyon olarak bildirmiştir (1). Dünyada HBV yüzey antijen (HBsAg) pozitifliği prevalansı bölgelere göre değişiklik göstermekte birlikte ortalama %3.5 olarak tahmin edilmektedir; prevalansın en yüksek olduğu Afrika’da en yüksek oran %4.7 olarak bildirilmiştir. Hepatit B aşısının yeni doğanlarda yaygın kullanımı yeni gelişen KHB infeksiyonlarının insidansını önemli ölçüde azmıştır. Aşı öncesi dönem (1980- 2000 yılı başlarına kadar) ile 2015 yılları arasında kronik olarak infekte olan beş yaş altı çocukların oranı %4.7’den %1.3’e düşmüştür (2). Avrupa ülkelerinde göçmenler ve mültecilerin yerli nüfusa kıyasla daha yüksek olan HBsAg pozitiflik oranları nedeniyle, yaygınlık ve insidans oranları değişebilmektedir (3). Aşılama programları ve antiviral tedavinin etkisiyle endemik bazı ülkelerde prevalans azalmaktadır (4). Ülkeler arasındaki prevalans farkları; bulaşma yolları, infeksiyonun gelişme yaşı ve değişen risk faktörleri ile ilişkilidir.
Bulaşma Yolları
HBV’nin infekte kan ve vücut sıvılarıyla olan perkütan (parenteral) bulaşma, semen ve vaginal sekresyonlara bağlı cinsel bulaşma, infekte anneden yenidoğana bulaşma (vertikal) ve infekte kişilerle cinsellik içermeyen yakın temasa bağlı horizontal bulaşma olmak üzere dört ana bulaşma yolu vardır.
Yüksek prevalanslı bölgelerde perinatal bulaşma en sık görülen bulaşma yoludur (5). Anneden bebeğe bulaşmanın önlenmesi için doğum öncesi testlerin yapılması, hamilelik sırasında kişilerin takibi, gerekli durumlarda tedavi uygulanması, güvenli doğum, doğumdan sonra ilk 12 saatte yenidoğana aşı ve immün globulin uygulanması çok önemlidir. Dünya popülasyonunun %25.3’ünü doğurganlık çağındaki kadınların oluşturduğu düşünülürse, doğurganlık çağındaki 65 milyon kadın hastanın hastalığı bebeklerine bulaştırma potansiyeli bulunmaktadır (6).
Düşük prevalanslı bölgelerde ise erişkinlerde korunmasız cinsel ilişki ve damar içi ilaç kullanımı ana bulaşma yollarını oluşturur. Damar içi ilaç kullanımına ek olarak akupunktur, dövme, “piercing” için kullanılan ekipmanın HBV ile infekte kan ile kontaminasyonu sonucu olarak da bulaşmalar görülmektedir (7). Cinsel yolla bulaşma da bir diğer geçiş yoludur. Birden fazla seks partneri olan ya da seks işçileri ile seks yapan heteroseksüel kişiler bulaşma için risk oluşturur (8).
Genel olarak risk grupları; sık kan nakli yapılanlar, hemodiyaliz hastaları, sağlık personeli, uyuşturucu bağımlıları, dövme yaptıranlar, kulak deldirenler, KHB infeksiyonlu annelerin çocukları, seks işçileri, zihinsel engelliler, bakımevinde yaşayanlar, ailesinde KHB infeksiyonu ya da hepatiti olanlar ve mahkumlardır (9). Dünya Sağlık Örgütü (DSÖ) kan transfüzyonu için donörlerde HBsAg ve anti-HBc taranmasını önermektedir (10). Donörlere HBsAg ve anti-HBc taraması yapılması sayesinde kan transfüzyonu ile HBV bulaşması önemli ölçüde azalmıştır. Taramalara HBV DNA bakılmasının eklenmesi ise transfüzyon yoluyla HBV bulaşma riskini 1 milyonda 1’e indirmiştir (11). Nükleik asit testleri (NAT’lar) yüksek maliyet nedeniyle her ülkede kullanılamamaktadır. Ülkemizde ise kan donörlerinde havuzlanmış kanlarda NAT uygulanmaktadır.
Genotip Dağılımı
HBV’nin A’dan- J’ye kadar 10 genotipi bulunmaktadır. Genotipler coğrafi bölgelere göre fark göstermekte olup genotip A Vietnam’da, genotip B Tayvan’da, genotip C Çin, Japonya, Kore, Sahra altı Afrika, Kuzey Avrupa ve Batı Avrupa’da, genotip D Hindistan, Avrupa, Afrika ve Akdeniz ülkelerinde, genotip E Batı ve Güney Afrika’da, genotip F Orta ve Güney Amerika’da, genotip G Fransa, Almanya, Amerika Birleşik Devletleri’nde, genotip H Orta Amerika ve Meksika’da, genotip I Vietnam ve Laos’da, genotip J ise Japonya’nın Ryukyu Adaları’ nda saptanmıştır (12,13).
Genotip D, D1- D7 subgenotip çeşitliliği göstermekte olup dünya genelinde yaygın olmakla birlikte Türkiye’nin de içinde bulunduğu Akdeniz havzası, Yakın Doğu ve Orta Doğu ülkeleriyle Güney Asya’da daha sık görülmektedir (16). Ülkemizde dominant olan genotip D ve subtip ayw’dir (15). En yeni genotip olan genotip J, Japonya’nın Ryukyu Adaları’nda tanımlanmış ve bu genotipin gibon/orangutan genotipleri ve insan genotip C’siyle yakın ilişkili olduğu bildirilmiştir (16). HBV genotipleri; klinik seyre, interferon ve antiviral tedaviye yanıtı etkileyerek prognoza da etki edebilir. C ve D genotiplerinde tedaviye yanıt daha kötüdür. A1, C, F1, D genotiplerinin daha yüksek oranda siroz ve HSK riski taşıdığı bildirilmektedir. Genotip H’nin düşük düzey HBV DNA ve HBeAg düzeyi ile ilişkili olarak daha hafif karaciğer hastalığına neden olduğu düşünülmektedir. Subgenotip A1 ve D1 erken HBeAg serokonversiyonu ve düşük düzey HBV DNA ile ilişkilidir. Küresel göçlerdeki artış nedeniyle dolaşımdaki HBV suşlarının yakından izlenmesi, hastalığın seyri ve uygun tedavinin belirlenebilmesi açısından önemlidir (17).
Türkiye’de HBV İnfeksiyonu Epidemiyolojisi
Ülkemizde HBV infeksiyonu prevalansı değişik bölgelerde farklı hızlara sahiptir. Yıllara ve yaş gruplarına göre akut hepatit B (AHB) olgularında 1990-2017 yılları arasında azalma olmakla birlikte hastalık daha ileri yaş gruplarında da görülmeye başlanmıştır. Bu yıllar arasında tüm nüfusa bakıldığında AHB insidansı 100 000’de 4.6’dan 1.9’a gerilemiştir. Yaş gruplarına göre ise AHB insidansı 15 yaş altı grupta 100 000’de 5.9’dan 0.1’e ve beş yaş altı grupta 100 000’de 6.2’den 0.2’ye gerilemiştir (18). En yüksek AHB bildirimi yapılan yaş grubu 30-44 yaş grubu olup bunu 20-29 yaş grubu takip etmektedir; 45-64 yaş grubu ise üçüncü sıradadır. AHB olgularının bölgelere göre dağılımı incelendiğinde en fazla olgu bildirimi yapılan bölgenin Güney Doğu Anadolu Bölgesi olduğu dikkat çekmektedir.
Ülkemizde 2014 yılında erişkin yaş grubunda TURHEP çalışmasında KHB seroprevalansı %4, anti-HBs pozitifliği %31.9 ve anti-HBc pozitifliği %30.6 saptanmış olup anti-HBs pozitif olanların eş zamanda anti-HBc pozitiflik oranı ise %22 olarak bildirilmiştir. Bölgelere göre HBsAg pozitifliği prevalansı Marmara Bölgesi’nde %3.8, Ege Bölgesi’nde %2.3, Akdeniz Bölgesi’nde %3.1, Karadeniz Bölgesi’nde %6.1, Orta Anadolu Bölgesi’nde %4.3, Doğu Anadolu’da %3.4 iken Güneydoğu Anadolu’da %7.3 olarak bulunmuştur. Çalışmada; erkek cinsiyet, evli olma, düşük eğitim düzeyi, dental girişim öyküsü ve tek kullanımlık olmayan enjektör kullanım hikâyesi ve Güneydoğu Anadolu Bölgesi’nde yaşama, HBsAg pozitifliği ile ilişkili bağımsız risk faktörleri olarak tespit edilmiştir (19).
Türkiye Cumhuriyeti Sağlık Bakanlığı verilerine göre KHB insidansı 2002’de %8.26 iken 2010’da %4.2 olarak bildirilmiştir (20). Ülkemizde yapılan, farklı gruplar üzerindeki seroprevalans çalışmalarında, HBsAg pozitiflik oranları %0.8-5.7 arasında bulunmuştur (19-24). Sağlık çalışanlarını kapsayan çalışmalar, sağlık çalışanlarındaki HBsAg pozitifliğinin normal popülasyondan çok farklı olmadığını göstermektedir (25,26). Hepatit B aşısı 1998’de çocukluk çağı aşı takvimine girmiş ve o tarihten itibaren üç doz olarak uygulanmaya başlamıştır. 2005-2009 yılları arasında ilk ve ortaöğretime devam eden çocuklara yönelik yakalama aşılamaları ile genç nüfusta AHB insidansında azalma sağlanmıştır. Aşılama hızının yüksek olması yeni gelişen KHB infeksiyonlarını önemli ölçüde azaltmıştır. Beş yaş altı grupta KHB infeksiyonu insidansı 100 000’de 1’in altına düşmüştür (18). Türkiye’de KHB infeksiyonunun yaşa ve bölgeye özgü prevalansını belirlemeye yönelik 2011’de yapılmış olan çalışmada; tahmini genel prevalans %4.57 ve tahmini toplam KHB olgu sayısı 3.3 milyon olarak bildirilmektedir. Yaş gruplarına bakıldığında; HBsAg pozitiflik prevalansının 0-14 yaş grubunda %2.84 ve 25-34 yaş grubunda ise %6.36 arasında değişmekte olduğu bildirilmiştir. Bölgelere bakıldığında; Ege ve Marmara Bölgesi’nde %3.4, İç Anadolu, Akdeniz ve Karadeniz Bölgesi’nde %4.8, Doğu ve Güneydoğu Anadolu Bölgesi’nde %6.2 oranında pozitiflik bildirilmiştir (22). Aynı çalışmada yaş gruplarına göre HBsAg pozitiflik prevalansı Marmara ve Ege Bölgesi’nde 25-34 yaş, Karadeniz, İç Anadolu ve Akdeniz Bölgesi’nde 35-44 yaş, Güneydoğu ve Doğu Anadolu Bölgesi’nde ise 15-24 yaş aralıklarında en yüksek oranda saptanmıştır. Bakanlığın verilerine göre 2012-2016 yılları arasında gerçekleştirilen karaciğer transplantasyonlarının yaklaşık yarısının (%40-50) HBV infeksiyonuna bağlı akut-kronik karaciğer yetmezliği ve HSK nedeniyle yapıldığı bildirilmektedir (18).
Dünyada HBV İnfeksiyonu Epidemiyolojisi
HBsAg pozitiflik oranları ülkelere göre farklı oranlarda bildirilmektedir. Erişkinlerde KHB infeksiyonu prevalansı; Amerika’da %0.4-1.6, Avrupa’da %1.2-2.6, Güneydoğu Asya’da %1.5-4.0, Doğu Akdeniz’de %2.6-4.3, Batı Pasifik’te %5.1-7.6, Afrika’da ise %4.6-8.5 arasında değişmektedir (2, 26-28). Afrika ve Pasifik Bölgesi prevalansın en yüksek olduğu bölgelerdir. Dünya Sağlık Örgütü verilerine göre dünya genelinde beş yaşından küçük çocuklarda KHB prevalansı %1’den düşüktür (1). Bu yaş grubunda prevalansın düşük olmasının yaygın aşılama programının etkinliğinin bir sonucu olduğu düşünülebilir.
Dünya Sağlık Örgütü, Mayıs 2016’da Viral Hepatitler Küresel Sağlık Sektörü Stratejisi 2016-2021’i uygulamaya koymuştur. Buna göre; 2030 yılı itibariyle viral hepatitlerin halk sağlığını tehdit eden bir risk olmaktan çıkarılması, yeni infeksiyon riskinin %90 oranında azalması, tedavi olabilecek hepatit hastalarının %80 oranında azalması ve hepatite bağlı mortalite oranının da %65 azaltılması öngörülmektedir (2,18). Ancak COVID-19 pandemisi eliminasyon programını olumsuz yönde etkilemiştir.
Dünya Sağlık Örgütü, 75. Dünya Sağlık Asamblesi Toplantısı’nda 2022-2030 dönemi için HIV, HBV ve HCV infeksiyonlarının birlikte değerlendirildiği yol haritalarını içeren bir strateji planı kapsamında yeni hedefler belirlemiştir. Söz konusu plan kapsamında; hepatit B tanısı alan/tedavi edilenlerin oranı 2020 yılında %30/%30 iken, 2023 yılında bu oranın %80/%80 olması, yeni gelişen hepatit B infeksiyonu sayısının ise 4.5 milyondan 170 bine indirilmesi, hepatit B’ye bağlı ölümlerin de 820 binden 310 bine indirilmesi hedeflenmektedir (2,28). Plana göre hepatit B ile ilgili faaliyet adımları aşağıda verilmiştir;
- Viral hepatitlerin önemi hakkında daha fazla farkındalık yaratmak,
- Finansal kaynaklardan, viral hepatit tanı ve tedavisinde kullanılmak üzere daha fazla pay ayrılmasını sağlamak,
- Çocuğa bulaşmanın önlenmesi için gebelere test yapılması ve özellikle yeni doğanda hepatit B aşısına erişimin artırılması,
- Tanı ve tedaviye erişim için birinci basamak sağlık hizmetlerini de içine alan modellemeler yapılması,
- Risk altındaki gruplara ulaşmak için sivil toplum örgütleri ile birlikte çalışılması.
Öneriler
- HBV infeksiyonu dünyada ve ülkemizde güncelliğini ve önemini yitirmeyen infeksiyon hastalıkları arasında yer almaktadır.
- Aşılama programları ve antiviral tedavinin etkisiyle yüksek oranda endemik olan bazı ülkelerde prevalans azalmaktadır.
- HBV infeksiyonuna karşı %98-100 oranında koruma sağlayan etkin aşılama programlarının uygulanmasıyla birçok ülkede yeni HBV infeksiyonu insidansında azalma görülmektedir.
- Ülkemizde özellikle genç yaştaki kişilerde farkındalığın artırılması önemlidir.
- Bulaşma ve korunma yolları ile ilgili eğitimlerin verilmesi, aşılamanın yaygınlaştırılması, sağlık çalışanları tarafından evrensel önlemlere titizlikle uyulması, evlilik öncesi tarama testleri ve gebelikte HBsAg pozitif saptanan anne ve bebeklerin takiplerinin yapılması önem taşımaktadır.
- Dünya genelindeki HBsAg prevalansında düşüş saptanması için; HBV aşılama programlarının düzenli uygulanması, kan ürünlerinin taranması, sağlık çalışanlarının tarama ve temas sonrası profilaksilerinin yapılması ve güvenli enjeksiyon uygulamalarının düzenli ve sürekli yapılması gereklidir.
DOĞAL SEYİR
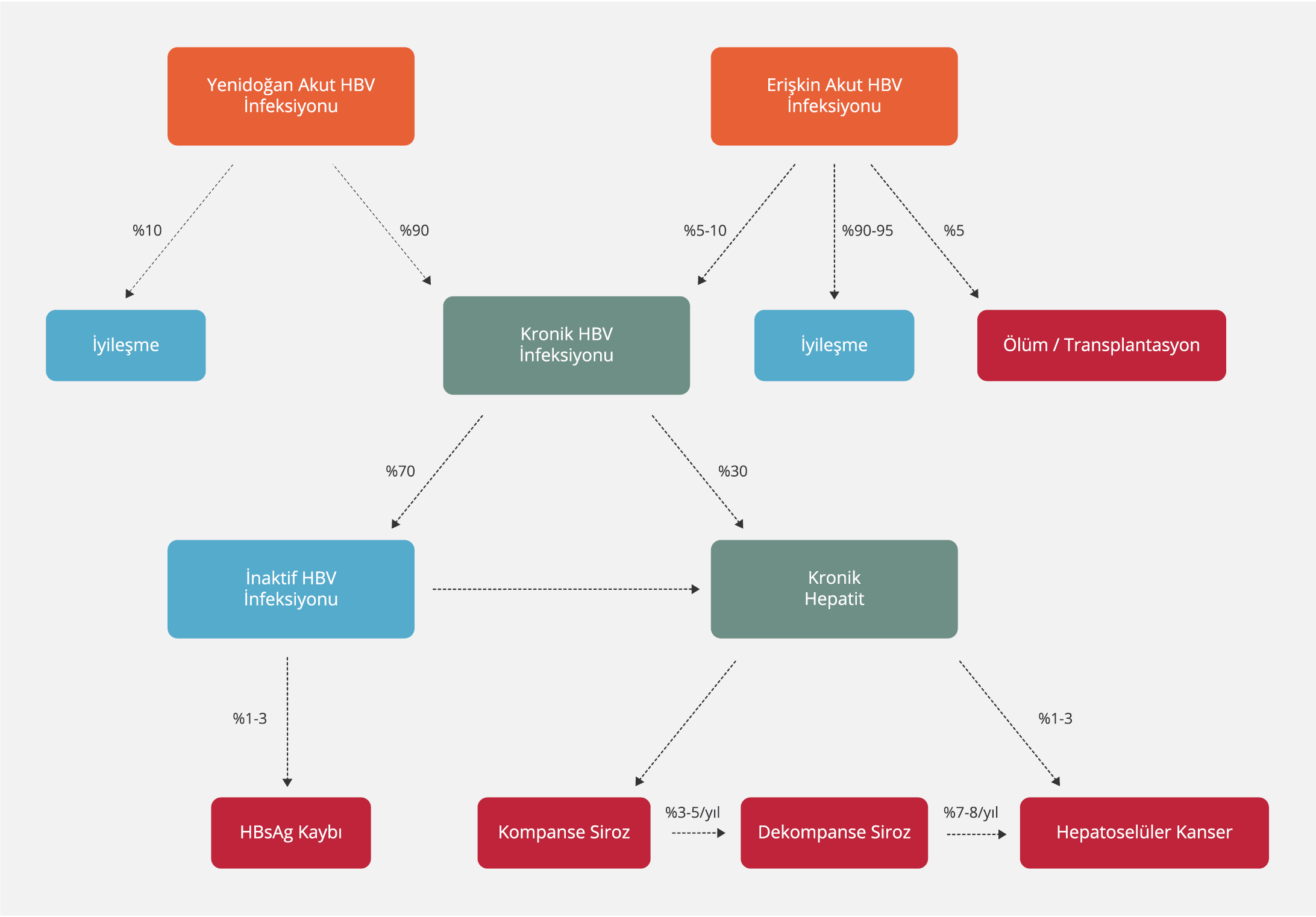
HBV infeksiyonunun doğal seyri akut infeksiyondan kronik infeksiyona, siroza ve karaciğer kanserine kadar değişebilen geniş bir yelpazeyi içermektedir (Şekil 1). HBV infeksiyonunda doğal seyri belirleyen faktörler arasında virusa ait özellikler, immün sistemin aktivitesi ve virusa karşı gelişen immün yanıtın şiddeti sayılabilir. İnfeksiyonun klinik seyri net bir şekilde tanımlansa da patogenezine yönelik araştırmalar devam etmektedir. Akut infeksiyon varlığında iyileşme oranı hastalığın edinildiği yaşa göre değişkenlik gösterirken, kronik infeksiyon varlığında ise hastalık farklı klinik fazlarda görülebilmektedir (29-31).
Akut Hepatit B
AHB, HBV ile temas sonrası yaklaşık 1-6 aylık inkübasyon süresini takiben gelişen, asemptomatik infeksiyondan fülminan hepatite kadar değişen farklı klinik tablolar ile seyreden bir infeksiyon hastalığıdır (32). İnkübasyon süresi, inoküle olan virus miktarına, bulaşma yoluna ve konak faktörlerine göre değişiklik gösterir. İnkübasyon döneminde hepatosit içine girerek çoğalmaya başlayan HBV birçok antijenik madde üretir ve hızla yayılarak hepatositlerin çoğunda replike olmaya devam eder. HBV, sitopatik bir virus değildir. AHB infeksiyonu sırasında izlenen karaciğer hasarı çoğunlukla aktif viral replikasyonun indüklediği konak immün yanıtına bağlı olarak gelişir. Viral replikasyon ve konak savunma mekanizmaları arasındaki etkileşim, viral infeksiyonun seyrini belirler. İnfeksiyon sırasında hücresel ve hümoral immün yanıt önemli rol oynar. Hastalık seyri sırasında ortaya çıkan ekstrahepatik bulgular antijen-antikor komplekslerine bağlı olarak oluşur (33,34).
Sağlıklı kişilerde hepatosite giren HBV’nin immün sisteme tanıtılmasıyla oluşan ilk immün yanıt doğal immün yanıttır. Doğal immün yanıt, hepatosit hasarına neden olmaz; patojenin yayılmasını önlemede ve etkili bir adaptif immün yanıtın oluşturulmasında önemlidir. İnkübasyonun ilerleyen döneminde adaptif immün yanıt başlar. İnterferon gamma (INF-γ) ve tümör nekrozis faktör alfa (TNF-α) gibi inflamatuar sitokinler virusun klirensinde etkili iken sitotoksik T lenfositler, hem viral klirensten hem de karaciğer hasarından sorumlu olan başlıca hücrelerdir. Hepatositlerin CD8+T lenfositler tarafından parçalanması ile alanin aminotransferaz (ALT) düzeyi yükselir. Virusa karşı oluşan immün yanıta bağlı olarak farklı seyirler izlenir. Vücudun verdiği immün yanıt yeterli ise viral klirens sağlanır ve doğal bağışıklık gelişir. Ancak vücudun verdiği immün yanıt yetersiz kalırsa viral klirens sağlanamaz ve kronikleşme görülür (35,36). Karaciğerde nekroz, rejenerasyon fibrozun uyarılması ile kronik hepatit gelişir ve siroz, HSK gibi komplikasyonlara neden olabilir. Diğer taraftan immün yanıt şiddetli ve kontrolsüz olursa infeksiyon, fülminan hepatit ve karaciğer yetmezliğine kadar ilerleyebilir. AHB infeksiyonu sırasında oluşan immün yanıt, infeksiyonun seyrine ve edinildiği yaşa bağlı değişmektedir (37,38).
AHB infeksiyonu geçiren kişilerde kronikleşme, erişkin dönemde %5-10 oranında görülürken, yenidoğan döneminde %90 oranında, çocukluk döneminde ise %20-50 oranında görülmektedir. Akut infeksiyonda, inkübasyon sonrası saptanmaya başlanan ilk gösterge HBsAg’dir. AHB infeksiyonu olan bir hastada beklenen iyileşme süresi altı aydan kısadır. İyileşme durumunda HBsAg negatifleşir, ardından anti-HBs pozitifleşir ve ömür boyu bağışıklık kazanılır. Altı aydan uzun süredir HBsAg varlığı, kronik infeksiyonun varlığını gösterir. İnfeksiyonun kronikleşmesinin nedenleri arasında; INF-γ eksikliği, antijen sunumunda yetersizlik, HBV spesifik CD8+ T lenfositlerin dokuda ya da kanda az sayıda bulunmaları ve CD4+T lenfositlerin aktivasyon bozukluğunun olduğu bildirilmiştir (34,39).
Kronik Hepatit B
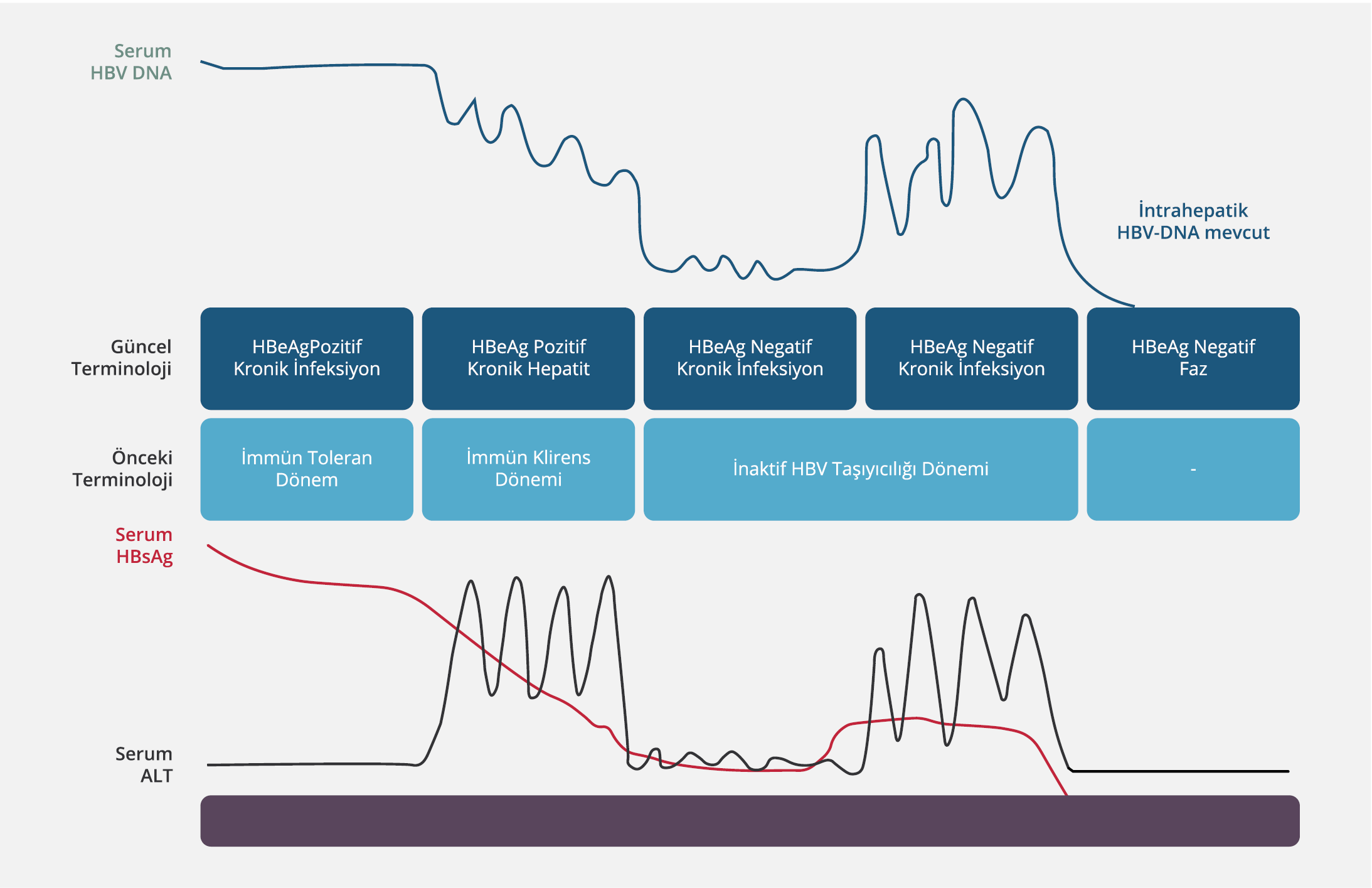
Şekil 2. KHB İnfeksiyonu Fazlarında Serum HBV DNA, HBsAg ve ALT Düzeylerinin Seyri (Kaynak 12’den uyarlanmıştır).
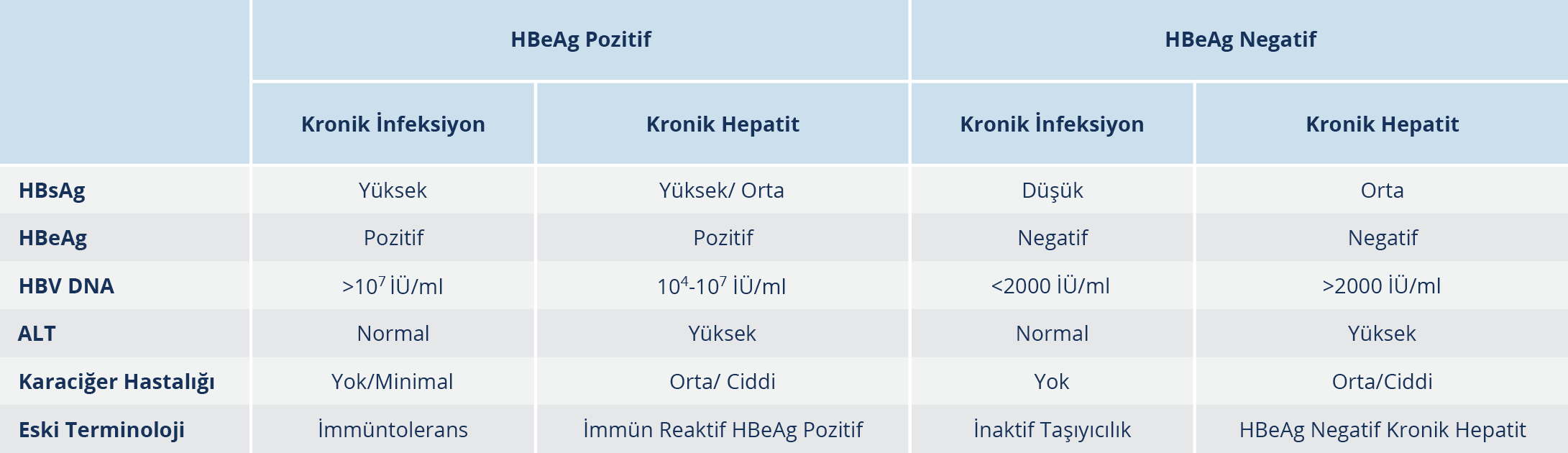
KHB infeksiyonu, HBV replikasyonu ile konak immün yanıtı arasındaki dinamik bir süreçtir. Hastalığın seyrini belirleyen birçok faktör vardır. Bunlar arasında infeksiyonun yaşı, viral faktörler (HBV genotipi, viral mutasyon varlığı, HBV replikasyon düzeyi), konak faktörleri (yaş, cinsiyet, immün sistemin aktivitesi) ve diğer faktörler (başka hepatotropik virus infeksiyonu varlığı, alkol kullanımı) sayılabilir (40). KHB infeksiyonunun doğal seyri, Avrupa Karaciğer Araştırmaları Derneği (EASL)’nin 2017 yılında yayımlamış olduğu rehbere göre güncellenerek yeni bir terminoloji ile beş faza ayrılmıştır (Şekil 2).
Yenilenen terminolojiye göre düzenlenen fazlarda viral göstergelerin düzeyleri değişiklikler gösterir (Tablo 1). Ancak AHB infeksiyonunun fazları sıralı bir seyir izlemek zorunda değildir. Bununla birlikte KHB infeksiyonu olan kişilerin izleminde HBeAg varlığı ile HBV DNA ve ALT düzeylerinin takip edilmesi gerekir. Bazı durumlarda ayrıntılı bir değerlendirmeden sonra bile KHB infeksiyonu olan kişiler net olarak sınıflandırılamayabilir. Bu durumda izlem ve tedavi yaklaşımının kişiselleştirilmesi gerekir (41).
Faz 1 (HBeAg pozitif KHB infeksiyonu)
Eski sınıflamaya göre immün tolerans dönem olarak adlandırılan bu faz genellikle infeksiyonun doğumda ya da erken çocukluk çağında alınması sonucunda görülürken nadiren geç çocukluk veya erişkin dönemde de karşımıza çıkabilir (29). Bu faz, serumda HBeAg varlığı, çok yüksek HBV DNA düzeyleri ve sürekli normal ALT düzeyleri ile karakterizedir. İmmün yanıtın yetersizliği sonucu görülen bu dönemde karaciğer histolojisinde nekroinflamasyon ya da fibroz gibi bulgular hiç yoktur veya minimaldir. Bulaşıcılığın yüksek olduğu bu faz; infeksiyonun çocukluk çağı gibi daha erken alındığı olgularda 10-40 yıl gibi uzun sürebilirken, infeksiyonun erişkin dönem gibi daha geç alındığı olgularda ise ya hiç yoktur ya da 1-4 ay gibi kısa bir dönem sürer. Bu fazın sürecinde görülen değişiklikler birçok faktörle ilişkili olabilir. Bu faktörler arasında; infeksiyonun yaşı (genç>yaşlı), infeksiyonun geçiş şekli (vertikal>horizontal), bağışıklık durumu (süprese>kompetan), etnik köken (Asya kökenli>Asya kökenli olmayanlar), HBV genotipi (C>B, D>A), başlangıç biyokimyasal ve histolojik aktivite düzeyleri (yüksek>düşük) ve takiplerde ALT düzeyinde izlenen alevlenme (var>yok) sayılabilir. Bu fazda spontan HBeAg kaybı çok düşüktür (<%5/yıl) (42). Hastalar asemptomatiktir ve genellikle tesadüfen tanı alır. Genel olarak iyi seyirli olduğu için tedavi önerilmemekle birlikte hastalar takibe alınmalıdır (43).
Faz 2 (HBeAg pozitif KHB)
Bu faz immün reaktif, immün aktif, immün klirens ve HBeAg klirens fazı olarak da adlandırılmaktadır. İmmün sistem aktivitesinin başladığı bu dönemde HBV antijenlerine karşı oluşan immün yanıt sonucu hepatoselüler hasar görülmeye başlar (44). Bunun sonucu olarak; serum HBeAg pozitifliği, yüksek veya dalgalı HBV DNA düzeyleri ve ALT düzeyinde kalıcı veya aralıklı yükselme izlenir. Karaciğer histolojisinde orta veya ciddi düzeyde nekroinflamasyon ve hızlı ilerleyen fibroz saptanır. İlk fazdan birkaç yıl sonra oluşabilir. Ancak daha çok erişkin dönemde infekte olan kişilerde görülen bu faz hızlı gelişebilir. Hastalık seyrine göre değişkenlik göstermekle birlikte bu fazın sonunda hastaların çoğunda HBeAg serokonversiyonu, HBV DNA baskılanması gelişerek HBeAg negatif kronik infeksiyon fazına ilerleme görülür. Ancak bazı hastalar HBV replikasyonu kontrol edilemediği için uzun yıllar boyunca HBeAg negatif kronik hepatit B fazında kalabilir (41). Genel olarak hastalar bu dönemde sıklıkla asemptomatik seyreder. Bazı hastalarda akut hepatite benzeyen ve hepatik dekompansasyonla sonuçlanabilen alevlenme atakları izlenebilir. Alevlenme ataklarında HBeAg serokonversiyonu olmayabilir ancak alevlenmeler karaciğer hasarının ilerlemesine ve fibroza neden olabilir (45). Bu fazda yıllık spontan HBeAg klirensi %3-12 arasında bildirilmektedir. Spontan HBeAg serokonversiyonu ile ilişkili faktörler; ileri yaş, yüksek aminotransferaz düzeyleri ve HBV genotipleri (A, B, D, F, B>C) olarak sayılabilir (46,47).
Faz 3 (HBeAg negatif KHB infeksiyonu)
Eski sınıflamaya göre inaktif HBV taşıyıcılığı dönemi olarak adlandırılan bu fazda; HBeAg kaybı, anti-HBe varlığı, düşük (<2000 İÜ/ml) veya saptanamayan HBV DNA düzeyleri ve normal ALT düzeyleri izlenir. Ancak bazı hastalarda HBV DNA düzeyleri 2000-20 000 İÜ/ml arasında olup normal ALT düzeyleri ile birlikte minimal hepatik nekroinflamatuar aktivite ve düşük fibroz görülebilir. Bu fazdaki hastalar siroz ve HSK açısından her ne kadar düşük riskli olarak kabul edilseler bile eğer bir sonraki faza ilerlerlerse yani HBeAg negatif kronik hepatit B’ye progrese olurlarsa risk artar. Bu hastalar, tipik olarak düşük serum HBsAg düzeylerine (<1000 İÜ/ml) sahiptir. Bu fazda spontan HBsAg kaybı ve/veya serokonversiyonu her yıl olguların %1-3’ünde saptanabilir (41).
Faz 4 (HBeAg negatif KHB)
Genellikle serum HBeAg negatifliği, anti-HBe pozitifliği, orta-yüksek düzeyde HBV DNA düzeyleri ve sürekli ya da dalgalı yüksek ALT düzeylerinin izlendiği fazdır. HBV DNA düzeyleri, genellikle HBeAg pozitif hastaların HBV DNA düzeylerinden daha düşük olup sürekli veya dalgalı bir düzey izler. Karaciğer histolojisi açısından değerlendirildiğinde nekroinflamasyon ve fibroz mevcuttur. Hastalığın seyri açısından bakıldığında; hastaların çoğunluğu faz 3 yani HBeAg negatif KHB infeksiyonundan sonra bu faza geçerken, bazı hastaların ise doğrudan faz 2 yani HBeAg pozitif kronik hepatit infeksiyonundan faz 4’e ilerleme olasılığı vardır (42). Bu fazdaki hastaların daha yaşlı oldukları ve daha ileri karaciğer hastalığına sahip oldukları görülmektedir; yüksek serum HBV DNA düzeyleri izlenir. Bu durum viral genomun prekor veya bazal kor promoter bölgesinde izlenen spontan bir mutasyonla ilişkilidir. Prekor mutasyonu, HBV genomunun bir bölgesinde HBeAg oluşumunu engelleyen stop kodonu üretir. Bazal kor promoter bölgedeki mutasyon ise HBeAg transkripsiyonunu etkiler. Bu mutasyonlar tek başına veya birlikte izlenebilir. Bunların sonucunda HBeAg üretilemez veya minimal olarak üretilir ancak viral replikasyon devam eder. Spontan hastalık remisyon oranı bu fazda düşüktür (41).
Faz 5 (HBsAg negatif faz)
Bu faz anti-HBs saptanabilir düzeyde olsun veya olmasın HBsAg negatifliği ve anti-HBc pozitifliği ile karakterizedir. Okült HBV infeksiyonu olarak da adlandırılmaktadır. KHB infeksiyonu varlığında spontan HBsAg kaybı oranı yılda %0.5-1 olarak bildirilmektedir. Yıllık HBsAg kaybı oranı dünyanın farklı bölgelerinde farklı oranlarda görülür. Genel olarak Batı toplumunda bu oran Doğu ve Asya toplumlarından daha yüksektir; bu durumun, Doğu toplumlarında infeksiyonun daha erken yaşta edinilmesinden ve genotipik farklılıklardan kaynaklandığı bildirilmektedir (34,45). Bu fazdaki hastalar normal ALT değerlerine ve genellikle saptanma sınırının altında olan düşük serum HBV DNA düzeyine sahiptir. Ancak bazen daha yüksek HBV DNA düzeyine sahip olabilecekleri de unutulmamalıdır. Sıklıkla karaciğerde hepatositlerde HBV DNA (“covalently closed circular DNA” – cccDNA) saptanabilir. Hastalığın seyri sırasında siroz gelişiminden önce HBsAg kaybı gelişirse siroz, hepatik dekompansasyon ve HSK gelişme riski düşüktür. Ancak siroz gelişimi sonrasında HBsAg kaybı saptanırsa HSK gelişme riski mevcut olduğu için hastaların takibi devam etmelidir. Diğer taraftan bu hastalarda immünosüpresyon varlığının da HBV reaktivasyonuna neden olabileceği unutulmamalıdır (41).
HBV infeksiyonunun doğal seyrini etkileyen birçok faktör mevcuttur ve bunların bazıları hastalığı olumlu yönde etkiler. Bunlara örnek olarak; infeksiyonun ileri yaşta edinilmesi, faz 2’nin (HBeAg pozitif kronik hepatit B – eski tanımlamaya göre immün klirens fazı) olmaması ya da kısa sürmesi, virusun genotipi, HBV-DNA’nın düşük düzeyde seyretmesi, HBeAg serokonversiyonunun erken olması, karaciğer histolojisinin iyi olması, eşlik eden metabolik bir hastalığın (diyabet, obezite vb.) olmaması, HIV, HCV, HDV ile koinfeksiyon olmaması ve alkol kullanımının olmaması verilebilir (48-51).
HBV infeksiyonunun doğal seyrinde komplikasyonların ortaya çıkışı oldukça değişken olup siroz ve HSK’ye progresyon riski konağın immün yanıtından etkilenir. Tedavi edilmeyen KHB infeksiyonu olan kişilerin beş yıllık kümülatif siroz insidansı %8-20, siroz tanısı olan kişilerin beş yıllık kümülatif hepatik dekompansasyon riski %20 ve siroz tanısı olan kişilerde yıllık HSK riski %2-5 olarak bildirilmektedir (41,52). Diğer taraftan KHB infeksiyonu olan kişilerde HSK gelişimi etkin şekilde tedavi edilen hastalarda bile görülebilmektedir. Siroz varlığı, ileri yaşta olmak, erkek cinsiyet, Afrika kökenli olmak, alkol ve sigara kullanımı, kronik karaciğer nekroinflamasyonu varlığı, HIV, HCV, HDV ile koinfeksiyon varlığı, eşlik eden metabolik hastalık varlığı, pozitif aile öyküsü varlığı gibi konak ile ilgili faktörler ve yüksek HBV DNA ve/veya HBsAg titreleri, HBV genotipi (C>B), spesifik mutasyonlar gibi viral faktörlerden bir veya daha fazla risk faktörünün varlığı durumunda kişilerde HSK gelişme riski daha yüksektir (53). Bu nedenle HBV infeksiyonunun doğal seyrinin bilinmesi ve kişilerin uygun takibinin yapılması önem taşır.
Öneriler
- AHB infeksiyonunda, inkübasyon sonrası saptanmaya başlanan ilk gösterge HBsAg’dir ve beklenen iyileşme süresi altı aydan kısadır. Altı aydan uzun süredir HBsAg varlığı, kronik infeksiyonun varlığını gösterir.
- Avrupa Karaciğer Araştırmaları Derneği’nin 2017 yılında yayımladığı kılavuzda KHB infeksiyonu, güncellenen terminolojiye göre beş faza ayrılmıştır. KHB infeksiyonunun fazları sıralı bir seyir izlemek zorunda değildir. KHB infeksiyonu olan kişilerin izleminde HBeAg varlığı ile HBV DNA ve ALT düzeylerinin takip edilmesi gerekir.
- Faz 1 (HBeAg pozitif KHB infeksiyonu) genel olarak iyi seyirli olduğu için tedavi önerilmez; hastalar takibe alınmalıdır.
- Faz 5 (HBsAg negatif faz) anti-HBs saptanabilir düzeyde olsun veya olmasın HBsAg negatifliği ve anti-HBc pozitifliği ile karakterizedir. Bu faz aynı zamanda okült HBV infeksiyonu olarak da adlandırılmaktadır.
- KHB infeksiyonu olan kişilerde hastalığın seyri sırasında siroz gelişiminden önce HBsAg kaybı gelişirse; siroz, hepatik dekompansasyon ve HSK gelişme riski düşüktür. Ancak siroz gelişimi sonrasında HBsAg kaybı saptanırsa; bu hastalarda HSK gelişme riski mevcut olduğu için kişilerin HSK açısından takibi devam etmelidir.
- KHB infeksiyonu olan kişilerde immünosüpresyon varlığında HBV reaktivasyonu görülebileceği unutulmamalıdır.
AKUT HEPATİT B VE KRONİK HEPATİT B TANISI
Günümüzde kullandığımız testlerle; HBV infeksiyonu tanısı, hastalığın evresi, virusun infektivite derecesi, hastalığın prognozu, tedaviye yanıtı ve HBV’ye karşı bağışıklık durumu hakkında bilgi alınabilmektedir. Ancak doğru tanı ve tedavi takibi için virus replikasyonunu gösteren daha hassas ve hızlı testlerin yanı sıra spesifik varyantları, intrahepatik HBV replikasyon seviyesini ve virus rezervuarlarını gösteren testlere de ihtiyaç vardır (54).
HBV infeksiyonu tanısında ve takibinde biyokimyasal, serolojik ve moleküler testler kullanılmaktadır. Hepatit B infeksiyonunun kesin tanısı ve hastalığın evrelemesinde karaciğer biyopsisi ile yapılacak histopatolojik değerlendirme yol göstericidir. Radyolojik olarak karaciğer ultrasonografisi yaygın olarak kullanılmaktadır. Karaciğer sertliğini ölçen “transient” elastografi ve manyetik rezonans elastografi gibi yöntemler karaciğer fibrozunu değerlendirmede en duyarlı invazif olmayan radyolojik testlerdir. Karaciğerde fibroz ve nekroinflamasyonu değerlendiren direkt ve indirekt serum belirteçleri (FibroTest, APRI, FIB-4, vb.) de kullanılmaktadır. Karaciğer fibrozunun derecesini belirlemede en etkili yaklaşım “transient” elastografi ile serum belirteçlerinin birlikte değerlendirilmesidir (55,56).
Biyokimyasal Testler
Biyokimyasal testler olarak; ALT, aspartat aminotransferaz (AST), alkalen fosfataz (ALP), gamma-glutamil transpeptidaz (GGT), izositrat dehidrogenaz (ICD), laktat dehidrogenaz (LDH), bilirubin, albümin ve protrombin zamanı (PT) kullanılmaktadır. Aminotransferazlar, LDH, glutamat dehidrogenaz ve ICD hepatosit hasarını gösteren testlerdir (57).
ALT ve AST’nin normal serum düzeyleri 30-40 İÜ/lt’den azdır. Amerikan Karaciğer Hastalıkları Araştırma Derneği (AASLD)’nin 2018 yılı rehberinde ALT için sınır değerler erkeklerde 35 İÜ/lt ve kadınlarda 25 İÜ/lt’ye indirilmiştir (58). ALT esasen karaciğer hücrelerinde ve sitoselde bulunur; karaciğer hücre hasarında doğal olarak seruma salınır ve düzey artar. AST, ALT’den farklı olarak sadece karaciğerde değil kalp, iskelet kası, böbrek, beyin, pankreas, dalak, akciğer gibi organlarda da bulunur. ALT, AST’ye göre karaciğer hastalığının daha özgül bir göstergesidir. Serum ALT düzeyinin artması karaciğerdeki nekroinflamatuar aktivitenin bir göstergesi olmakla birlikte ALT düzeylerinin normal olması nekroinflamasyon veya fibrozun olmadığı anlamına gelmez (42). Karaciğer hücre hasarının büyüklüğü ile serum aminotransferazların artışı çoğunlukla korelasyon göstermez ve prognozla ilişkili değildir. Ancak akut karaciğer yetmezliği olan hastalarda, plazma bilirubin konsantrasyonunda artış ve protrombin zamanında uzama ile beraber AST ve ALT düzeylerinde hızlı düşüş saptanması kötü prognozu göstermektedir. Serum transaminazlarının hızlı düşüşü genellikle hastalığın iyileşmesini gösterse de aynı durum akut karaciğer yetmezliği olan hastalarda hepotositlerin yoğun yıkımını da gösterir (57). Glutamat dehidrogenaz, LDH ve ICD karaciğer hasarını göstermede transaminazlar kadar duyarlı değildir ve tanısal özgüllükleri de düşüktür.
ALP, 5’-nükleotidaz ve GGT kolestazı gösteren enzimlerdir. ALP sadece karaciğere spesifik bir enzim değildir; hepatositlerin kanaliküler membranı dışında kemikteki osteoblastların zarında, ince barsak mukoza hücrelerinde, böbrekte, plasenta ve beyaz kan hücrelerinde bulunur. ALP ve 5’-nükleotidaz safrada tıkanıklığın veya karaciğerdeki infiltratif veya yer kaplayan lezyonların gösterilmesinde değerlidir. Albümin, koagülasyon faktörleri, PT, “international normalized ratio” (INR) karaciğerin biyosentez kapasitesini gösteren testlerdir (42,57).
Serolojik Testler
HBV infeksiyonunun tanısında, serolojik testlerle; hepatit B yüzey antijeni (HBsAg), hepatit B kor antijen (HBcAg), anti-HBc IgM ve anti-HBc IgG, anti-HBs, hepatit B zarf antijeni (HBeAg) ve anti-HBe araştırılır.
HBsAg
Zarf geninin kodladığı yüzey antijenidir; kişinin HBV ile infekte olduğunu gösterir. Virusla temastan 3-9 hafta sonra yükselir. ALT düzeyinin yükselmesinden 1-3 hafta ve semptomlardan 3-5 hafta önce serumda saptanır. HBsAg düzeyi akut dönemde pik yapar ve 4-6 ayda saptanamaz düzeye iner. Altı aydan uzun süre ile serumda pozitif kalması kronikleşmeyi gösterir (55).
Anti-HBs
HBV’ye karşı bağışıklığı gösteren antikordur. Doğal infeksiyon ya da aşılama sonrası ortaya çıkar. Akut infeksiyon sırasında HBsAg’nin negatifleşmesinden bir süre sonra görülür. Aşılama sonrası 4-8 haftanın ardından anti-HBs kontrolü önerilir; elde edilen ≥10 İÜ/lt antikor düzeyi infeksiyondan korunmada yeterlidir.
HBcAg
HBcAg kor geninin kodladığı virus kapsidini oluşturan kuvvetli bir immünojen proteindir. Asıl olarak karaciğerde bulunur; serumda serbest halde bulunmaz. Anti-HBc yanıtını T hücre yardımı olmadan da uyarabilmektedir.
Anti-HBc
HBV ile karşılaşmayı gösterir. İnfeksiyonun tüm dönemlerinde pozitiftir. Geçirilmiş HBV infeksiyonunda anti-HBe ve anti-HBs negatifleşse bile serumda ömür boyu saptanır. Koruyucu antikor değildir. Çoğu serolojik yöntem ile izole anti-HBc IgG tespit edilemez ve anti-HBc total şeklinde ölçüm yapılır.
Anti-HBc IgM
HBV ile infeksiyonda ilk oluşan antikordur. Akut HBV de HBsAg kaybolup anti-HBs oluşmadan önce “pencere döneminde” infeksiyonun tek göstergesidir. Akut infeksiyon tanısı koydurur. ALT yüksekliği ile eş zamanlı ortaya çıkar. 3-6 ay süre serumda pozitif kalır. Yerini daima anti-HBc IgG’ye bırakır. Akut infeksiyonda serumda yüksek titrede pozitif saptanır. Kronik hepatit B’nin reaktivasyon ya da akut alevlenmesinde düşük titrede pozitiflik saptanabilir.
HBeAg
Prekor bölgesinin kodladığı aksesuar bir proteindir. Virus replikasyonu için gerekli değildir. HBcAg’nin hepatosit endoplazmik retikulumundaki yıkım ürünüdür. Serumda saptanması aktif replikasyon göstergesidir. Akut HBV infeksiyonu sırasında serumda saptanır. HBeAg pozitif kronik infeksiyon (immün tolerans) döneminde düzeyi yüksektir. HBeAg pozitif kronik hepatit (immün reaktif) döneminde ise düzeyi azalır ve kaybolur.
Anti-HBe
HBeAg negatifleştikten sonra anti-HBe saptanabilir hale gelir ve yıllarca serumda pozitif kalır. HBeAg üretimini engelleyen mutasyonlar yoksa HBeAg negatif ve anti-HBe pozitif olması virus replikasyonunun baskılandığı ve sonlandığını gösterir. HBeAg pozitif KHB’de tedavi başarı kriterlerinden biri HBeAg serokonversiyonudur (54-56).
Kalitatif ve Kantitatif HBV DNA Testleri
HBV DNA serumda HBsAg’den yaklaşık üç hafta önce saptanır. HBV DNA saptamada hedef çoğaltma ve sinyal çoğaltma prensibine dayalı testler mevcuttur. Hedef olarak nükleik asit çoğaltılmasına dayanan yöntemler arasında en yaygın kullanılan yöntem gerçek zamanlı polimeraz zincir reaksiyonu (PZR) tekniğidir. Dünya Sağlık Örgütü tarafından sonuçlar İÜ/lt olarak verilir. Kantitatif HBV DNA testleri; KHB’de evreleme ve tedavi endikasyonu koymada, tedavi yanıtı izleminde, özellikle kan ve organ donörlerinde akut infeksiyon döneminde HBV infeksiyonunu saptamada, antiviral ilaç direncinin saptanmasında, serolojik tanıdan kaçan mutant infeksiyon tanısında, okült HBV infeksiyonu tanısında ve riskli temasta bulaşmanın erken saptanmasında kullanılır (54,58,59).
HBV Genotipinin Belirlenmesi
HBV’nin filogenetik analizler sonrası coğrafi farklılık gösteren A-J arası 10 farklı genotipi ve 30 subtipi tespit edilmiştir (54). HBV genotipleri hastalığın bulaşma yolu ve progresyonu ile de ilişkilidir. Avrupa ve Amerika rehberleri genotip tayininin, sadece pegile interferon (PEG-IFN) tedavisi planlanan hastalarda yapılmasını önermektedir. Nükleoz(t)id anologları (NA) ile tedavide genotip analizi önerilmemektedir (41,54,58). Genotipin tedavi altındaki hastalarda HBsAg kaybı gelişmesi üzerine etkisi olabilir. Tenofovir tedavisi altındaki HBeAg pozitif hastalarda yapılmış olan bir çalışmada, HBsAg kaybı; genotip A’da %61, genotip D’de %30, genotip B’de %4 oranlarında görülürken, genotip C’de görülmemiştir (60).
HBsAg Kantitasyonu
HBsAg, hepatosit çekirdeğinde viral cccDNA’nın transkripsiyonu sonucu oluşan iki farklı mRNA (pre-S1 ve pre-S2 mRNA) translasyonu ile sentezlenir. HBsAg miktarının infekte hücre havuzunun bir göstergesi olduğu düşünülmekte olup miktarının azalmasının immün yanıta bağlı infeksiyon kontrolünün indirekt bir göstergesi olduğu kabul edilmektedir. HBV tedavisinde kullanılan nükleoz(t)id analoglarından etkilenmemektedir. HBsAg’nin diğer kaynakları ise konak genomundaki gelişigüzel entegre yerlerdir (54,60,61). Otomatize kantitatif HBsAg kitleri [Architect-QT assay (Abbott Diagnostics, ABD); Elecsys HBsAgIII Quant (Roche Diagnostics, Fransa), Liaison XL (DiaSorin, İtalya)] kullanımda olup kantitasyon aralığı dar olması nedeniyle örneklerin dilüe edilerek çalışılması gerekmektedir (62).
HBsAg düzeyi HBV infeksiyonunun dönemine ve genotipe göre değişmektedir. HBeAg pozitif KHB infeksiyonunda (immün tolerans dönem) HBsAg düzeyi en yüksek (>4 log10 İÜ/ml) iken, HBeAg negatif KHB infeksiyonunda (inaktif taşıyıcılık) en düşük (<2 log10 İÜ/ml) düzeylerdedir. Genotip A infeksiyonlarında diğer genotip infeksiyonlarına göre HBsAg düzeyi daha yüksektir (54,63). İnaktif (HBeAg negatif) KHB infeksiyonu olan olgularda HBsAg düzeyi 100 İÜ/ml’nin altında ise spontan HBsAg kaybı gelişebileceğinin göstergesi olabilir (54,64). Avrupa rehberinde, HBeAg negatif KHB infeksiyonunda (inaktif taşıyıcılarda) HBsAg düzeyi 1000’in altında ise HBV DNA ve ALT kontrolü yılda bir ve fibroz açısından değerlendirme üç yılda bir önerilirken HBsAg düzeyi 1000’in üzerinde ise HBV DNA ve ALT kontrolü altı ayda bir ve fibroz açısından değerlendirme iki yılda bir önerilmektedir (41). Amerika rehberinde bu şekilde bir öneri yoktur (58).
HBeAg pozitif KHB’de PEG-INF-α tedavisi yanıtını öngördürmede HBsAg titresi kullanılması önerilmektedir. Genotip A ve D için PEG-INF-α tedavisinin 12. haftasında HBsAg titresinde herhangi bir düzeyde azalma olmaması ya da 24. haftasında >20 000 İÜ/ml olması durumunda tedavinin kesilmesi önerilmektedir. Genotip B ve C’de ise PEG-INF-α tedavisinin 12. ve 24. haftasında HBsAg titresi >20 000 İÜ/ml ise tedavinin kesilmesi önerilir. HBeAg negatif genotip D KHB’de PEG-INF-α tedavisinin 12. haftasında HBsAg titresinde herhangi bir azalma olmaması ve HBV DNA düzeyinde 2 log’dan az düşüş olması halinde tedavinin kesilmesi önerilmektedir (54,65).
Nükleoz(t)id anologları ile tedavi sırasında HBV DNA’da belirgin baskılanma olurken, HBsAg düzeyindeki azalma geç ve yavaştır. HBeAg pozitif olgularda HBsAg düzeyindeki hızlı düşüş HBeAg serokonversiyonu ve virus süpresyonunun göstergesi olabilirken HBeAg negatif olgularda böyle bir korelasyondan söz etmek mümkün değildir. Nükleoz(t)id anologları ile tedavi altında olan ve HBsAg düzeyi <100 İÜ/ml olan siroz bulgusu olmayan olgularda relaps riskinin düşük olması nedeni ile tedavinin bir süre sonra kesilmesi düşünülebilir (54,60).
Anneden bebeğe geçiş riskini tanımlamada HBsAg düzeyi özellikle HBV DNA ölçümlerinin yapılamadığı durumlarda kullanılabilir. Annede HBsAg düzeyi 4 log İÜ/ml ise yenidoğana geçme riski yüksektir (%100 duyarlık ve %71 özgüllükte) (54,66).
HBsAg düzeyi, HSK gelişimini tahmin etmede kullanılabilir. HBeAg negatif düşük viral yükü olan kişilerde yapılmış olan bir çalışmada, HBsAg düzeyi 1000 İÜ/ml’nin üzerinde olan kişilerde HSK gelişme riski 14 kat daha yüksek bulunmuştur (67).
Özetle klinik süreçte kantitatif HBsAg (qHBsAg) ölçümü; HBV infeksiyonunun evresini tanımlamada (özellikle HBeAg negatif KHB infeksiyonu/hepatiti ayırımında), interferon tedavisine cevap verebilecek hasta grubunun seçiminde, anneden bebeğe geçiş riskini tanımlamada, HBeAg negatif KHB infeksiyonu olan kişilerde kontrol sıklığına karar vermede, NA ile tedavi altında iken tedavinin kesilmesine karar vermede ve HSK gelişme riskini tahmin etmede kullanılabilir.
HBV İnfeksiyonu Tanısında Yeni Biyobelirteçler
Serum HBV RNA Ölçümü
Serum “pregenomic” RNA (pgRNA) yapısal olarak cccDNA’dan kopyalanır. Bu nedenle serumdaki düzeyleri virus cccDNA’sının transkripsiyonel aktivitesini gösterir ve rezervuar boyutu hakkında bilgi verir (68). Karaciğer dokusundaki cccDNA’nın takip edilerek değerlendirilmesi mümkün olmadığından serum HBV RNA ölçümü ile cccDNA aktivitesini belirlemek önemlidir. HBV RNA ölçümü biyobelirteç olarak; HBV DNA ve qHBsAg ile birlikte NA ile tedavi altındaki hastalarda tedavi cevabını değerlendirmede, NA ile tedavi altında olan hastalarda tedavi kesilmesinin güvenliliğine ve HBsAg kaybı gelişebilecek (fonksiyonel kür) hastaları belirlemede kullanılabilir (54). Serum pgRNA, KHB infeksiyonu olan hastalarda cccDNA moleküllerinin intrahepatik aktivitelerini göstermede ve özellikle önümüzdeki yıllarda kullanıma gireceği düşünülen cccDNA transkripsiyonunu hedef alan tedavilere olan yanıtı ölçmede yararlı bir klinik gösterge olabilir (54,68).
Hepatit B Kor İlişkili Antijen
Hepatit B kor ilişkili antijen (HBcrAg) denatüre edilmiş HBeAg’dir. Serumda HBcrAg kantitasyonu ile viral yük, intrahepatik HBV DNA ve cccDNA arasında korelasyon olduğu gösterilmiştir. HBsAg negatif hastalarda bile tespit edilebilir. İntrahepatik cccDNA’yı göstermede önemli bir göstergedir. Nükleoz(t)id anologları ile tedavi sırasında düşük titrede HBcrAg tespiti tedavinin sonlanabileceğinin göstergesi olabilir. HBeAg serokonversiyonu gelişecek hastaları belirlemede, HBeAg negatif kronik infeksiyonu (inaktif KHB) kronik hepatitten ayırt etmede ve HSK gelişim riskini belirlemede kullanılabilir (54,69).
HBeAg Titresi Ölçümü
HBeAg akut ve kronik infeksiyonda kor geni tarafından kodlanarak üretilen proteindir ve aktif viral replikasyonu gösterir. HBeAg kantitasyonu hastalığın progresyonunu göstermede, HBeAg serokonversiyonunu tahmin etmede, mevcut ve gelecekteki tedavilere yanıtı belirlemede kullanılabilir. Ancak ticari kitleri arasında standardizasyonun olmaması kullanımını kısıtlamaktadır (70).
Anti-HBc Titresi Ölçümü
Anti-HBc kantitasyonu HBV’ye karşı immün cevabı gösterir. Yüksek anti-HBc titreleri, HBV’ye karşı kuvvetli immün cevabı gösterdiği için tedaviye en iyi cevap verecek hasta grubunu ayırt etmede yardımcı olabilir. Anti-HBc titre ölçümü hastalardaki hepatik alevlenme riskini göstermede ve spontan HBeAg serokonversiyonu gelişebilecek hastaları tespit etmede kullanılabilir (54,71,72).
Histopatolojik Değerlendirme
Karaciğer iğne biyopsisi, KHB tanısının kesinleştirilmesinde, tedavi öncesinde nekroinflamatuar aktiviteyle fibrozun belirlenmesinde ve siroz tanısının doğrulanmasında gerekli bir yöntemdir. Bu amaçla en yaygın olarak Ishak (modifiye Knodell) skorlama sistemi kullanılmaktadır. Bu skorlama sistemine göre histolojik aktivite indeksi 18 puan üzerinden değerlendirilir; 1-6 hafif, 7-12 orta, 13-18 ağır inflamasyon işaretidir. Fibroz ise 6 evre üzerinden değerlendirilmektedir; evre 5-6 sirotik evreyi işaret eder. Histopatolojik değerlendirme aynı zamanda karaciğer hastalığının diğer nedenlerinin dışlanmasında da yararlıdır (42).
İnvaziv Tanı Yöntemleri
Son yıllarda; karaciğer biyopsisinin uygulama zorluğu, invazif bir işlem olması, nadir de olsa komplikasyon gelişme riski bulunması ve örneklem hatası yapılması gibi nedenlerden dolayı karaciğer fibrozunu göstermede invazif olmayan tanı yöntemleri klinik kullanıma girmiştir. Kronik karaciğer hastalığı ve fibrozu değerlendiren invazif olmayan metodlar arasında; ultrasonografi, “transient” elastografi (fibroscan), “transient” elastografi ile konvansiyonel ultrasonografinin kombine edildiği “acoustic radiation force impulse” (ARFI), magnetik rezonans elastografi (MRE) gibi görüntüleme yöntemleri ile çeşitli biyokimyasal analizler ve bu analizlerin kullanıldığı panel testler bulunmaktadır (59,73).
“Transient” Elastografi (Fibroscan)
Karaciğer doku elastisitesini (sertliğini) ultrasonografik olarak ölçerek, kronik karaciğer hastalarında fibroz durumu hakkında bilgi veren standart radyolojik tekniklerin dışında kabul edilen ve invazif olmayan bir görüntüleme yöntemidir. Hasta başında hemen uygulanabilmesi ve hızlı bir şekilde sonucun elde edilmesi avantaj sağlamaktadır. Karaciğerin daha geniş bir kısmı değerlendirildiği için biyopsiye göre daha fazla bilgi vermektedir. Sonuçlar kilopascal (kPa) olarak verilir; 6 kPa ve altında olan sonuçlar sirozu dışlarken 9 kPa üzeri olan veya 12 kPa üzeri olan ve ALT yüksekliği olan durumlar kuvvetle ileri düzey karaciğer hastalığı olduğunu gösterir (74,75).
Magnetik Rezonans Elastografi (MRE)
Dokuların sertliğini kantitatif olarak değerlendirmek için mekanik ve sürekli dalgaların kullanıldığı dinamik bir görüntüleme tekniğidir. Karaciğerin tamamını tarama avantajına sahip olması nedeniyle akustik bir pencereye bağımlı değildir. Karaciğerdeki lezyonları ve HSK’yı da saptayabilir. Ayrıca karaciğer fibrozunun daha erken dönemlerinde tanı sağlayabilir. Üç boyutlu bir görüntü elde edildiği için karaciğerin viskoelastik paremetreleri daha iyi analiz edilebilir. Obez ve asiti olan hastalara uygulanması avantaj sağlar. Aşırı demir yükü olan hastalarda ve fibrozun ara evrelerini tanımada kısıtlılıkları mevcuttur. Pahalı ve zaman alıcı olması nedeniyle rutin uygulamada kullanılması zordur (76,77).
Panel Testler
Panel testlerde, biyokimyasal belirteçlerin birkaçı birlikte değerlendirilerek veya matematiksel modeller kullanılarak karaciğer fibroz derecesinin ve nekroinflamasyonun daha hassas olarak belirlenmesi amaçlanır. Bu testler arasında PGA indeksi, APRI indeksi, FibroTest, ActiTest, FIB-4 sayılabilir. Bu testlerin dezavantajı; akut inflamasyonda yanlış negatiflik, Gilbert hastalığı, hemoliz, ekstrahepatik kolestaz, akut hepatit gibi durumlarda yanlış pozitif sonuç vermesi, sadece karaciğer hasar derecesini belirlemesi ve hastalık etiyolojisi hakkında bilgi verememesidir. Avantajları ise; invazif olmamaları, trombositopeni, kanama diyatezi gibi biyopsinin kontrendike olduğu durumlarda kullanılabilmeleri, patolog gözlem farklılığı ve örnekleme hatası içermemeleri, daha az maliyetli olmalarıdır (73,78,79).
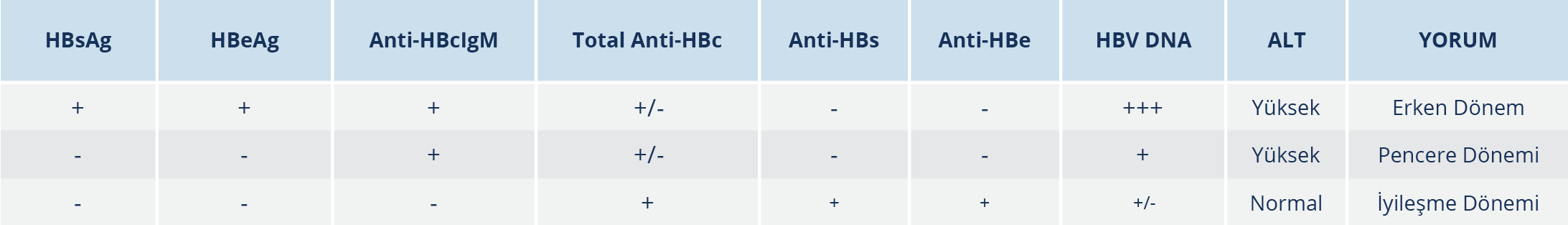
Akut Hepatit B Tanısı
Akut hepatit B’de AST ve ALT düzeyleri en az 10 kat yükselmektedir. Bu yükselme prodromal dönemde klinik bulguların ortaya çıkmasından 1-2 gün önce başlar ve 3-10 gün içinde pik yapar. Hepatoselüler hasarın şiddetine ve kolestazın derecesine bağlı olarak bilirubin düzeylerinde de yükselmeler saptanır. Protrombin zamanında uzama karaciğer hasarına veya kolestaza bağlı olarak görülebilir. HBsAg ve anti-HBcIgM pozitifliğiyle AHB nitelenir (Tablo 2). HBeAg, HBsAg ile aynı dönemde veya kısa bir süre sonra pozitifleşir ve HBsAg’den önce kaybolarak yerini anti-HBe’ye bırakır. İlk antikor yanıtı anti-HBcIgM olmakla birlikte anti-HBcIgM pozitifliği, KHB akut alevlenmelerinde de görülebilir ve tanısal karışıklığa yol açabilir (56,80).
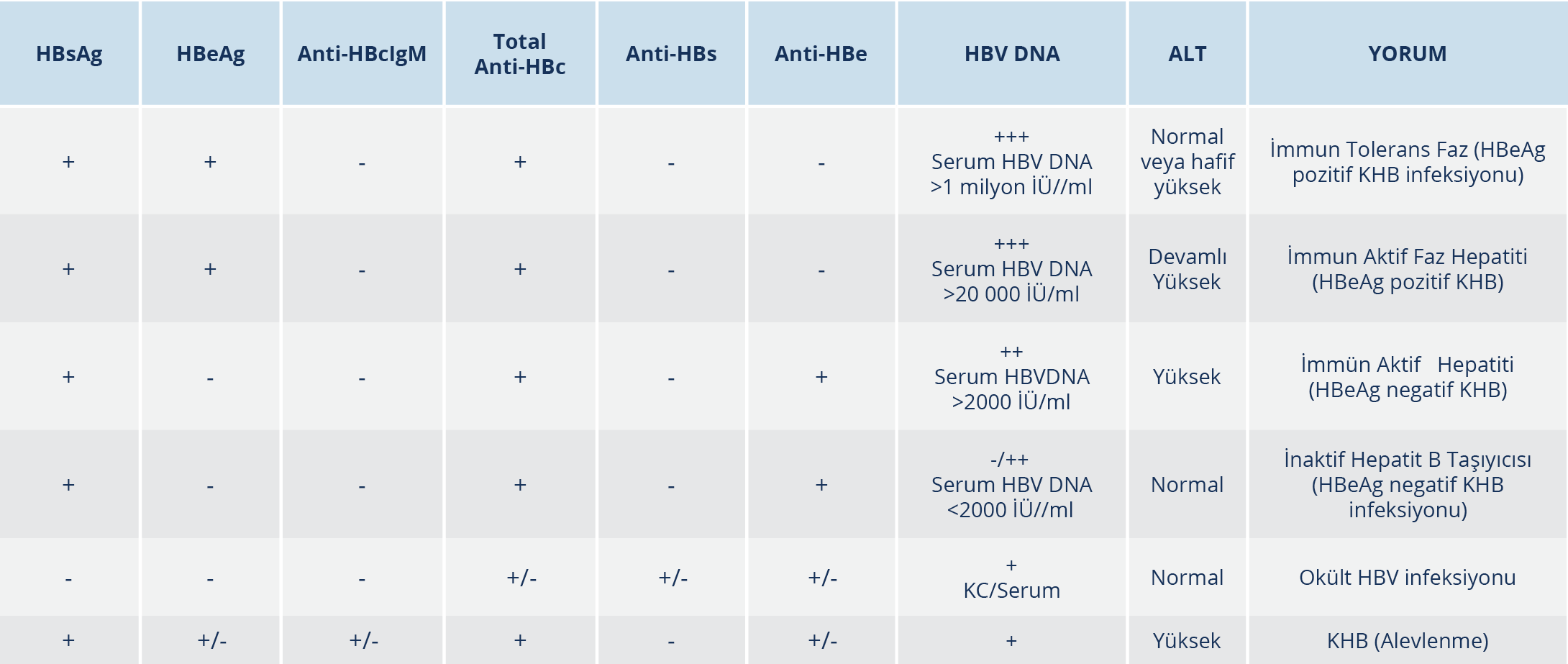
Kronik Hepatit B Tanısı
KHB infeksiyonunun tanısı, HBsAg’nin altı aydan uzun süre pozitif kalmasına dayanır. HBV replikasyonunu ve hastalığın evresini belirlemek için HBeAg, serum HBV DNA ve ALT düzeylerine bakılmalıdır. HBV DNA ve ALT düzeyleri HBV infeksiyonunun seyri sırasında değişebildiği için KHB infeksiyonu olan tüm hastalar düzenli olarak izlenmelidir. Ayrıca başvuru anında tedavi adayı olmayan hastalar takipte tedavi adayı haline gelebilir. KHB infeksiyonu tanı testleri ve klinik yorumları Tablo 3’te gösterilmiştir (56,80).
HBeAg pozitif KHB infeksiyonu (immün tolerans) döneminde HBV DNA çok yüksek düzeylerde saptanmasına karşın immün sistem aktivasyonu olmadığı için karaciğer histopatolojisinde hepatit bulguları yoktur.
HBeAg negatif KHB infeksiyonu (inaktif hepatit B taşıyıcısı) döneminde karaciğer biyopsisinde hepatite özgü bulgular ya yoktur ya da minimaldir. Prognozu iyi olan bu gruptaki hastaların HBeAg negatif KHB’den ayırt edilmesi önemlidir. Burada belirleyici olan HBV DNA düzeyidir. Bu nedenle söz konusu hasta grubunda ilk yıl üç ayda bir ALT ve HBV DNA düzeyleri izlenmeli, tanısı doğrulandıktan sonra daha uzun aralıklarla izlem sürdürülmelidir. Eğer yapılabiliyorsa HBsAg düzeyi bakılması da bu iki hasta grubunun ayırt edilmesinde yardımcı olacaktır (74,80).
Tedavi alan HBeAg negatif ya da pozitif KHB hepatit olgularında; HBV DNA negatifliği elde edilene dek her üç ayda bir, negatiflik elde edildikten sonra altı ayda bir ALT ve HBV DNA takibi yapılmalıdır. Söz konusu hasta grubunda, HBsAg düzeyi 1000 İÜ/ml’nin altında ise HBsAg kaybı gelişebileceğinin bir göstergesi olabilir ve HBsAg düzeyinin yıllık takibi yapılabilir. HBsAg düzeyi 100 İÜ/ml’nin altında olup sirozu olmayan hastalarda tedavinin sonlandırılması düşünebilir.
Okült HBV infeksiyonu, HBsAg negatif hastalarda HBV DNA pozitifliği olarak tanımlanabilir. Bu grupta yer alan hastalar, HBV’nin diğer serolojik göstergelerinin sıklıkla anti-HBcIgG’nin olup olmamasına göre seropozitif veya seronegatif olarak gruplandırılabilir. Söz konusu hastalar, potent immünosüpresif tedavi almaları durumunda HBV reaktivasyonu açısından risk altındadır. Kriptojenik kronik karaciğer hastalığının ayırıcı tanısında okült HBV infeksiyonu akla getirilmelidir (42,80).
Akut Hepatit B’nin Kronik Hepatit B Akut Alevlenmesinden Ayırt Edilmesi
KHB seyri sırasında akut alevlenme tablosu sık görülen bir durumdur ve bazen hastalığın ilk belirtisi olabilir; serum ALT ve HBV DNA düzeyinde yükselme, nekroinflamatuar aktivitenin tekrar belirginleşmesi ya da artmasıyla nitelenir. Özellikle ikterik seyreden akut alevlenme, AHB infeksiyonunu taklit edebilir. Prognoz ve tedavi yaklaşımlarının farklı olması nedeni ile iki tablonun ayırt edilmesi önemlidir. AHB hastalarının çoğu kendiliğinden iyileşir ve fülminan seyirliler hariç hastalık tedavi gerektirmez. Akut alevlenme ise hepatik dekompensasyona gidebilir ve tedavi gerekir (42). KHB’de akut alevlenme immün alevlenme ve reaktivasyon olmak üzere iki şekilde gerçekleşir:
İmmün alevlenme: İmmün aktif evredeki hastalarda bazen de HBeAg negatif KHB’de immün alevlenme olur ve viral klirense gidebilir. KHB’li kişide serum ALT düzeyinin hızlı bir şekilde normalin üst sınırının beş katı veya daha fazla yükselmesi durumudur.
Reaktivasyon: İnaktif veya geçirilmiş KHB’nin aktif infeksiyon haline dönüşmesidir. HBV DNA’nın negatif iken pozitifleşmesi veya >1 log artışıyla nitelenir. Önce HBV DNA artışı ardından karaciğerde inflamasyon bulguları ve ALT yükselmesi gelişir. Genellikle hastalarda altta yatan bir immünosüpresyon durumunda gelişir.
İkterik hastalarda klinik tablosu benzer olan bu iki durumu ayırt etmek çok zordur. Akut alevlenmelerde akut hepatitin en önemli göstergesi olan anti-HBcIgM de pozitif olabilir. Ayrıntılı bir öykü alınması çok önemlidir. Geçmişte KHB öyküsü olması veya aile öyküsü olması kronik infeksiyonu düşündürürken yakın zamanda kan transfüzyonu, iğne batması, perkütan yaralanma, ağız ve diş girişim öyküsünün olması ise akut infeksiyonu düşündürür. Akut alevlenmede de klinik semptomlar olmakla birlikte AHB infeksiyonunda semptomatik seyir daha sık görülür. Klinik olarak asit, kronik karaciğer hastalığına ait belirtiler, splenomegali olması altta kronik hastalık olduğunu düşündürür. İkter akut hepatitte, splenomegali de kronik hepatitin akut alevlenmesinde daha yaygındır. Bununla birlikte klinik olarak bu iki tabloyu ayırt etmek her zaman mümkün değildir.
Kantitatif anti-HBcIgM testleri AHB’de daha yüksek titrede pozitiftir. AHB’de HBsAg titresi daha düşüktür ve altı ay içinde kaybolması AHB lehinedir. AHB’de HBV DNA düzeyleri daha düşüktür. HBeAg tek başına ayırt ettirici olmamakla birlikte AHB’de titreleri daha düşüktür. Histopatolojik inceleme, akut dönemde akut hepatit bulguları nedeniyle kronik hepatit bulguları maskelenebileceği için akut dönem geçtikten sonra yapılmalıdır (42,81,82).
Öneriler
- HBV infeksiyonu tanısında ve takibinde; biyokimyasal (AST/ALT), serolojik (HBsAg, anti-HBcIgM/IgG, HBeAg, anti-HBe) ve moleküler testler (HBV DNA) birlikte kullanılmalıdır.
- Günümüzdeki NA ile tedavide genotip analizi önerilmemektedir.
- HBsAg kantitasyonu HBV infeksiyonunun evresini tanımlamada (özellikle HBeAg negatif KHB infeksiyonu/hepatiti ayırımında), interferon tedavisine cevap verebilecek hasta grubunun seçiminde, NA tedavisi altında iken tedavi kesimine karar vermede kullanılabilir.
- HBV infeksiyonu tanısında yeni biyobelirteçler (serum HBV RNA, hepatit B kor ilişkili antijen, HBeAg titresi ölçümü, anti-HBc titresi ölçümü) şu an için klinik kullanımda değildir. Önümüzdeki yıllarda klinik kullanıma girmesi planlanan yeni tedavilere (genoma entegre olmuş olan HBV DNA ve cccDNA kaybını sağlayabilecek tedavilere) yanıtı değerlendirmede kullanılabilirler.
- Histopatolojik değerlendirme, KHB tanısının kesinleştirilmesinde kullanılabilir. Histopatolojik değerlendirmenin yapılamadığı durumlarda invazif olmayan tanı yöntemleri kullanılabilir.
- AHB ve KHB akut alevlenmesini ayırt etmede hiçbir test tek başına yeterli değildir; ayrıntılı anamnez alınmalı ve anti-HBcIgM, HBV DNA, HBeAg ve HBsAg düzeylerine göre karar verilmelidir.
KRONİK HEPATİT B TEDAVİSİ
Tedavinin birincil amacı; hastaların yaşam süresini uzatmak, yaşam kalitesini artırmak ve HSK ya da karaciğer yetmezliği gelişimi gibi komplikasyonları engellemektir. KHB’ye bağlı karaciğer dışı bulguların tedavisi, hepatit B reaktivasyonlarının engellenmesi ve anneden bebeğe bulaşmanın önlenmesi ise tedavinin ikincil amaçlarıdır (41,83).
Tedavi Endikasyonları
KHB’nin özellikle immün aktif evresinde (HBeAg pozitif ya da negatif kronik hepatit hastaları) olan hastalarda ve sirotik hastalarda komplikasyon gelişme olasılığı ve HSK riski yüksek olduğu için hemen antiviral tedavi başlanması önerilir. Ancak KHB hastalarının yaklaşık %30’u gri zondadır ve bu hastaların prognoz ve tedavisi halen çalışma konusudur (83). Gri zondaki hastalara antiviral tedavi verilip verilmeyeceği klinik olarak zorlayıcı bir sorudur.
KHB tedavisinde hasta için en faydalı hedef fonksiyonel kür olarak tanımlanan HBsAg kaybıdır. Fonksiyonel kür safhasındaki hastada intrahepatik cccDNA ve/veya hücre kromozumuna entegre HBV DNA varlığına karşın serumda HBV DNA saptanamaz düzeydedir ve HBsAg negatiftir. Bu safhada olan hastaların karaciğer komplikasyonu olasılığı ve HSK riski çok düşüktür (41,83). KHB infeksiyonunda karaciğer hasarı ve HSK ile ilişkili en önemli faktör aktif HBV replikasyonu olduğu için antiviral tedavi ile HBV DNA baskılandığında, hepatik inflamasyonun, siroza ve hepatik dekompansasyona gidişin azaltılması ile HSK’nin önlenmesi sağlanır. Günümüzde antiviral tedavi ile bu hedefe büyük oranda ulaşılmasına karşın halen HBV’nin eradikasyonu söz konusu değildir. Antiviral tedavi kararı alınırken şu üç önemli faktör dikkate alınmalıdır; karaciğer hastalığının ciddiyeti, HBV replikasyon derecesi ve karaciğerde devam eden hasarın varlığı.
HBeAg Pozitif KHB İnfeksiyonu Olan Hastalarda Tedavi
HBeAg pozitif kronik infeksiyonlu hastaların antiviral tedavi olmaksızın uzun dönem prognozları gayet iyidir (58,84). Literatürde, bu dönemdeki hastaların HSK insidanslarının antiviral tedavi alan hastalardan farklı olmadığını gösteren çalışmalar bulunmakla birlikte tedavi almayan hastaların bir kısmında HSK ve siroz ilişkili komplikasyonların gelişebileceği bildirilmektedir (85,87,88). Güncel çalışmalarda; ileri yaş, HBV DNA’nın <107 İÜ/ml olması, karaciğer sertlik değerinin yüksekliği ve ALT düzeyinin üst sınıra yakın olması, HBeAg pozitif kronik infeksiyonlu hastalar arasında karaciğer komplikasyonları ve HSK gelişimi açısından risk faktörleri olarak bildirilmektedir (87-90). Genellikle HBeAg pozitif kronik infeksiyonlu hastalar gençtir. Yaşı ileri olan (>35) ve klinik olarak HBeAg pozitif kronik infeksiyon özellikleri taşıyanlarda, önemli düzeyde fibroz veya nekroinflamasyona rastlanma olasılığı gençlere göre daha yüksek olarak bildirilmektedir (88,89). Söz konusu hastalara karaciğer biyopsisi yapmak için yaş sınırı 30-40 yıl olarak bildirilmektedir (41,58). Karaciğer biyopsisi yanında invazif olmayan tanı testleri de fibroz düzeyini göstermek için kullanılabilir (87).
HBeAg pozitif kronik infeksiyon evresinde, oral antiviral tedavi başlanan hastaların tümünde, tedavi kesildiği zaman, HBV DNA’nın 2000 İÜ/ml’nin üzerine çıktığı, %70’inde ALT düzeyinde artış olduğu ve %55’inde tekrar antiviral tedavi başlandığı gözlenmiştir. HBeAg pozitif kronik infeksiyon hastalarına tedavi başlanırsa uzun süreli tedavi gerekli olabilir ve tedavinin kesilmesi zor olabilir (83,91). Bu yüzden HBeAg pozitif kronik infeksiyonlu hastalar içerisinden sadece yukarıda bahsedilen risk faktörlerini taşıyan hastalara tedavi başlanması önerilir. Ayrıca EASL 2017 kılavuzunda HSK yönünden aile hikayesi olanlara da tedavi başlanması önerilmiştir (41).
Tedavisiz izlenen HBeAg pozitif veya negatif KHB infeksiyonlu hastalarda, spontan ve ciddi alevlenmeler görülebilir. Bu hastaların herhangi bir nedenle immünosüpresif tedavi almaları durumunda da alevlenme gelişme olasılığı vardır. Alevlenmelerde; ALT düzeyi normalin 5-10 kat üstünde bir oranla artar, HBV DNA yüksektir, sarılık, koagülopati ve/veya ensefalopati görülebilir. Alevlenme atakları, anti-HBs serokonversiyonu ya da HBeAg pozitif hastalarda anti-HBe serokonversiyonu ile sonuçlanabileceği gibi akut karaciğer yetmezliği ve mortalite ile de sonuçlanabilir. Bu nedenle, alevlenme gelişen kronik infeksiyonlu hastalarda antiviral tedavi başlanmalıdır (83).
Öneriler
- HBeAg pozitif kronik infeksiyonlu hastalar (HBeAg pozitif, HBV DNA >107 İÜ/ml ve devamlı normal düzeyde ALT’si olanlar, genellikle 40 yaş altındadır) antiviral tedavi verilmeksizin izlenmelidir.
- Normal ALT’si olup HBeAg pozitif kronik infeksiyon evresinde olduğu düşünülen olgularda, eğer hastanın yaşı >30-40 yıl ise, HBV DNA <107 İÜ/ml ise veya ALT düzeyi üst sınıra yakınsa invazif olmayan fibroz değerlendirme testleri veya karaciğer biyopsisi ile değerlendirme önerilir; söz konusu yöntemlerle orta-şiddetli nekroinflamasyon ve/veya orta-ciddi fibroz bulgusu elde edilirse antiviral tedavi başlanabilir.
- HBeAg pozitif ya da negatif KHB infeksiyonlu hastalarda akut alevlenme gelişme durumunda antiviral tedavi mutlaka başlanmalıdır.
HBeAg Pozitif veya Negatif Kronik Hepatit B Olan Hastalarda Tedavi
KHB, HBeAg pozitif veya HBeAg negatif olabilir; bu fazdaki hastalarda aktif HBV replikasyonu ve karaciğerde hasar ve/veya fibroz vardır. KHB evresindeki hastalarda, antiviral tedavi ile siroz, hepatik dekompansasyon ve HSK riski azalır (92). Bu nedenle KHB evresinde olan HBeAg pozitif/negatif tüm hastalara antiviral tedavi önerilir. Ancak hastalar, tedavi alsalar bile, HSK açısından izlenmeye devam edilmelidir. Zira antiviral tedavi HSK riskini tamamen ortadan kaldırmaz (41).
Saptanabilir alt sınırın üzerinde HBV DNA’ya sahip hastaların hepsinde tedavi gerekmeyebilir. HBV DNA değerleri HBeAg pozitif hastalar için >20 000 İÜ/ml ve HBeAg negatif hastalar için ise 2000 İÜ/ml sınırının üzerinde olup karaciğerde HBV’ye bağlı önemli düzeyde hasar veya fibroz olanlara tedavi verilir (41,93). Hastalarda ALT yüksekliği, karaciğer hasarını düşündürür ve tedavi kararında önemlidir. ALT değeri, normalin üst sınırının iki katından fazla yükselirse KHB için antiviral tedavi mutlaka önerilir (41,58). ALT düzeyi, normalin üst sınırından 1-2 kat oranında artmış ise bu hastalara antiviral tedavi verilmesi konusunda tartışma vardır (41,58). ALT düzeyi, normalin üst sınırından 1-2 kat arasında bir oranda yükselmiş hastaların, ALT düzeyi normal olanlara göre siroz ve HSK riskleri artmıştır (94). Bu hastaların serum ALT ve HBV DNA düzeyleri yakından takip edilmelidir. Devam eden ALT yüksekliği durumunda karaciğer histolojisini araştırmak için invazif olmayan fibroz testlerine veya karaciğer biyopsisine başvurulabilir.
Karaciğer biyopsisinde orta-ciddi fibroz veya nekroinflamasyon bulgusu antiviral tedavi endikasyonudur. Karaciğer biyopsisi invazif bir girişimdir ve her merkezde uygulanamaz. Serum fibroz biyobelirteçleri veya “transient” elastografi alternatif olarak fibrozu tahmin etmek için kullanılabilir (50). Son yıllarda, tedavi başlama kararı verirken, biyopsi yerine, karaciğer hastalığının düzeyinin “fibroscan” gibi invazif olmayan testlerle değerlendirilmesi önerilmektedir (95).
HBeAg pozitif veya negatif KHB’li hastalarda, ciddi alevlenmeler de görülebilir. Bu durumda ALT düzeyi, normalin üst sınırından 5-10 kat arasında artar; HBV DNA düzeyi yüksektir, sarılık, koagülopati ve/veya ensefalopati görülebilir. Ciddi akut alevlenme spontan olabileceği gibi, antiviral tedavi altındaki KHB hastalarında ilaç direnci ya da antiviral tedavi kesilmesi sonucunda da görülebilir. Hangi nedenle olursa olsun, HBV infeksiyonu alevlenmelerinde NA tedavisi mortaliteyi düşürür. Dolayısıyla ciddi akut alevlenmede hemen antiviral tedavi başlanması önerilir (83,96).
HBeAg negatif ve HBV DNA düzeyi >2000-20 000 İÜ/ml arasında olup ALT normalin üst sınırından 1-2 kat arasında yüksek seyreden hastalarda, ALT >normalin üst sınırı x 2 kat yüksek olup antiviral tedavi başlananlara göre karaciğer komplikasyonu gelişme ihtimalinin daha yüksek olduğu bildirilmektedir (97). Bu hastaların önceden HBeAg pozitif KHB evresine geçmiş (immün aktif faz) olması ve karaciğerde değişen derecelerde fibroz bulunması mümkündür. Eğer karaciğerde ciddi fibroz varsa ALT’den bağımsız olarak, bu hastalarda da tedavi düşünülebilir (58,92). HBV DNA düzeyi >2000 İÜ/ml ve ALT düzeyi normal ya da hafif yüksek hastalarda fibrozun iyice değerlendirilmesi ve buna göre tedavi verilmesi gerekir (98).
Öneriler
- HBeAg pozitif ve HBV DNA düzeyi ≥20 000 İÜ/ml olan KHB hastaları ile HBeAg negatif ve HBV DNA düzeyi ≥2000 İÜ/ml olan KHB hastaları, ALT düzeyinden bağımsız olarak tedavi edilmelidir.
- HBV DNA düzeyleri, ilk öneride belirtilen eşik değerlerin altında olan ancak ALT düzeyi >normalin üst sınırı x 1-2 kat olan hastalarda, karaciğer histolojisi biyopsi ya da invazif olmayan tanı testleri ile değerlendirilmeli ve karaciğerde orta-ağır düzeyde nekroinflamasyon ya da fibroz varlığında tedavi düşünülmelidir.
- HBeAg pozitif/negatif KHB hastalarında, akut alevlenme varlığında hemen tedaviye başlanmalıdır.
HBeAg Negatif KHB İnfeksiyonu Olan Hastalarda Tedavi
Bu fazda olup ileri fibrozu olmayanlarda uzun dönemde prognoz iyidir (99). Buna karşıt olarak ileri fibrozu olanlarda HSK riski yüksektir (97, 100-102). Güney Kore’den bir çalışmada, düşük düzey viremisi olan HBeAg negatif hastalar ele alınmış ve bu hastalarda beş yıllık dönemde HSK gelişimi incelenmiştir. Ultrasonografi ile siroz bulgusu saptanan hastalarda, beş yıllık HSK insidansı %13.9 olarak tespit edilmiştir. Ancak HSK, siroz olmayanlarda da gözlenmiştir. Sirozu olmayan ve düşük düzey viremisi olan hastalar içerisinde özellikle invazif olmayan yöntemlerle karaciğer histolojisinin değerlendirildiği ve yüksek FIB-4 skoru veya APRI indeksi tespit edilen hastalarda HSK insidansının yüksek olduğu görülmüştür (102). HBeAg negatif KHB infeksiyon evresi dinamik bir evredir; hastalarda HBeAg negatif KHB evresine geçiş olabilir. Bu evredeki hastalarda fibroz derecesi dikkatli değerlendirilmeli ALT ve HBV DNA düzeyleri yakın takip edilmelidir. Bu değerlendirmelerle HSK riski düşük olan hastalarda antiviral tedavinin bir etkinliğinin olmadığı bildirilmektedir (83).
Öneri
HBeAg negatif KHB infeksiyonu olan hastalarda, tedavi kararı karaciğerde fibroz varlığının değerlendirilmesine göre verilmelidir; fibrozu olanlara antiviral tedavi uygulanmalıdır.
Kompanse Siroz Varlığında Tedavi
Görüntüleme ile karaciğer yüzeyindeki nodülarite, splenomegali veya portal hipertansiyonu düşündüren abdominal kollaterallerin varlığı belirlenirse veya endoskobide özofageal veya gastrik varis görülürse siroz tanısı konur (83). Görüntüleme çalışmalarına ek olarak albümin, bilirubin, protrombin zamanı ve trombosit sayısı da siroz tanısında yardımcıdır. Kompanse sirozlu hastalara antiviral tedavi verilmesi HSK ve karaciğer ilişkili komplikasyon riskini azaltabilir ve karaciğer fibrozunu iyileştirebilir (103,104). Serum ALT değeri, sirozlu hastada yükselmeyebilir ve komplikasyon riski ALT’si normal düzeyde olanda bile yüksektir. Dolayısıyla aktif HBV replikasyonu olan sirotik hastalar ALT düzeyinden bağımsız olarak antiviral tedavi almalıdır (105). Antiviral tedavi ile sirotik hastaların HSK riski azalır; ancak viral yanıt alınmakla birlikte risk devam ettiği için HSK taraması, tedavi süresince devam etmelidir (41,106). Kompanse siroz hastalarında HBV DNA düzeyi >2000 İÜ/ml ise antiviral tedavi kesin endikedir. Tesbit edilebilir ancak düşük düzey viremisi (<2000 İÜ/ml) olan hastalar için uluslararası tedavi kılavuzları tedavi önermektedir (41,83). HSK riski; düşük düzey viremisi olan hastalarda, tespit edilemeyecek düzeyde HBV DNA’sı olanlara göre yüksektir. Söz konusu hastalar arasında antiviral tedavi alanlarda HSK riski daha düşüktür ve antiviral tedavi düşük düzey viremisi olanlara verildiğinde HBV reaktivasyon riskini de azaltarak sağkalımı artırmaktadır (107). Literatürde, düşük düzey viremisi olan sirotik hastaların 10 senede kümülatif HSK insidansının %13.9 olduğu ve bu hastaların tedavi alan sirotik hastalara göre karaciğer ilişkili komplikasyonları daha sık yaşadıkları bildirilmektedir (101,108). Söz konusu veriler düşük düzey viremili kompanse siroz hastalarında antiviral tedavi verilmesi gerektiğini düşündürmektedir.
Öneriler
- HBV DNA düzeyi >2000 İÜ/ml olan kompanse sirozlu hastalarda mutlaka antiviral tedavi başlanmalıdır.
- Tespit sınırının üzerinde ancak <2000 İÜ/ml HBV DNA düzeyi olan kompanse sirotik hastalarda tedavi başlanması olumsuz sonuçları azaltabilir.
Tedavi Seçenekleri
Günümüzde KHB’de kullanım onayı almış antiviral tedaviler, PEG-INF-α ve NA’dır; NA dirence yüksek genetik bariyeri olanlar ve düşük genetik bariyeri olanlar şeklinde ikiye ayrılır (41). Nükleoz(t)id anologlarının ve PEG-INF-α’nın başlangıçta birlikte kullanımlarının avantajlı olduğu gösterilmemiştir (109,110).
PEG-INF-α tedavisi belli bir süre verilir; HBV’nin immün aracılı kontrolünü sağlar ve ayrıca tedavi bittikten sonra yanıtın devam etme ihtimali vardır (111). Ancak parenteral verilmesi, yan etkilerinin sık olması ve sınırlı etkinliğinin olması önemli dezavantajlarıdır. Ayrıca dekompanse sirozda kontrendikedir (111). Kompanse sirozda immüniteyi uyararak karaciğer hasarına neden olma ihtimali olduğu için dikkatli kullanılmalıdır. Tedavi sırasındaki bazı laboratuvar parametrelerine bakılarak tedaviye devam ya da kesme kararı alınabilir.
Nükleoz(t)id anologları ile tedavinin ise, PEG-INF-α tedavisinden farklı olarak belli bir süresi yoktur; çok daha uzun dönem verilebilir (93) ve dekompanse siroz dahil çoğu hasta için güvenlidir. Diğer yanda direnç problemi ortaya çıkabilir; ancak dirence genetik bariyeri yüksek olan ajanların monoterapisi ile çok iyi bir viral baskılanma olmakta ve direnç gelişimi neredeyse hiç görülmemektedir (41,93). Dolayısıyla NA ile tedavi başlanacaksa yüksek genetik bariyeri olan bir ajanla tekli tedavi önerilir. Hangi NA’nın verileceği seçilirken etkinlik ve daha da önemlisi yan etki profili değerlendirilir. Hastanın komorbiditelerine göre ilaç seçimi gerekebilir.
Nükleoz(t)id) Analogları
KHB infeksiyonu için 2017 yılında kullanıma giren tenofovir alafenamid fumarat (TAF) ve besifovir en yeni antiviral ajanlardır (119; TAF, tenofovir disporoksil fumarat (TDF) ile aynı etki mekanizmasına sahip bir nükleotid analoğudur, plazmada stabil bir konsantrasyonda kalır, hepatositlerden metabolize edilir ve daha düşük dozda TDF ile benzer aktivite sergiler. Vücudun bu ilaca maruziyeti daha düşük olduğu için TAF, TDF’den daha az oranda renal ve kemik toksisitesine neden olur (111-114).
Nükleoz(t)id analogları olarak yüksek genetik bariyeri olan, entekavir (0.5 mg/gün), TAF (25 mg/gün), TDF (245 mg/gün) ve besifovir, KHB tedavisinde ilk seçenek olarak önerilen ajanlardır. Entekavir ve TDF’nin uzun dönemde etkin ve güvenilir olduğu birçok çalışma ile kanıtlanmıştır (115-117). Nispeten daha yeni kullanıma giren ve iki yıllık takip verilerini içeren çalışma sonuçlarının yayımlandığı TAF ve besifovir ise TDF ile aynı etkinliği gösterirken TDF’den daha güvenli olduğu ortaya konmuştur (111-114,118). Bu ilaçların daha uzun dönem sonuçları beklenmektedir.
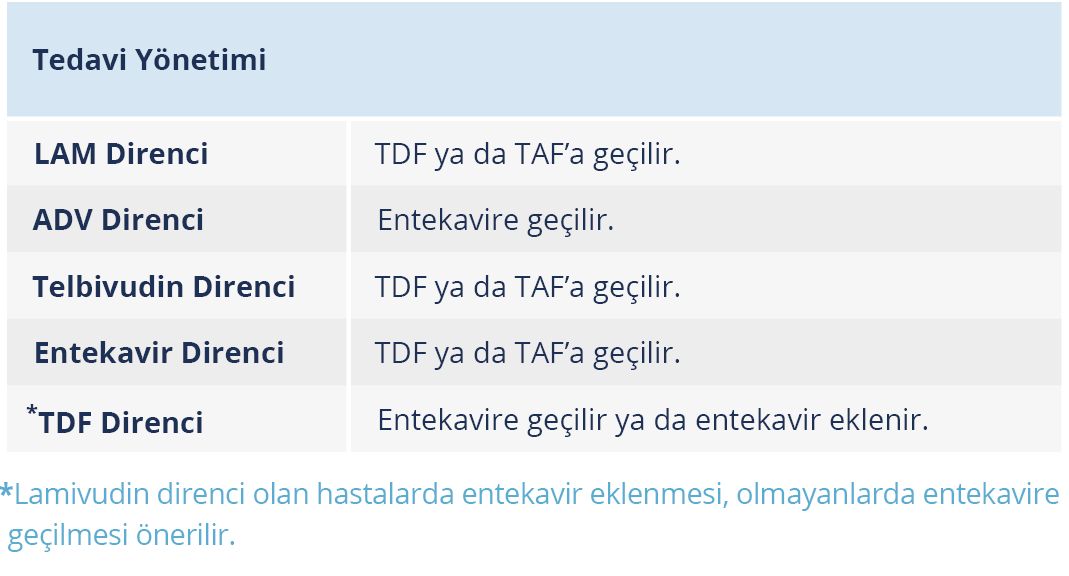
Düşük genetik bariyerli NA’lar olan lamivudin, telbivudin ve adefovir ise direnç gelişme riski olduğu için artık KHB’nin tedavisinde ilk seçenek ilaçlar değildir (41,93). Daha önce bu ilaçlarla kalıcı viral yanıt (KVY) sağlanmış olan ve henüz direnç gelişmemiş hastalarda kullanımları sürdürülebilir.
İnterferonlar
İnterferonun antiviral ve immün modülatör aktivitesi vardır. İnterferon alfa (INF-α), mekanizması tam bilinmese de cccDNA ve viral mRNA’nın parçalanmasında, viral DNA replikasyonunun inhibisyonunda ve virusla infekte hepatositlere immün cevabın kontrolünde rol alır. PEG-IFN, interferon ve polietilen glikol moleküllerinin kombinasyonudur; uzun bir yarılanma ömrü olduğu için haftada bir kullanım kolaylığı vardır ve konvansiyonel interferona göre daha güçlü etki gösterir. PEG-INF’nin en önemli avantajı, 48 haftalık sabit kullanım süresidir ve 180 mikrogram dozda haftada üç kez subkutan yoldan uygulanır (109,120-125).
PEG-INF-α tedavisi ile, tedaviden sonraki 6-12 ayda HBV DNA düzeyinin <2000 İÜ/ml olması KVY olarak kabul edilmektedir (41,93). HBeAg pozitif KHB hastalarında KVY %20-30 civarındadır. HBeAg kaybı da gerçekleşen hastalarda, bu yanıt ilerleyen yıllarda da kalıcı olabilmektedir (58). Ayrıca bu hastalarda HBsAg kaybı tedavi bitiminde %3-7 arasında saptanırken, oran yıllar içinde artabilmektedir (41). HBeAg negatif KHB hastalarında ise bu oran %20 civarındadır (126). HBeAg negatif, genotip D ve E HBV infekte hastalarda, PEG-INF-α tedavisinin etkinliği düşüktür; buna karşın tedavi öncesi yüksek ALT ve düşük HBV DNA düzeyleri ile genç yaş ve kadın cinsiyet, genotip B veya C ile infekte olmak iyi tedavi yanıtını gösteren faktörlerdir (41,127). HBeAg pozitif KHB hastalarında PEG-INF-α yanıt olasılığını artıran faktörler; tedavi öncesi düşük viral yük, yüksek serum ALT düzeyleri (2-5 kat), HBV genotipi ve karaciğer biyopsisinde yüksek aktivite skorlarıdır. Genotip A ve B’de genotip C ve D’ye göre tedavi yanıt olasılığı yüksektir (41,128). KHB’de tedavi yanıtı tanımlamaları Tablo 4’te gösterilmiştir (41).
Öneriler
- KHB tedavisinde, ilk seçenek olarak PEG-INF-α ya da genetik bariyeri yüksek NA kullanılır.
- Antiviral direnç için yüksek genetik bariyerli ilaçlar; entekavir, TDF ve TAF olup; NA ile tedavi başlanacaksa, ilk seçenek bu ilaçlardan biri olmalıdır. Besifovir, ABD Gıda ve İlaç Dairesi (FDA) onaylı olmasına karşın henüz uluslararası rehberlerde ilk seçenek tedaviler arasında yer almamakta ve ülkemizde bulunmamaktadır.
- Kompanse sirotik hastalarda, yüksek genetik bariyerli NA öncelikli olarak önerilir. Ancak karaciğer fonksiyonu iyi korunmuşsa, karaciğer fonksiyonlarının ve yan etkilerin yakın takibi koşulu ile PEG- INF-α da kullanılabilir.
- Dekompanse sirotik hastalarda PEG- INF-α kontrendikedir.
Nükleoz(t)id Analogları İle Tedavinin Yan Etkileri
Uzun dönem TDF veya adefovir kullanımı böbrek fonksiyonu ve kemik mineral dansitesi (KMD)’nde azalmaya yol açabilir. Bu ilaçları alan hastalarda, akut ya da kronik böbrek yetmezliği, hipofosfatemi ve Fanconi sendromu gibi yan etkiler rapor edilmiştir (129-131). Hasta hali hazırda metabolik kemik hastalığı ve böbrek hastalığı için risk faktörü taşıyorsa veya tedavi sırasında bunlarda kötüleşme olduysa tedavi rejiminin değiştirilmesi düşünülebilir. Kronik böbrek hastalarında NA ile tedaviye başlarken, kreatinin klirensine (KK) göre doz ayarı yapılmalıdır; TAF için KK <15 ml/dk olan hastalarda, TDF için KK <10 ml/dk olan hastalarda, renal replasman tedavisi uygulanmıyorsa bu ilaçlar verilmemelidir. Bu durum besifovir için de geçerlidir (41,83). Tenofovir disporoksil fumarat böbrek fonksiyonu veya KMD’yi etkilediği için, steroid kullanımı gibi herhangi bir ek risk faktörünün varlığında besifovir, TAF ya da entekavirden biri tercih edilmelidir; TDF alanlar, tedavi sürecinde KMD yönünden izlenmelidir. Renal disfonksiyon yönünden herhangi bir risk faktörü taşıyan hastalar (50 yaş üstü, hipertansiyon, kardiyovasküler hastalık, diyabet veya hiperlipidemi) arasında TDF alanlarda TAF alanlara göre glomerüler filtrasyon hızında (GFR) daha belirgin düşüş olduğu bildirilmektedir (112-114). Benzer şekilde KMD’de düşüş riski olanlarda olmayanlara göre KMD’deki azalma TDF alanlarda, TAF alanlara göre daha yüksek bulunmuştur. Renal disfonksiyon için risk faktörü taşıyan hastalarda [bazal GFR <60 ml/dk, proteinüri veya albuminüri (idrarda protein pozitifliği veya idrar albümin/kreatinin oranı >30 mg/g olması), serum fosfat düzeyi <2.5 mg/dl, kontrolsüz diyabet ve hipertansiyon] TDF kullanımından kaçınılması önerilir (41). Kronik steroid alımı, KMD’yi azaltan ilaç kullanımı ve osteoporoz veya osteopenisi olanlarda TDF’den ziyade TAF ve diğer ilaçlar tercih edilmelidir.
Öneriler
- NA ilaç dozu böbrek fonksiyon bozukluğu olanlarda düzenlenmelidir.
- NA ile tedavi başlanacak hastalarda, renal fonksiyon bozukluğu veya metabolik kemik hastalığı varsa veya bunlar için risk varsa TDF yerine entekavir, TAF veya besifovir tercih edilmelidir.
- TDF alan hastalarda renal fonsiyon bozukluğu veya metabolik kemik hastalığı tesbit edilirse veya bu hastalıklar yönünden riskli oldukları ortaya konursa TAF, entekavir veya besifovire geçilebilir.
- İlaç değişimi gerektiren veya ilaç seçimini etkileyecek risk faktörleri; osteopeni veya osteoporoz varlığı, kronik steroid veya başka kemik dansitesini azaltan ilaç kullanımıdır. Renal risk durumları ise GFR <60 ml/dk, proteinüri (idrarda protein pozitifliği veya idrar albümin/kreatinin oranı >30 mg/g olması) veya hipofosfatemi (serum fosfor düzeyi <2.5 mg/dl) olmasıdır.
Tedavinin Sonlandırılması
Tedavinin sonlandırılmasında en uygun kriter HBsAg kaybının sağlanmasıdır. Ancak antiviral tedaviye rağmen cccDNA hepatosit çekirdeğinde kalmaya devam ettiği için HBV’nin tamamen eliminasyonu ve dolayısı ile HBsAg kaybı elde edilmesi çok zordur. PEG-INF tedavi süresi 48 hafta olarak net olmakla birlikte NA ile tedavinin sonlanacağı noktayı belirlemek için kesin bir fikir birliği oluşmamıştır.
Klinik pratikte ALT düzeyinin normalleşmesi, tesbit edilemeyen HBV DNA, HBeAg kaybı veya serokonversiyonu, HBsAg kaybı veya serokonversiyonu tedaviyi sonlandırmak için kullanılan belirteçlerdir. Günümüzde bunlara HBcrAg gibi yeni belirteçler eklenmektedir (132-135). HBsAg kaybını veya KVY’yi en iyi tahmin ettiren bir belirteç halen tanımlanmamıştır. NA tedavisini kestiğimizde hastanın durumuna ve izlem süresine göre değişmekle birlikte %20-70 hastada viral relaps olmaktadır (136-138). NA kesilmesi sonrası oluşan ALT alevlenmesiyle birlikte HBsAg kaybının arttığına dair çalışmalar vardır. Özellikle NA tedavisi kesilen kafkasyalı HBeAg negatif hasta grubunda HBsAg kaybı oranının progresif olarak arttığına ilişkin raporlar vardır (136,137,139). Dolayısıyla tedavi kesilmesine hem güvenlik konusu hem de yanıtın kalıcı olma ihtimali göz önüne alınarak dikkatli karar verilmelidir; NA tedavisi kesilen hastalara yakın takip önerilir. Özellikle sirotik hastada klinik relaps oluşursa hepatik dekompansasyona ve hatta ölüme bile gidebilir. Bu nedenle sirotik hastalarda HBsAg serokonversiyonu gelişmeden tedavi kesilmemelidir (121,124).
Normal ALT Düzeyi
KHB tedavisi sırasında ALT düzeyi normalizasyonu hepatik inflamasyonun azaldığını gösterir ve sirozda iyileşme ile ilişkilidir. Ancak devamlı normal ALT değeri olan hastaların %14-40’ında ciddi fibroz olduğu bildirilmektedir (140,141). Bu yüzden tedavi kesilmesi kararında ALT düzeyi normalizasyonu tek başına yeterli olamaz (83).
Saptanamaz Düzeyde HBV DNA Varlığı
HBV DNA düzeyi histolojik aktivite ile ilişkilidir, düşük düzeyde HBV DNA’sı olanların hepatik dekompansasyona gitme oranı da düşüktür. Antiviral tedavi HBV DNA düzeyini düşürdüğü zaman, histolojik iyileşme de başlar; ek olarak hastalık ilerleyişini ve karaciğer hastalığı alevlenmesini azalttığı ve HSK’yı önlediği için tedavi bitişi için kullanılabilecek alternatif göstergedir. HBV DNA uzun süre tesbit edilemeyecek düzeyde kalırsa HBsAg kayıp oranı artar, hatta HBeAg negatif hastalarda tedavi kesildikten sonra bile artmaya devam eder. Dolayısıyla uzun dönem tesbit edilemeyecek düzeyde HBV DNA’sı olan hastalarda tedavi kesilmesi düşünülebilir. Uluslararası kanıta dayalı rehberlerde de HBeAg negatif sirotik olmayan KHB hastalarında, en az üç yıl devam eden HBV DNA negatifliği durumunda tedavinin kesilebileceği bildirilmektedir (41,136,139). HBV DNA ne kadar düşükse klinik durum o kadar iyidir; ancak HBV DNA 60-2000 İÜ/ml arasında olduğu zaman siroz ve HSK riski, tespit edilemeyen HBV DNA’sı olanlarla benzerdir (99,140,141). Diğer yanda, saptanamaz HBV DNA’sı olmasına rağmen NA kesilmesi sonrasında da çoğu hastada relaps geliştiği gösterilmiştir (136,146). Bu nedenle saptanamaz HBV DNA düzeyi, tedaviyi kesmek için tek belirteç olarak değerlendirilmemelidir.
HBeAg Kaybı/Serokonversiyonu
HBeAg kaybı/serokonversiyonu olduktan sonra NA tedavisi kesilenlerde KVY oranı üçüncü senenin sonunda %51.5’tir (142). Kalıcı viral yanıt gelişmeyenlerde HBeAg reversiyonu, HBeAg negatif KHB veya sarılıkla giden akut alevlenme oluşabilir (142,143). HBeAg kaybı/serokonvesiyonu tek başına tedaviyi sonlandırma belirteci olamaz. HBeAg kaybı/serokonvesiyonu sonrası saptanamaz HBV DNA’nın uzun süre devam etmesi ve NA kesilmeden önce konsolidasyon tedavisi, yanıtın kalıcılığı için önemlidir. KVY’nin devamı için, HBeAg kaybı/serokonvesiyonu sonrası en az 12 ay süren konsolidasyon tedavisi önerilmektedir (41).
Kantitatif HBsAg Düzeyi, Kantitatif HBcrAg Düzeyi ve HBV RNA
HBsAg düzeyi, birçok çalışmada, KVY göstergesi olarak bildirilmiştir (63,144-147). HBsAg düzeyinin düşmesi PEG-INF-α tedavisine de iyi yanıtın göstergesidir ve hatta PEG-INF-α tedavisinin başlangıç döneminde HBsAg düzeyi yeterince düşmeyenlerde tedavi başarısı düşük olmakta ve bu da tedaviyi kesme kuralı olarak önerilmektedir (63). HBsAg düzeyinin NA tedavisi kesilmesi düşünülen olgularda da izlenmesinin faydalı olduğunu gösteren çalışmalar vardır. Bu çalışmalarda NA tedavisi HBsAg düzeyi düştüğünde kesilen olgularda klinik ve virolojik relapsların düşük oranda olduğu ve HBsAg kaybının ise yüksek olduğu görülmüştür. Genelde HBeAg negatif olgular için çeşitli çalışmalarda relapsın düşük ve HBsAg kaybının yüksek olduğu en uygun eşik değerler 80-100 İÜ/ml civarında belirlenmiştir (147). HBeAg pozitif KHB hastaları için ise en uygun “cut-off” değeri bir çalışmada 300 İÜ/ml olarak belirlenmiştir (145).
HBcrAg düzeyi; intrahepatik total HBV DNA düzeyi, cccDNA ve bunun yanında serum HBV DNA düzeyi ile yakın şekilde koreledir (54,69,133,148). HBcrAg düzeyi, NA tedavisinin kesilmesi sonrasında KVY’yi tahmin etmede yararlıdır. HBcrAg düzeyinin HBsAg düzeyi ile kombine şekilde kullanımını başarılı bulan çalışmalar vardır; hatta HBsAg düzeyi ve HBcrAg düzeylerini birlikte içeren SCALE-B skoru NA tedavisinin kesilmesi sonrasında relaps ve HBsAg kaybını öngörmek için Japon Hepatoloji Derneği (JSH) tarafından önerilmiştir (149).
HBV RNA; NA tedavisinin ne zaman kesilebileceğini belirlemek açısından yeni bir biyomarker olarak denenmektedir.
HBsAg Kaybı
HBsAg kaybı anti-HBs serokonversiyonu ile birlikte olsun ya da olmasın, kalıcı şekilde olduğunda KVY için en önemli göstergedir. HBsAg’nin kaybı fonksiyonel kür anlamına gelir. Tedavi almadan spontan HBsAg kaybı gelişen hastalarda da prognoz çok iyidir. HSK insidansının, HBsAg kaybı 45-50 yaş altında olursa belirgin olarak düştüğü bildirilmiştir (150). Antiviral tedavi sırasında HBsAg kaybı gelişen hastalarda bu durum çoğunlukla kalıcı olmakta, karaciğer komplikasyonu veya HSK insidansı azalmaktadır (151,154). Ancak özellikle sirozu olan hastalarda, antiviral tedavi ile HBsAg kaybı sağlansa da HSK gelişebilir. Bazı çalışmalarda bu riskin spontan HBsAg kaybı gelişenlerle benzer oranda, bazılarında ise daha yüksek oranlarda olabileceği bildirilmektedir (152,153). HBsAg kaybı antiviral tedavinin optimal sonucu olup NA tedavisinin kesilebileceği optimal hedeftir (151,154,155). HBsAg altı ay arayla iki kez negatif olarak tespit edilirse tekrar reversiyon veya HBV DNA pozitifleşmesi çok enderdir (154,155).
Tedavi Kesildikten Sonra İzlem
Nükleoz(t)id anologları tedavisi kesildikten sonra akut alevlenme ve dekompansasyonla sonuçlanabilecek klinik relapslar bazı hastalarda görülebileceği için karaciğer fonksiyon testleri, HBeAg/anti-HBe ve HBV DNA düzeyi düzenli takip edilmelidir. Bu takip, tedavi yanıtının kalıcılığını göstermek açısından da gereklidir. Özellikle tedavi kesildikten sonra HBV DNA düzeyi yükselirse NA tedavisine tekrar başlanıp başlanmayacağını belirlemek için daha yoğun bir takibe geçilir (134,135). HBsAg kaybı olmadan tedavi kesilenlerde HBsAg düzeyi de izlenebilir. HBsAg kaybı olsa bile, tedavi kesildikten sonra HBsAg reversiyonu ve HSK riski hala vardır (151,154-156). Bu yüzden HBsAg/anti-HBs testleriyle hasta izlenmeli ve HSK taramasına devam edilmelidir.
Öneriler
- PEG- INF-α tedavisi 48 hafta uygulandıktan sonra kesilir.
- Nükleoz(t)id anoloğu ilaçlar ile antiviral tedavinin sonlandırılması için en kesin nokta HBsAg negatifleşmesidir.
- HBeAg pozitif hastalarda, NA ile tedavi sırasında HBsAg kaybı ya da anti-HBe serokonversiyonu gelişirse, tedavi 12 ay daha sürdürüldükten sonra kesilebilir.
- NA ile antiviral tedavinin sonlandırılmasında kullanılabilecek tanımlanmış biyobelirteçler HBsAg kantitasyonu, HBV DNA ve yeni tanımlanan HBcrAg’dir. HBeAg negatif hastalarda HBsAg <100 İÜ/ml ise tedavinin kesilmesi denenebilir. HBcrAg için kesinleşmiş bir kantitatif değer yoktur. HBeAg negatif, sirotik olmayan hastalarda üç yıldan uzun HBV DNA negatifliği durumunda, yakın takibin sürdürülmesi koşuluyla hastalar, tedavinin kesilmesi açısından değerlendirilebilir.
- Özellikle dekompansasyon gelişmiş sirotik hastalarda tedavi HBsAg negatif olmadan kesilmemelidir.
- Tedavi kesilen hastalarda, karaciğer fonksiyon testlerinin ve serum HBV DNA ölçümlerinin bir yıl boyunca 1-6 ay arayla, HBeAg/anti-HBe testlerinin ise 3-6 ay arayla yapılması önerilir. Tedavi kesildikten bir yıl sonra yanıt devam ediyorsa karaciğer fonksiyon testleri ve HBV DNA takipleri 3-6 ay arayla; HBeAg/anti-HBe testleri ise 6-12 ay arayla kontrol edilmelidir.
- Tedavi kesildikten sonra viral yanıt devam ediyorsa HBsAg/anti-HBs testleri de HBsAg kaybını veya reversiyonunu yakalamak için düzenli olarak yapılmalıdır.
Antiviral İlaç Direncinin Yönetimi
İlk basamak antiviral ilacın dikkatli seçilmesi direncin ortaya çıkışını önlemek ve diğer ajanlara çapraz direnci azaltmak için önemlidir. Direnç gelişiminde önemli olan faktörlerden biri de hastanın tedaviye uyumudur. Antiviral direnç testi, tedaviye uyumu iyi olan hastalarda virolojik ve biyokimyasal kırılma olduğunda düşünülmelidir. Virolojik kırılma; antiviral tedavi alan olgularda, viral yanıt sonrası, HBV DNA düzeyinde >1 log İÜ/ml artış olması veya PZR ile negatif olan HBV DNA’nın tedavi altında yeniden pozitifleşmesidir. Biyokimyasal kırılma ise; tedavi ile başlangıçta yanıt alınan hastalarda, tedavi altında yeniden ALT düzeyinin yükselmesi olarak tanımlanır; bunun nedeni nerdeyse tamamen ilaç direncidir. Direnç analizi, genotipik ve fenotipik olarak yapılır. Genotipik analizde, moleküler yöntemlerle direnç gen mutasyonları araştırılırken; fenotipik analiz, genotipik olarak saptanın mutasyon varlığının in vitro olarak ilaca olan duyarlılık üzerine etkisinin değerlendirilmesi ile gerçekleştirilir (41,93).
Lamivudin, telbivudin, entekavir gibi nükleozid analoglarına karşı kanıtlanmış direnci olan hastalarda tek başına TDF ya da TAF tedavisine geçilebilir. Lamivudin/entekavir direnci olan hastaların ele alındığı randomize kontrollü bir çalışmada tek başına TDF alanlarla, TDF ve entekavir kombinasyon tedavisi alanlar arasında saptanamaz HBV DNA oranları açısından fark bulunmamıştır (%71 ve %73) (156,157). Aynı karşılaştırmayı yapan bir başka çalışmada, total grupta saptanamaz HBV DNA yönünden fark yokken başlangıçta viral yükü yüksek olanlarda tedavinin ikinci yılında TDF ve entekavir kombinasyonu tek başına TDF’ye üstün bulunmuştur (158).
Adefovir direnci durumunda TDF temelli monoterapiye veya TDF/entekavir kombinasyon tedavisine geçilmesi önerilir. Adefovir direnci gelişmiş HBV hastalarını ele alan bir randomize kontrollü çalışmada, saptanamaz HBV DNA’ya ulaşan hastaların oranı hem TDF grubunda hem de TDF/entekavir grubunda benzer bulunmuştur (%62 ve %63.5) (159). Bu hastalar üç yıl izlendiğinde yine her iki grupta virolojik baskılanma oranı benzer saptanmıştır. Ancak iki adefovir direnç mutasyonu (rtA181T/V ve rtN236T) taşıyanlarda HBV DNA’daki azalmanın monoterapi grubunda daha küçük olduğu görülmüştür (159,160). Daha önce adefovir kullanma hikayesi olan hastalara tenofovir monoterapisi verilirse hastalar yakından izlenmelidir. Tenofovir disporoksil fumarat temelli ilaç direnci durumunda, lamivudin naif hastalarda entekavire geçiş, lamivudin dirençli hastalarda ise tedaviye entekavir eklenmesi önerilir. Ancak bugüne kadar tanımlanmış tenofovir temelli ilaç direnci bulunmamaktadır (41,93,125).
İki veya daha fazla antiviral ilaç sınıfına direnç olarak tanımlanabilecek çoklu ilaç direnci (ÇİD) ile ilişkili tecrübe ve çalışma azdır. Bu tür hastalar daha çok nükleozid analoğu direnci durumunda adefovir ve entekavir tedavilerini monoterapi şeklinde almış olan hastalardır. Bir çalışmada, ÇİD ve KHB infeksiyonu olan 64 hastada TDF/entekavir kombine tedavisi ile 48 haftanın sonunda saptanamaz HBV DNA oranı %62.5 bulunmuştur (161). Bir başka çalışmada, entekavir ve/veya adefovir direnç mutasyonu olan KHB hastalarında 48. haftada viral yanıt yönünden tek başına TDF alan hastalarla TDF+entekavir alanlar arasında fark bulunmamıştır (%66 ve %68) (159,160). Bu verilere göre ÇİD olan KHB hastaları tek başına TDF temelli ilaçlar ile tedavi edilebilir. Ancak prospektif bir çalışmanın sonucuna göre çoklu direnç veya adefovir direnci nedeniyle kurtarma tedavisi alan KHB hastalarının yaklaşık %25’inde üç yılın sonunda yeterli viral yanıt alınamadığı da bildirilmiştir (160). İlaç direnci durumunda yapılması önerilen tedavi değişiklikleri Tablo 5’te gösterilmiştir.
Tedavi Yanıtına Göre Direncin Yönetimi
Tedavi yanıtını değerlendirmek için, tedavi başlandıktan sonra 3-6 aylık aralarla HBV DNA duyarlı bir yöntemle ölçülmelidir. Viral yanıta ulaşılsa dahi tedavi yanıtının 3-6 aylık aralarla takibine, tedavi hedefine ulaşılıp tedavi kesilinceye değin devam edilmelidir. PEG-INF-α tedavisi sırasında yetersiz viral yanıt varsa (HBeAg negatif hastalarda tedavinin 12 haftasında HBsAg kantitasyonunda hiç düşme olmaması ya da HBV DNA değerinde <2 log azalma olması gibi) tedavinin erken kesilmesi düşünülmelidir (41).
Tedaviye uyumlu parsiyel viral yanıtlı hastalar için çapraz direnç ihtimali olmayan, yüksek direnç bariyerli bir başka nükleoz(t)id anoloğuna geçiş önerilir. Lamivudin tecrübesi ya da direnci olan ve 0.5 mg/gün entekavir alan hastalarda dozun 1 mg/güne yükseltilmesi bir seçenek olsa da bu tür hastalarda entekavir direncinin gelişebileceği düşünülerek TDF ya da TAF’a geçilmesi öncelikli öneridir. Entekavir’e veya TDF’ye parsiyel viral yanıt durumunda HBV DNA takiplerinde düşme devam ediyorsa mevcut tedaviye devam edilebilir; çünkü bu hastaların önemli bir kısmında gecikmeli de olsa viral yanıt alınır (93). Güney Kore’den randomize kontrollü bir çalışmada, 12. ayda entekavire parsiyel viral yanıt gösteren hastalarda TDF’ye geçildiğinde 12 ay sonra %55 oranında viral yanıt alındığı gösterilmiştir (162). Tenofovir disporoksil fumarat başlanan ve 12. ayda parsiyel viral yanıt gösterenlerin önemli bir kısmının tedaviye devam edildiğinde üç sene sonunda yanıt verdikleri görülmüştür (163). Tüm bu nedenlerle parsiyel viral yanıtlı hastalarda tedavi değişikliği için 96 hafta beklenmesi önerilmektedir (41).
Entekavir veya adefovir direnç mutasyonları nedeniyle TDF başlanan hastalarda antiviral etki TDF+entekavir başlanan hastalara benzer bulunmuştur (157-159,164). Bu çalışmalara dayanarak entekavir+TDF kurtarma tedavisi ile viral yanıt elde edilen hastalarda TDF monoterapisine geçiş düşünülebilir. Retrospektif bir Güney Kore çalışmasında bu uygulamanın başarılı olduğu gösterilmiştir (165).
Öneriler
- NA tedavisi sırasında virolojik kırılma gerçekleşirse tedaviye uyum araştırılmalı ve direnç testi yapılmalıdır.
- Antiviral kurtarma tedavisi, virolojik kırılma tesbit edilip genotipik direnç de teyit edilir edilmez başlanmalıdır.
- Lamivudin ve telbivudin gibi nükleozid analoglarına direnç durumunda tenofovir monoterapisine geçilir.
- Adefovir direnci varsa ya TDF monoterapisine ya da TDF/entekavir kombine tedavisine geçilir.
- Entekavir direnci durumunda ya TDF monoterapisine geçilir ya da TDF eklenir.
- TDF temelli tedavilerde direnç bugüne kadar saptanmamıştır. Saptanması durumunda entekavirin eklenmesi ya da tek başına entekavir tedavisine geçilmesi önerilir.
- Çoklu ilaç direnci varsa ya tenofovir/entekavir kombinasyon tedavisine geçilmesi ya da tek başına TDF ya da TAF’a geçilmesi önerilir.
- NA tedavisine parsiyel yanıt gelişen hastalarda hasta uyumu gözden geçirilmelidir.
- Düşük genetik direnç bariyerli ilaçlara parsiyel yanıt varsa çapraz direnç olasılığı olmayan yüksek genetik direnç bariyerli ilaçlardan birine geçilmelidir.
- Yüksek genetik direnç bariyerli ilaçlardan birine parsiyel yanıt varsa tedavi değişikliği için 96 hafta beklenmelidir; bu sürenin sonunda hala HBV DNA negatif olmadıysa tedavi değişikliği düşünülmelidir.
- Ülkemizde baskın olan genotip D hastalarının, PEG-INF-α tedavisi sırasında HBeAg pozitif hastalarda eğer 12. haftada kantitatif HBsAg’de hiç azalma görülmediyse, HBeAg negatif hastalarda ise 12. haftada hem kantitatif HBsAg düzeyinde hiç azalma olmamış hem de HBV-DNA’da 2 log’dan daha az düşüş olmuşsa tedavi erken sonlandırılabilir.
KORUNMA
HBV sadece insanlarda infeksiyon oluşturduğundan, virusun doğadaki bilinen tek kaynağı HBV ile infekte kişilerdir. Kaynağının net olarak bilindiği, korunma önlemlerinin uygulanıp, aşılamanın tüm dünyada uygun şekilde yapılması halinde eradike edilmesi bile teorik olarak mümkün olan bir hastalık olan hepatit B infeksiyonunun halen önemli bir halk sağlığı sorunu olarak varlığını devam ettirmesi yapılan müdahalelerin yetersiz olduğunu göstermektedir. Hepatit B infeksiyonundan korunma, aktif veya pasif immünizasyon şeklinde olabilir (166).
Aktif İmmünizasyon
Aktif immünizasyonda (maruziyet öncesi bağışıklama) hepatit B aşıları kullanılmaktadır. HBV infeksiyonundan korunmada en önemli yol aşılamadır. Dünya Sağlık Örgütü, 1991 yılında, öncellikle HBV endemisitesi yüksek olan ülkelerde; 1997 yılında ise tüm dünyada her yeni doğan bebeğe HBV aşısı yapılmasını önermiştir (167). Ülkemizde ise 1998 yılında ulusal aşılama programına hepatit B aşısı dahil edilmiştir. HBV aşısı önceleri belli riskleri taşıyan kişilere önerilirdi; günümüzde ise öncelikle yüksek riskli gruplar olmak üzere, HBV’den korunmak isteyen herkesin aşılanması görüşü benimsenmektedir (168).
HBV aşıları, HBV’nin rekombinant DNA teknolojisiyle üretilmiş majör yüzey antijenini içerir. Çok sayıda rekombinant aşı vardır. Aşılar hem çocuklarda hem de erişkinlerde oldukça etkin ve güvenilirdir (169). 0, 1 ve 6. aylarda birer doz aşı uygulaması, yaygın olarak kullanılmakta olan aşı şemasıdır; 0, 1, 2 ve 12. aylarda birer doz aşı uygulaması ise hızlı yanıt elde edilmek istendiğinde uygulanan şemadır. Ayrıca 0, 10, 21. günlerde ve 0, 7, 28. günlerde birer aşının yapıldığı ve 12. ayda bir dozun daha uygulandığı, hızlandırılmış aşı şemaları da bulunmaktadır. Aşı dozu çocuklarda 10 µg, erişkinlerde ise 20 µg şeklindedir (170,171). Hemodiyaliz hastalarında ise aşının çift doz (40 µg) olarak 0, 1, 2, 6. aylarda yapılması önerilmektedir (172). Aşılama öncesinde rutin olarak kontrol amaçlı serolojik test yapılması önerilmemektedir. Bununla birlikte; HBsAg pozitif kişilerin ev içi ve cinsel temasları, HIV ile yaşayan kişiler, etiyolojisi bilinmeyen yüksek ALT, AST düzeyine sahip kişiler, hemodiyaliz hastaları, erkeklerle seks yapan erkekler, damar içi madde kullanan veya geçmişte kullanmış olan kişiler, kemoterapi, organ nakli ile ilgili immün baskılama ve romatolojik veya gastroenterolojik bozukluklar için immün baskılayıcı tedaviye ihtiyaç duyan kişiler, kan, plazma, organ, doku veya semen bağışçılarında aşılama öncesi test yapılması (HBsAg, anti HBs, anti HBcIgG) önerilmektedir (172).
Aşılama sonrası koruyucu antikor düzeyinin 10 mlÜ/ml ve üzerinde olması gerekir. Yeterli antikor oluştuğu saptanan kişilerde sonradan antikor düzeyi bu değerin altına veya saptanamayacak düzeylere gelse bile HBV infeksiyonuna karşı koruyuculuğun sürdüğü bilinmektedir. Virusla tekrar karşılaşıldığında bellek hücreleri tarafından antijenik yapı tanınmakta ve antikor yapımı uyarılmaktadır. Bu nedenle immün sisteminde sorunu olmayan kişilere rapel doz önerilmemektedir (170,171). Aşılama sonrasında rutin olarak bağışıklamanın kontrolü için test yapılması önerilmemektedir; ancak sağlık çalışanları, hemodiyaliz hastaları, HIV ile yaşayan kişiler, bağışıklığı baskılanmış diğer kişiler (hematopoietik kök hücre nakli alıcıları veya kemoterapi alanlar, vb.), HBsAg-pozitif kişilerin cinsel partnerleri gibi risk gruplarında aşılama şeması tamamlandıktan 1-2 ay sonra serolojik testler ile kontrol yapılabilir (172). Daha önce eksiksiz, ≥3 doz aşı serileri ile aşılanmış ve aşılama sonrası serolojik testi olmayan sağlık personeli için temas öncesi değerlendirmesinde anti-HBs bakılması ve <10 mlÜ/ml olanlarda bir doz aşı yapıldıktan sonra serolojik kontrol yapılması ve aşı yanıtı olmaması durumunda üç doza tamamlanması önerilmektedir (172).
Pasif İmmünizasyon
Pasif immünizasyonda (maruziyet sonrası bağışıklama) hepatit B immünglobulin (HBIG) kullanılmaktadır. Erişkinlere endikasyon olduğunda tüm uygulamalarda 0.06 ml/kg standart doz, intramüsküler yolla ve tercihen deltoid veya gluteal kasa yapılmalıdır. Eğer HBV aşısı ile aynı anda uygulanması gerekiyorsa enjeksiyonlar farklı bölgelerden yapılmalıdır. Hepatit B immünglobulinin sağladığı koruma geçicidir ve yaklaşık 4-6 ay süresince koruma sağlamaktadır. Temas sonrası korunmada bağışıklamaya başlama zamanı oldukça önemlidir. Perkütan maruziyet sonrası yedi gün içinde, cinsel yolla karşılaşma sonrası 14 gün içinde bağışıklamaya başlanması önerilmektedir (172).
Esas olarak doğum sırasında meydana geldiği kabul edilen ve KHB infeksiyonunun çoğuna neden olan HBV perinatal bulaşmasının önlenmesi, doğumdan sonraki 6-12 saat içinde yapılan 0.5 ml HBIG ve aşılamanın birlikte uygulanması ile mümkün olabilir. Bu profilaksi, perinatal bulaşma riskini düşürür; HBIG ve aşı başarısızlıkları neredeyse sadece yüksek HBV DNA düzeylerine (200 000 İÜ/ml) sahip HBeAg-pozitif kadınlarda görülür (41). Düşük doğum ağırlıklı bebeklerin (<2000 g) yetersiz aşı yanıtları olabileceğinden, HBsAg pozitif kadınların düşük doğum ağırlıklı bebeklerine doğumdan sonraki 12 saat içinde HBIG ve HBV aşısı yapılarak ardından bir aylıktan başlayarak, toplam dört doz aşılama uygulanması aşı yanıtını artırabilir (58).
HBV ile teması olan sağlık çalışanlarında bağışıklık durumuna göre profilaksi önerileri bulunmaktadır. Maruz kalan kişi daha önce aşı olmuş ve anti-HBs titresi ≥10 İÜ/ml ise profilaksi yapılmasına gerek yokken anti-HBs titresi <10 İÜ/ml ise hem HBIG hem de aşı yapılması gereklidir (Tablo 6)
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – N.D.; Tasarım – N.D., A.K., O.U.; Denetleme – N.D., A.K.; Kaynak ve Fon Sağlama – N.D., A.K., O.U., A.A., Ş.B., Ş.S., F.Ş., N.T.; Malzemeler/Hastalar – N.D., A.K., O.U., A.A., Ş.B., Ş.S., F.Ş., N.T.; Veri Toplama ve/veya İşleme – N.D., A.K., O.U., A.A., Ş.B., Ş.S., F.Ş., N.T.; Analiz ve/veya Yorum – N.D., A.K., O.U., A.A., Ş.B., Ş.S., F.Ş., N.T.; Literatür Taraması – N.D., A.K., O.U., A.A., Ş.B., Ş.S., F.Ş., N.T.; Makale Yazımı – N.D., A.K.; Eleştirel İnceleme – N.D.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Hepatitis B [Internet]. Geneva: World Health Organization (WHO). Hepatitis B. [erişim 24 Haziran 2022]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-b
- Global Hepatitis Report 2017 [Internet]. Geneva: World Health Organization (WHO). [erişim 17 Haziran 2022]. https://www.who.int/publications/i/item/9789241565455
- Chen CL, Yang JY, Lin SF, et al. Slow decline of hepatitis B burden in general population: Results from a population-based survey and longitudinal follow-up study in Taiwan. J Hepatol. 2015;63(2):354-63. [CrossRef]
- Hampel A, Solbach P, Cornberg M, Schmidt RE, Behrens GM, Jablonka A. [Current seroprevalence, vaccination and predictive value of liver enzymes for hepatitis B among refugees in Germany]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2016;59(5):578-83. German. [CrossRef]
- Burns GS, Thompson AJ. Viral hepatitis B: clinical and epidemiological characteristics. Cold Spring Harb Perspect Med. 2014;4(12):a024935. [CrossRef]
- Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection, March 2015 [Internet]. Geneva: World Health Organization (WHO). [erişim 17 Haziran 2022]. https://iris.who.int/bitstream/handle/10665/154590/9789241549059.?sequence=1
- Tosun S. Türkiye’de viral hepatit B epidemiyolojisi-Yayınların metaanalizi. In: Tabak F, Tosun S, eds. Viral Hepatit-2013. İstanbul: Viral Hepatitle Savaşım Derneği Yayını, İstanbul Tıp Kitapevi, 2013: 25-81.
- Inoue T, Tanaka Y. Hepatitis B virus and its sexually transmitted infection – an update. Microb Cell. 2016;3(9):420-37. [CrossRef]
- Hou J, Liu Z, Gu F. Epidemiology and prevention of hepatitis B virus infection. Int J Med Sci. 2005;2(1):50-7. [CrossRef]
- Guidelines on assessing donor suitability for blood donation, 2012 [Internet]. Geneva: World Health Organization (WHO). [erişim 24 Haziran 2022]. https://apps.who.int/iris/bitstream/handle/10665/76724/9789241548519_eng.pdf
- Stramer SL, Notari EP, Krysztof DE, Dodd RY. Hepatitis B virus testing by minipool nucleic acid testing: does it improve blood safety? Transfusion. 2013;53(10 Pt 2):2449-58. [CrossRef]
- Tozun N, Ozdogan O, Cakaloglu Y, et al. Seroprevalence of hepatitis B and C virus infections and risk factors in Turkey: a fieldwork TURHEP study. Clin Microbiol Infect. 2015;21(11):1020-6. [CrossRef]
- Liu Z, Zhang Y, Xu M, Li X, Zhang Z. Distribution of hepatitis B virus genotypes and subgenotypes: A meta-analysis. Medicine (Baltimore). 2021;100(50):e27941. [CrossRef]
- Kramvis A, Kew M, François G. Hepatitis B virus genotypes. Vaccine. 2005;23(19):2409-23. [CrossRef]
- Bozdayı G, Türkyılmaz AR, İdilman R, et al. Complete genome sequence and phylogenetic analysis of hepatitis B virus isolated from Turkish patients with chronic HBV infection. J Med Virol. 2005;76(4):476-81. [CrossRef]
- Kim BK, Revill PA, Ahn SH. HBV genotypes: relevance to natural history, pathogenesis and treatment of chronic hepatitis B. Antivir Ther. 2011;16(8):1169-86. [CrossRef]
- McMahon BJ. The influence of hepatitis B virus genotype and subgenotype on the natural history of chronic hepatitis B. Hepatol Int. 2009;3(2):334-42. [CrossRef]
- Türkiye viral hepatit önlem ve kontrol programı 2018-2023. Ankara: T.C. Sağlık Bakanlığı. [erişim 09 Mayıs 2023]. https://hsgm.saglik.gov.tr/depo/Yayinlarimiz/Programlar/Turkiye_Viral_Hepatit_Onleme_ve_Kontrol_Programi_2018-2023.pdf
- Tosun S. Dünyada ve Türkiye’de viral hepatit B epidemiyolojisi. In: Tabak F, Güner R, eds. Viral Hepatit-2018. İstanbul: Viral Hepatitle Savaşım Derneği Yayını, İstanbul Tıp Kitapevi, 2018: 13-33.
- Uluturk R. Kan donörlerinde yapılan rutin tarama testlerinin 11 yıllık değerlendirilmesi. Türk Mikrobiyol Cemiy Derg. 2010;40(1):41-7.
- Ozsoy MF, Oncul O, Cavuslu S, Erdemoglu A, Emekdas G, Pahsa A. Seroprevalences of hepatitis B and C among health care workers in Turkey. J Viral Hepat. 2003;10(2):150-6. [CrossRef]
- Toy M, Önder FO, Wörmann T, et al. Age- and region-specific hepatitis B prevalence in Turkey estimated using generalized linear mixed models: a systematic review. BMC Infect Dis. 2011;11:337. [CrossRef]
- Mıstık R. Türkiye’de viral hepatit epidemiyolojisi – Yayınların irdelenmesi. Tabak F, Balık İ, Tekeli E (eds). Viral Hepatit-2007. Viral Hepatitle Savaşım Derneği Yayını, İstanbul, 2007:9-50.
- Korkmaz P, Çağlan-Çevik F, Aykın N, et al. [Seroprevalences of HBV, HAV, HCV and HIV infection among health personnel in a state hospital]. Klimik Derg. 2013;26(2):64-7. Turkish. [CrossRef]
- Tekin-Koruk S, Koruk İ, Şahin M, et al. [Evaluation of HBsAg, anti-HBs and anti-HCV positivity and risk factors among oral and dental health workers in Şanlıurfa]. Klimik Derg. 2009;22(2):55-61. Turkish.
- Arıkan A, Şanlıdağ Tamer. [Molecular epidemiology of hepatitis B virus]. Klimik Derg. 2016;29(2):56-9. Turkish. [CrossRef]
- Schweitzer A, Horn J, Mikolajczyk RT, Krause G, Ott JJ. Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet. 2015;386(10003):1546-55. [CrossRef]
- Global health sector strategies on, respectively, HIV, viral hepatitis and sexually transmitted infections for the period 2022-2030 [Internet]. Geneva: World Health Organization (WHO). [erişim 9 Mayıs 2023]. https://iris.who.int/bitstream/handle/10665/360348/9789240053779-eng.pdf?sequence=1
- Wu JF, Chang MH. Natural history of chronic hepatitis B virus infection from infancy to adult life – the mechanism of inflammation triggering and long-term impacts. J Biomed Sci. 2015;22:92. [CrossRef]
- Değertekin B. [Natural history, pathogenesis and clinical course of hepatitis B infection]. Turkiye Klinikleri J Gastroenterohepatol-Special Topics. 2010;3(1):45-52. Turkish.
- Yapali S, Talaat N, Lok AS. Management of hepatitis B: our practice and how it relates to the guidelines. Clin Gastroenterol Hepatol. 2014;12(1):16-26. [CrossRef]
- Sümer Ş, Ural O. Akut Viral Hepatitler. In: Wilke Topçu A, Söyletir G, Doğanay M, eds. İnfeksiyon Hastalıkları ve Mikrobiyolojisi. 4. Baskı. İstanbul: Nobel Tıp Kitabevleri, 2017: 1077-83.
- Iannacone M, Sitia G, Ruggeri ZM, Guidotti LG. HBV pathogenesis in animal models: recent advances on the role of platelets. J Hepatol. 2007;46(4):719-26. [CrossRef]
- Busch K, Thimme R. Natural history of chronic hepatitis B virus infection. Med Microbiol Immunol. 2015;204(1):5-10. [CrossRef]
- Maini MK, Boni C, Ogg GS, et al. Direct ex vivo analysis of hepatitis B virus-specific CD8(+) T cells associated with the control of infection. Gastroenterology. 1999;117(6):1386-96. [CrossRef]
- Rehermann B, Ferrari C, Pasquinelli C, Chisari FV. The hepatitis B virus persists for decades after patients’ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med. 1996;2(10):1104-8. [CrossRef]
- Dienstang JL. Akut Viral Hepatitis. In: Kasper D, Fauci A, Hauser S, Longo D, Jameson J, Loscalzo J, eds. Harrison’s Principles of Internal Medicine. 19th ed. New York: McGraw Hill, 2014: 1124-36.
- İnan N, Tabak F. Hepatit B virüsü ve immünopatogenez. In: Güner R, Tabak F, eds. Viral Hepatit. 1. Baskı. İstanbul: İstanbul Tıp Kitabevleri, 2018: 157-165.
- Yamazhan T. HBV infeksiyonunda klinik tablolar. In: Kandemir Ö, Danalıoğlu A, eds. Hepatit B’den D’ye Hep Güncel Klinik El Kitabı. İstanbul: İstanbul Tıp Kitabevleri, 2015: 52-7.
- Seto WK, Lo YR, Pawlotsky JM, Yuen MF. Chronic hepatitis B virus infection. Lancet. 2018;392(10161):2313-24. [CrossRef]
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Akhan S, Aynıoğlu A, Çağatay A, et al. [Management of chronic hepatitis B virus infection: A consensus report of the Study Group for Viral Hepatitis of the Turkish Society of Clinical Microbiology and Infectious Diseases]. Klimik Derg. 2014;27(özel sayı 1):2-18. Turkish. [CrossRef]
- Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int. 2016;10(1):1-98. [CrossRef]
- Croagh CM, Lubel JS. Natural history of chronic hepatitis B: phases in a complex relationship. World J Gastroenterol. 2014;20(30):10395-404. [CrossRef]
- Kıratlı HE, Sümer Ş, Aktuğ Demir N. Hepatit B enfeksiyonunda doğal seyir. In: Demirtürk N, ed. Hepatit B Virüs Enfeksiyonu. Ankara: Türkiye Klinikleri; 2022: 11-5.
- Kao JH, Chen PJ, Lai MY, Chen DS. Hepatitis B virus genotypes and spontaneous hepatitis B e antigen seroconversion in Taiwanese hepatitis B carriers. J Med Virol. 2004;72(3):363-9. [CrossRef]
- Livingston SE, Simonetti JP, Bulkow LR, et al. Clearance of hepatitis B e antigen in patients with chronic hepatitis B and genotypes A, B, C, D, and F. Gastroenterology. 2007;133(5):1452-7. [CrossRef]
- Lin CL, Kao JH. Hepatitis B viral factors and clinical outcomes of chronic hepatitis B. J Biomed Sci. 2008;15(2):137-45. [CrossRef]
- Huo T, Wu JC, Hwang SJ, et al. Factors predictive of liver cirrhosis in patients with chronic hepatitis B: a multivariate analysis in a longitudinal study. Eur J Gastroenterol Hepatol. 2000;12(6):687-93. [CrossRef]
- Yuen MF, Yuan HJ, Wong DK, et al. Prognostic determinants for chronic hepatitis B in Asians: therapeutic implications. Gut. 2005;54(11):1610-4. [CrossRef]
- Chen G, Lin W, Shen F, Iloeje UH, London WT, Evans AA. Past HBV viral load as predictor of mortality and morbidity from HCC and chronic liver disease in a prospective study. Am J Gastroenterol. 2006;101(8):1797-803. [CrossRef]
- Raffetti E, Fattovich G, Donato F. Incidence of hepatocellular carcinoma in untreated subjects with chronic hepatitis B: a systematic review and meta-analysis. Liver Int. 2016;36(9):1239-51. [CrossRef]
- Varbobitis I, Papatheodoridis GV. The assessment of hepatocellular carcinoma risk in patients with chronic hepatitis B under antiviral therapy. Clin Mol Hepatol. 2016;22(3):319-26. [CrossRef]
- Coffin CS, Zhou K, Terrault NA. New and old biomarkers for diagnosis and management of chronic hepatitis B virus infection. Gastroenterology. 2019;156(2):355-68.e3. [CrossRef]
- Örmen B. Hepatit B virüs tanı testleri. In: Akhan S, ed. Hepatit B Rehber Güncelleme, Uzlaşı Raporu. İstanbul: Metsis Matbaa Hizmetleri San ve Tic Ltd Şti, 2021: 19-22.
- Altındiş M. Kronik hepatitlerde güncel tanı testleri. In: Güner R, Tabak F, eds. Viral Hepatit. İstanbul : İstanbul Medikal Sağlık ve Yayıncılık, 2018: 75-92.
- Hatipoğlu-Ataman Ç. Karaciğer testleri ve klinik kullanımları. In: Güner R, Tabak F, eds. Viral Hepatit. İstanbul : İstanbul Medikal Sağlık ve Yayıncılık, 2018:57-73.
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99. [CrossRef]
- Nguyen MH, Wong G, Gane E, Kao JH, Dusheiko G. Hepatitis B virus: advances in prevention, diagnosis, and therapy. Clin Microbiol Rev. 2020;33(2):e00046-19. [CrossRef]
- Marcellin P, Buti M, Krastev Z, et al. Kinetics of hepatitis B surface antigen loss in patients with HBeAg-positive chronic hepatitis B treated with tenofovir disoproxil fumarate. J Hepatol. 2014;61(6):1228-37. [CrossRef]
- Wooddell CI, Yuen MF, Chan HL, et al. RNAi-based treatment of chronically infected patients and chimpanzees reveals that integrated hepatitis B virus DNA is a source of HBsAg. Sci Transl Med. 2017;9(409):eaan0241. [CrossRef]
- Wursthorn K, Jaroszewicz J, Zacher BJ, et al. Correlation between the Elecsys HBsAg II assay and the Architect assay for the quantification of hepatitis B surface antigen (HBsAg) in the serum. J Clin Virol. 2011;50(4):292-6. [CrossRef]
- Cornberg M, Wong VW, Locarnini S, Brunetto M, Janssen HLA, Chan HL. The role of quantitative hepatitis B surface antigen revisited. J Hepatol. 2017;66(2):398-411. [CrossRef]
- Liu J, Yang HI, Lee MH, et al. Serum levels of hepatitis B surface antigen and DNA can predict inactive carriers with low risk of disease progression. Hepatology. 2016;64(2):381-9. [CrossRef]
- Rijckborst V, Hansen BE, Ferenci P, et al. Validation of a stopping rule at week 12 using HBsAg and HBV DNA for HBeAg-negative patients treated with peginterferon alfa-2a. J Hepatol. 2012;56(5):1006-11. [CrossRef]
- Wen WH, Huang CW, Chie WC, et al. Quantitative maternal hepatitis B surface antigen predicts maternally transmitted hepatitis B virus infection. Hepatology. 2016;64(5):1451-61. [CrossRef]
- Tseng TC, Liu CJ, Yang HC, et al. High levels of hepatitis B surface antigen increase risk of hepatocellular carcinoma in patients with low HBV load. Gastroenterology. 2012;142(5):1140-9.e3. [CrossRef]
- Giersch K, Allweiss L, Volz T, Dandri M, Lütgehetmann M. Serum HBV pgRNA as a clinical marker for cccDNA activity. J Hepatol. 2017;66(2):460-2. [CrossRef]
- Mak LY, Wong DK, Cheung KS, Seto WK, Lai CL, Yuen MF. Review article: hepatitis B core-related antigen (HBcrAg): an emerging marker for chronic hepatitis B virus infection. Aliment Pharmacol Ther. 2018;47(1):43-54. [CrossRef]
- Gao YH, Meng QH, Zhang ZQ, et al. On-treatment quantitative hepatitis B e antigen predicted response to nucleos(t)ide analogues in chronic hepatitis B. World J Hepatol. 2016;8(34):1511-20. [CrossRef]
- Yuan Q, Song LW, Liu CJ, et al. Quantitative hepatitis B core antibody level may help predict treatment response in chronic hepatitis B patients. Gut. 2013;62(1):182-4. [CrossRef]
- Li J, Zhang TY, Song LW, et al. Role of quantitative hepatitis B core antibody levels in predicting significant liver inflammation in chronic hepatitis B patients with normal or near-normal alanine aminotransferase levels. Hepatol Res. 2018;48(3):133-45. [CrossRef]
- Yılmaz G, Kostakoğlu U. Kronik hepatit tanısında invaziv olmayan testlerin karşılaştırılması. In: Güner R, Tabak F, eds. Viral Hepatit. İstanbul: İstanbul Medikal Sağlık ve Yayıncılık, 2018: 109-22.
- Leroy V, Chevaliez S, Decraecker M, et al. Non-invasive diagnosis and follow-up of chronic infection with hepatitis B virus. Clin Res Hepatol Gastroenterol. 2022;46(8):101773. [CrossRef]
- Ziol M, Handra-Luca A, Kettaneh A, et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology. 2005;41(1):48-54. [CrossRef]
- Manduca A, Oliphant TE, Dresner MA, et al. Magnetic resonance elastography: non-invasive mapping of tissue elasticity. Med Image Anal. 2001;5(4):237-54. [CrossRef]
- Huwart L, van Beers BE. MR elastography. Gastroenterol Clin Biol. 2008;32(6 Suppl 1):68-72. [CrossRef]
- Rockey DC, Bissell DM. Noninvasive measures of liver fibrosis. Hepatology. 2006;43(2 Suppl 1):S113-20. [CrossRef]
- Lok ASF. Hepatitis B virüs: Screening and diagnosis in adults [Internet]. Wolters Kluwer: UpToDate. [erişim 01 Aralık 2022]. https://www.uptodate.com/contents/hepatitis-b-virus-screening-and-diagnosis-in-adults
- Korkmaz P, Demirturk N, Batırel A, et al. Noninvazive models to predict liver fibrosis in patients with chronic hepatitis B: A study from Turkey. Hepat Mon. 2017;17(12):e60266. [CrossRef]
- Hoofnagle JH. Reactivation of hepatitis B. Hepatology. 2009;49(5 Suppl):S156-65. [CrossRef]
- Puri P. Acute exacerbation of chronic hepatitis B: The dilemma of differentiation from acute viral hepatitis B. J Clin Exp Hepatol. 2013;3(4):301-12. [CrossRef]
- Korean Association for the Study of the Liver (KASL). Erratum to ‘KASL clinical practice guidelines for management of chronic hepatitis B’ [Clin Mol Hepatol 2022;28:276-331]. Clin Mol Hepatol. 2022;28(4):940. Erratum for: Clin Mol Hepatol. 2022;28(2):276-331. [CrossRef]
- Wong GL. Management of chronic hepatitis B patients in immunetolerant phase: what latest guidelines recommend. Clin Mol Hepatol. 2018;24(2):108-13. [CrossRef]
- Lee HA, Lee HW, Kim IH, et al. Extremely low risk of hepatocellular carcinoma development in patients with chronic hepatitis B in immune-tolerant phase. Aliment Pharmacol Ther. 2020;52(1):196-204. [CrossRef]
- Lee HW, Kim SU, Baatarkhuu O, et al. Comparison between chronic hepatitis B patients with untreated immune-tolerant phase vs. those with virological response by antivirals. Sci Rep. 2019;9(1):2508. Erratum in: Sci Rep. 2019;9(1):17518. [CrossRef]
- Jeon MY, Kim BK, Lee JS, et al. Negligible risks of hepatocellular carcinoma during biomarker-defined immune-tolerant phase for patients with chronic hepatitis B. Clin Mol Hepatol. 2021;27(2):295-304. [CrossRef]
- Kim GA, Lim YS, Han S, et al. High risk of hepatocellular carcinoma and death in patients with immune-tolerant-phase chronic hepatitis B. Gut. 2018;67(5):945-52. [CrossRef]
- Sinn DH, Lee JH, Kim K, et al. A novel model for predicting hepatocellular carcinoma development in patients with chronic hepatitis B and normal alanine aminotransferase levels. Gut Liver. 2017;11(4):528-34. [CrossRef]
- Kim MN, Kim SU, Kim BK, et al. Increased risk of hepatocellular carcinoma in chronic hepatitis B patients with transient elastography-defined subclinical cirrhosis. Hepatology. 2015;61(6):1851-9. [CrossRef]
- Wong VW, Hui AJ, Wong GL, et al. Four-year outcomes after cessation of tenofovir in immune-tolerant chronic hepatitis B patients. J Clin Gastroenterol. 2018;52(4):347-52. [CrossRef]
- Lok AS, McMahon BJ, Brown RS Jr, et al. Antiviral therapy for chronic hepatitis B viral infection in adults: A systematic review and meta-analysis. Hepatology. 2016;63(1):284-306. [CrossRef]
- Korean Association for the Study of the Liver (KASL). KASL clinical practice guidelines for management of chronic hepatitis B. Clin Mol Hepatol. 2019;25(2):93-159. [CrossRef]
- Chen CF, Lee WC, Yang HI, et al; Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer in HBV (REVEAL–HBV) Study Group. Changes in serum levels of HBV DNA and alanine aminotransferase determine risk for hepatocellular carcinoma. Gastroenterology. 2011;141(4):1240-8.[CrossRef]
- European Association for Study of Liver; Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol. 2015;63(1):237-64. [CrossRef]
- Loomba R, Liang TJ. Hepatitis B reactivation associated with immune suppressive and biological modifier therapies: current concepts, management strategies, and future directions. Gastroenterology. 2017;152(6):1297-309. [CrossRef]
- Choi GH, Kim GA, Choi J, Han S, Lim YS. High risk of clinical events in untreated HBeAg-negative chronic hepatitis B patients with high viral load and no significant ALT elevation. Aliment Pharmacol Ther. 2019;50(2):215-26. [CrossRef]
- Barut S, Gemici Ü, Güneş F, Demir O, Duygu F. Predictors of histological indication for treatment in HBeAg negative chronic HBV infection. J Med Virol. 2017;89(11):1952-7. [CrossRef]
- Chen CJ, Yang HI, Su J, et al; REVEAL-HBV Study Group. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA. 2006;295(1):65-73. [CrossRef]
- Yao K, Liu J, Wang J, et al. Distribution and clinical characteristics of patients with chronic hepatitis B virus infection in the grey zone. J Viral Hepat. 2021;28(7):1025-33. [CrossRef]
- Sinn DH, Kim SE, Kim BK, Kim JH, Choi MS. The risk of hepatocellular carcinoma among chronic hepatitis B virus-infected patients outside current treatment criteria. J Viral Hepat. 2019;26(12):1465-72. [CrossRef]
- Paik N, Sinn DH, Lee JH, et al. Non-invasive tests for liver disease severity and the hepatocellular carcinoma risk in chronic hepatitis B patients with low-level viremia. Liver Int. 2018;38(1):68-75. [CrossRef]
- Marcellin P, Gane E, Buti M, et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet. 2013;381(9865):468-75. [CrossRef]
- Chang TT, Liaw YF, Wu SS, et al. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology. 2010;52(3):886-93. [CrossRef]
- Lee J, Sinn DH, Kim JH, et al. Hepatocellular carcinoma risk of compensated cirrhosis patients with elevated HBV DNA levels according to serum aminotransferase levels. J Korean Med Sci. 2015;30(11):1618-24. [CrossRef]
- Kim JH, Sinn DH, Kang W, et al. Low-level viremia and the increased risk of hepatocellular carcinoma in patients receiving entecavir treatment. Hepatology. 2017;66(2):335-43. [CrossRef]
- Sinn DH, Lee J, Goo J, et al. Hepatocellular carcinoma risk in chronic hepatitis B virus-infected compensated cirrhosis patients with low viral load. Hepatology. 2015;62(3):694-701. [CrossRef]
- Cho YY, Lee JH, Chang Y, et al. Comparison of overall survival between antiviral-induced viral suppression and inactive phase chronic hepatitis B patients. J Viral Hepat. 2018;25(10):1161-71. [CrossRef]
- Janssen HL, van Zonneveld M, Senturk H, et al; HBV 99-01 Study Group; Rotterdam Foundation for Liver Research. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet. 2005;365(9454):123-9. [CrossRef]
- Li WC, Wang MR, Kong LB, Ren WG, Zhang YG, Nan YM. Peginterferon alpha-based therapy for chronic hepatitis B focusing on HBsAg clearance or seroconversion: a meta-analysis of controlled clinical trials. BMC Infect Dis. 2011;11:165. [CrossRef]
- Viganò M, Grossi G, Loglio A, Lampertico P. Treatment of hepatitis B: Is there still a role for interferon? Liver Int. 2018;38 Suppl 1:79-83. [CrossRef]
- Agarwal K, Brunetto M, Seto WK, et al; GS-US-320-0110; GS-US-320-0108 Investigators. 96 weeks treatment of tenofovir alafenamide vs. tenofovir disoproxil fumarate for hepatitis B virus infection. J Hepatol. 2018;68(4):672-81. [CrossRef]
- Chan HL, Fung S, Seto WK, et al; GS-US-320-0110 Investigators. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of HBeAg-positive chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol. 2016;1(3):185-95. Erratum in: Lancet Gastroenterol Hepatol. 2016;1(3):e2. [CrossRef]
- Buti M, Gane E, Seto WK, et al; GS-US-320-0108 Investigators. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg-negative chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol. 2016;1(3):196-206. Erratum in: Lancet Gastroenterol Hepatol. 2016;1(3):e2. [CrossRef]
- Seto WK, Asahina Y, Brown TT, et al. Improved bone safety of tenofovir alafenamide compared to tenofovir disoproxil fumarate over 2 years in patients with chronic HBV infection. Clin Gastroenterol Hepatol. 2018:S1542-3565(18)30633-5. [CrossRef]
- Hou JL, Zhao W, Lee C, et al. Outcomes of long-term treatment of chronic HBV infection with entecavir or other agents from a randomized trial in 24 countries. Clin Gastroenterol Hepatol. 2020;18(2):457-67.e21. [CrossRef]
- Liu Y, Corsa AC, Buti M, et al. No detectable resistance to tenofovir disoproxil fumarate in HBeAg+ and HBeAg- patients with chronic hepatitis B after 8 years of treatment. J Viral Hepat. 2017;24(1):68-74. [CrossRef]
- Lam YF, Seto WK, Wong D, et al. Seven-year treatment outcome of entecavir in a real-world cohort: effects on clinical parameters, HBsAg and HBcrAg levels. Clin Transl Gastroenterol. 2017;8(10):e125. [CrossRef]
- Ahn S, Kim W, Jung YK, et al. Safety and efficacy of besifovir in treatment-naïve chronic hepatitis B virus infection: a randomized, double-blind, double dummy, phase 3 study. J Hepatol. 2017;66(1):88-9. [CrossRef]
- Lau GK, Piratvisuth T, Luo KX, et al; Peginterferon Alfa-2a HBeAg-Positive Chronic Hepatitis B Study Group. Peginterferon alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med. 2005;352(26):2682-95. [CrossRef]
- Marcellin P, Lau GK, Bonino F, et al; Peginterferon Alfa-2a HBeAg-Negative Chronic Hepatitis B Study Group. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B. N Engl J Med. 2004;351(12):1206-17. [CrossRef]
- Chan HL, Leung NW, Hui AY, et al. A randomized, controlled trial of combination therapy for chronic hepatitis B: comparing pegylated interferon-alpha2b and lamivudine with lamivudine alone. Ann Intern Med. 2005;142(4):240-50. [CrossRef]
- Buster EH, Flink HJ, Cakaloglu Y, et al. Sustained HBeAg and HBsAg loss after long-term follow-up of HBeAg-positive patients treated with peginterferon alpha-2b. Gastroenterology. 2008;135(2):459-67. [CrossRef]
- Liaw YF, Jia JD, Chan HL, et al. Shorter durations and lower doses of peginterferon alfa-2a are associated with inferior hepatitis B e antigen seroconversion rates in hepatitis B virus genotypes B or C. Hepatology. 2011;54(5):1591-9. [CrossRef]
- Choi HSJ, van Campenhout MJH, van Vuuren AJ, et al. Ultra-Long-term follow-up of interferon alfa treatment for HBeAg-positive chronic hepatitis B virus infection. Clin Gastroenterol Hepatol. 2021;19(9):1933-40.e1. [CrossRef]
- Marcellin P, Bonino F, Lau GK, Farci P, et al; Peginterferon alfa-2a in HBeAg-negative Chronic Hepatitis B Study Group. Sustained response of hepatitis B e antigen-negative patients 3 years after treatment with peginterferon alpha-2a. Gastroenterology. 2009;136(7):2169-79.e1-4. [CrossRef]
- Chon YE, Kim DJ, Kim SG, et al. An observational, multicenter, cohort study evaluating the antiviral efficacy and safety in Korean patients with chronic hepatitis b receiving pegylated interferon-alpha 2a (Pegasys): TRACES Study. Medicine (Baltimore). 2016;95(14):e3026. [CrossRef]
- European Association for the Study of the Liver. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection. J Hepatol. 2012;57(1):167-85. Erratum in: J Hepatol. 2013;58(1):201. Janssen, Harry [corrected to Janssen, Harry L A]. [CrossRef]
- Buti M, Tsai N, Petersen J, et al. Seven-year efficacy and safety of treatment with tenofovir disoproxil fumarate for chronic hepatitis B virus infection. Dig Dis Sci. 2015;60(5):1457-64. [CrossRef]
- Lampertico P, Chan HL, Janssen HL, Strasser SI, Schindler R, Berg T. Review article: long-term safety of nucleoside and nucleotide analogues in HBV-monoinfected patients. Aliment Pharmacol Ther. 2016;44(1):16-34. [CrossRef]
- Maggi P, Montinaro V, Leone A, et al. Bone and kidney toxicity induced by nucleotide analogues in patients affected by HBV-related chronic hepatitis: a longitudinal study. J Antimicrob Chemother. 2015;70(4):1150-4. [CrossRef]
- Kaewdech A, Tangkijvanich P, Sripongpun P, et al. Hepatitis B surface antigen, core-related antigen and HBV RNA: Predicting clinical relapse after NA therapy discontinuation. Liver Int. 2020;40(12):2961-71. [CrossRef]
- Lee HW, Ahn SH, Chan HL. Hepatitis B core-related antigen: from virology to clinical application. Semin Liver Dis. 2021;41(2):182-90. [CrossRef]
- Liu S, Zhou B, Valdes JD, Sun J, Guo H. Serum hepatitis B virus RNA: A new potential biomarker for chronic hepatitis B virus infection. Hepatology. 2019;69(4):1816-27. [CrossRef]
- Kao JH, Jeng WJ, Ning Q, et al. APASL guidance on stopping nucleos(t)ide analogues in chronic hepatitis B patients. Hepatol Int. 2021;15(4):833-51. [CrossRef]
- van Bömmel F, Berg T. Risks and benefits of discontinuation of nucleos(t)ide analogue treatment: a treatment concept for patients with HBeAg-negative chronic hepatitis B. Hepatol Commun. 2021;5(10):1632-48. [CrossRef]
- Liem KS, Gehring AJ, Feld JJ, Janssen HLA. Challenges with stopping long-term nucleos(t)ide analogue therapy in patients with chronic hepatitis B. Gastroenterology. 2020;158(5):1185-90. [CrossRef]
- Hall SAL, Vogrin S, Wawryk O, et al. Discontinuation of nucleot(s)ide analogue therapy in HBeAg-negative chronic hepatitis B: a meta-analysis. Gut. 2022;71(8):1629-41. [CrossRef]
- Tout I, Lampertico P, Berg T, Asselah T. Perspectives on stopping nucleos(t)ide analogues therapy in patients with chronic hepatitis B. Antiviral Res. 2021;185:104992. [CrossRef]
- Chao DT, Lim JK, Ayoub WS, Nguyen LH, Nguyen MH. Systematic review with meta-analysis: the proportion of chronic hepatitis B patients with normal alanine transaminase ≤ 40 IU/L and significant hepatic fibrosis. Aliment Pharmacol Ther. 2014;39(4):349-58. [CrossRef]
- Iloeje UH, Yang HI, Su J, Jen CL, You SL, Chen CJ; Risk Evaluation of Viral Load Elevation and Associated Liver Disease/Cancer-In HBV (the REVEAL-HBV) Study Group. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology. 2006;130(3):678-86. [CrossRef]
- Papatheodoridis G, Vlachogiannakos I, Cholongitas E, et al. Discontinuation of oral antivirals in chronic hepatitis B: A systematic review. Hepatology. 2016;63(5):1481-92. [CrossRef]
- Gara N, Tana MM, Kattapuram M, et al. Prospective study of withdrawal of antiviral therapy in patients with chronic hepatitis B after prolonged virological response. Hepatol Commun. 2021;5(11):1888-900. [CrossRef]
- Liu J, Li T, Zhang L, Xu A. The role of hepatitis B surface antigen in nucleos(t)ide analogues cessation among Asian patients with chronic hepatitis B: a systematic review. Hepatology. 2019;70(3):1045-55. [CrossRef]
- Chen CH, Lu SN, Hung CH, et al. The role of hepatitis B surface antigen quantification in predicting HBsAg loss and HBV relapse after discontinuation of lamivudine treatment. J Hepatol. 2014;61(3):515-22. [CrossRef]
- Jeng WJ, Chen YC, Chien RN, Sheen IS, Liaw YF. Incidence and predictors of hepatitis B surface antigen seroclearance after cessation of nucleos(t)ide analogue therapy in hepatitis B e antigen-negative chronic hepatitis B. Hepatology. 2018;68(2):425-34. [CrossRef]
- Chen CH, Hsu YC, Lu SN, et al. The incidence and predictors of HBV relapse after cessation of tenofovir therapy in chronic hepatitis B patients. J Viral Hepat. 2018;25(5):590-7. [CrossRef]
- Inoue T, Tanaka Y. Novel biomarkers for the management of chronic hepatitis B. Clin Mol Hepatol. 2020;26(3):261-79. [CrossRef]
- Drafting Committee for Hepatitis Management Guidelines, the Japan Society of Hepatology. Japan Society of Hepatology Guidelines for the Management of Hepatitis B Virus Infection: 2019 update. Hepatol Res. 2020;50(8):892-923. [CrossRef]
- Kim JH, Lee YS, Lee HJ, et al. HBsAg seroclearance in chronic hepatitis B: implications for hepatocellular carcinoma. J Clin Gastroenterol. 2011;45(1):64-8. [CrossRef]
- Kim GA, Lim YS, An J, et al. HBsAg seroclearance after nucleoside analogue therapy in patients with chronic hepatitis B: clinical outcomes and durability. Gut. 2014;63(8):1325-32. [CrossRef]
- Choi J, Yoo S, Lim YS. Comparison of long-term clinical outcomes between spontaneous and therapy-induced HBsAg seroclearance. Hepatology. 2021;73(6):2155-66. [CrossRef]
- Park Y, Lee JH, Sinn DH, et al. Risk and risk score performance of hepatocellular carcinoma development in patients with hepatitis B surface antigen seroclearance. Clin Transl Gastroenterol. 2021;12(1):e00290. [CrossRef]
- Yip TC, Wong GL, Wong VW, et al. Durability of hepatitis B surface antigen seroclearance in untreated and nucleos(t)ide analogue-treated patients. J Hepatol. 2017:S0168-8278(17)32332-2. [CrossRef]
- Kim MA, Kim SU, Sinn DH, et al. Discontinuation of nucleos(t)ide analogues is not associated with a higher risk of HBsAg seroreversion after antiviral-induced HBsAg seroclearance: a nationwide multicentre study. Gut. 2020;69(12):2214-22. [CrossRef]
- Jang JW, Kim JS, Kim HS, et al. Persistence of intrahepatic hepatitis B virus DNA integration in patients developing hepatocellular carcinoma after hepatitis B surface antigen seroclearance. Clin Mol Hepatol. 2021;27(1):207-18. [CrossRef]
- Lim YS, Byun KS, Yoo BC, et al. Tenofovir monotherapy versus tenofovir and entecavir combination therapy in patients with entecavir-resistant chronic hepatitis B with multiple drug failure: results of a randomised trial. Gut. 2016;65(5):852-60. [CrossRef]
- Lee S, Ahn SH, Jung KS, et al. Tenofovir versus tenofovir plus entecavir for chronic hepatitis B with lamivudine resistance and entecavir resistance. J Viral Hepat. 2017;24(2):141-7. [CrossRef]
- Lim YS, Yoo BC, Byun KS, et al. Tenofovir monotherapy versus tenofovir and entecavir combination therapy in adefovir-resistant chronic hepatitis B patients with multiple drug failure: results of a randomised trial. Gut. 2016;65(6):1042-51. [CrossRef]
- Lim YS, Lee YS, Gwak GY, et al. Monotherapy with tenofovir disoproxil fumarate for multiple drug-resistant chronic hepatitis B: 3-year trial. Hepatology. 2017;66(3):772-83. [CrossRef]
- Park JY, Kim CW, Bae SH, et al. Entecavir plus tenofovir combination therapy in patients with multidrug-resistant chronic hepatitis B: results of a multicentre, prospective study. Liver Int. 2016;36(8):1108-15. [CrossRef]
- Yim HJ, Kim IH, Suh SJ, et al. Switching to tenofovir vs continuing entecavir for hepatitis B virus with partial virologic response to entecavir: a randomized controlled trial. J Viral Hepat. 2018;25(11):1321-30. [CrossRef]
- Du Jeong I, Jung SW, Park BR, et al. Clinical course of partial virologic response with prolonged tenofovir therapy in nuclos(t)ides-naïve patients with chronic Hepatitis B. Dig Dis Sci. 2017;62(10):2908-14. [CrossRef]
- Lee HW, Park JY, Lee JW, et al. Long-term efficacy of tenofovir disoproxil fumarate monotherapy for multidrug-resistant chronic HBV infection. Clin Gastroenterol Hepatol. 2019;17(7):1348-55.e2. [CrossRef]
- Kim DY, Lee HW, Song JE, et al. Switching from tenofovir and nucleoside analogue therapy to tenofovir monotherapy in virologically suppressed chronic hepatitis B patients with antiviral resistance. J Med Virol. 2018;90(3):497-502. [CrossRef]
- Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021 [Internet]. Geneva: World Health Organization (WHO). [erişim 24 Haziran 2022]. https://www.who.int/publications/i/item/9789240027077
- Sixty-Third World Health Assembly. Provisional agenda item 11.12. Viral hepatitis: Report by the Secretariat, 25 March 2010 [Internet]. Geneva: World Health Organization (WHO). [erişim 24 haziran 2022]. https://apps.who.int/gb/ebwha/pdf_files/WHA63/A63_15-en.pdf
- Mast EE, Weinbaum CM, Fiore AE, et al; Advisory Committee on Immunization Practices (ACIP) Centers for Disease Control and Prevention (CDC). A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep. 2006;55(RR-16):1-33; quiz CE1-4. Erratum in: MMWR Morb Mortal Wkly Rep. 2007;56(42):1114.
- Centers for Disease Control and Prevention. Hepatitis B. In: Atkinson W, Hamborsky J, Wolfe C, eds. Epidemiology and Prevention of Vaccine-Preventable Diseases. 8th ed. Washington, DC: Public Health Foundation, 2004; 191-212.
- Tosun S. Hepatit B aşılaması. Dünyadaki ve ülkemizdeki durum. In: Tabak F, Balık İ, eds. Viral Hepatit-2009. Ankara: Viral Hepatitle Savaşım Derneği Yayını, Nobel Tıp Kitapevi, 2009: 307-51.
- Bruce MG, Bruden D, Hurlburt D, et al. Antibody levels and protection after hepatitis b vaccine: results of a 30-year follow-up study and response to a booster dose. J Infect Dis. 2016;214(1):16-22. [CrossRef]
- Schillie S, Vellozzi C, Reingold A, et al. Prevention of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on immunization practices. MMWR Recomm Rep. 2018;67(1):1-31. [CrossRef]