En Çok Okunanlar
Özet
Amaç: Kronik hepatit B’nin eradikasyonu için anti-viral bir tedavi henüz yoktur. Nükleoz(t)ide analogu (NA) tedavisinin durdurulması sıklıkla viral nükse yol açar ve bu nedenle genellikle yaşam boyu tedavi gerekir. Bu çalışmada, hepatit B e-antijeni (HBeAg) negatif hastalarda NA tedavisinin bırakılmasının sonuçları araştırıldı.
Yöntemler: Ortalama ≥7 yıldır NA tedavisi alan ve ortalama ≥7 yıldır baskılanmış HBV DNA’sı olan sirozu olmayan HBeAg-negatif hastalarda, NA tedavisi EASL kılavuzunun durdurma kuralına göre kesildi. Tedavi ve tedavi sonrası takipte HBV DNA viral yükü, HBsAg ve alanin aminotransferaz ölçümlerini içeren standart laboratuvar testleri ve advers olay dört yıldan uzun süre takip edildi.
Bulgular: Dört yıldan uzun süredir devam eden takiplerde hiçbir hastada HBsAg kaybı yaşanmadı. NA tedavisi kesilen tüm hastalarda ilk 12 hafta sonrasında HBV-DNA değerleri saptanabilir durumdaydı. Çalışmamızda HBV DNA >2000 İÜ/ml olan hastaların oranı altıncı ayda %70, 12. ayda %74, 24. ayda %78, 36. ayda %79.7 olup takiplerde dört yılı aşan süreçte diğer hastalarda HBV DNA >2000 İÜ/ml’yi aşmadı. Nüks nedeniyle tedavi başlanan hastaların oranı ilk bir yılda %26 (n=18), ikinci yılda %46 (n=32), üçüncü yılda %49 (n=34), dördüncü yılda %55 (n=38) idi. Dördüncü yılın sonunda %45 (n=31) oranında hasta tedavisiz şekilde izlenmekteydi.
Sonuç: HBeAg-negatif KHB hastalarının NA tedavisi altında takipleri literatüre göre uzun olmasına rağmen nüks oranlarımız diğer çalışmalarla benzerdi ve hiçbir hastamızda HBsAg kaybı izlenmedi. En önemli kazanım, dört yıldan uzun süreçte en azından iki hastadan birini tedavisiz izleyebiliyor olmamız ve hastaların ilaç kullanma zorunluluğunun olmamasıdır.
GİRİŞ
Hepatit B virusu (HBV) infeksiyonu, 257 milyondan fazla kişinin etkilendiği önemli bir küresel sağlık sorunu olmaya devam etmektedir (1,2). Kronik hepatit B (KHB)’nin siroz, hepatik dekompansasyon ve hepatoselüler karsinom (HSK) dahil olmak üzere potansiyel olumsuz sonuçları vardır (1,3). Dünya Sağlık Örgütü (DSÖ) verilerine göre 2021 yılında HBV ilişkili karaciğer hastalıkları kapsamında yaklaşık olarak 820 000 ölüm bildirilmiştir (2). Amerikan Karaciğer Hastalıkları Araştırma Derneği (American Association for the Study of Liver Diseases – AASLD), Avrupa Karaciğer Araştırmaları Derneği (European Association for the Study of the Liver – EASL) ve Türk Karaciğer Araştırmaları Derneği (TKAD), KHB tedavisinde önerilen birinci basamak ajanlara ilişkin kılavuzlarını basitleştirmiştir. Nükleoz(t)id analog (NA)’ları ve immünomodülatörler [pegile interferon (pegIFN)] önerilen tedaviler olmakla birlikte kolay uygulanmasının yanı sıra güvenli ve etkin olması nedeniyle çoğu hastada NA tedavisi kullanılır (4,5). Söz konusu tedaviler genel olarak viral replikasyonu azaltarak, yaşam kalitesini artırmayı ve karaciğer hastalığına bağlı komplikasyon riskini azaltmayı içerir; ancak nadiren HBV yüzey antijeni (HBsAg) klirensine yol açabilirler (6,7). Yüksek genetik direnç bariyerli olmaları nedeniyle önerilen NA’lar; entekavir (ETV) ve tenofovir alafenamid (TAF) veya tenofovir disoproksil fumarat (TDF)’tır (1,3,8). Optimal sonlanım noktaları hala tanımlanamadığı için kronik hepatit B tedavisinin süresini belirlemek uygun ajanları seçmekten çok daha zordur. Çoğu klinisyen, HBsAg kaybını ve serokonversiyonunu bir son nokta olarak kabul eder; ancak şu anda mevcut tedavilerimizle bu sonuç çok düşük bir oranda elde edilmektedir (9,10). HBV e-antijeni (HBeAg) klirensi ise makul bir terapötik son noktadır ve KHB’nin fonksiyonel tedavisi olarak da adlandırılır.
Uzun süreli NA tedavisi; uyum, yan etkiler ve özellikle maliyet gibi bazı endişeleri de gündeme getirmekte olup hastaların önemli bir kısmı çeşitli nedenlerle tedaviyi bırakmak istemektedir. Bu nedenle, NA tedavisini durdurmak için kuralların tanımlanması son derece önemlidir (11). HBeAg-negatif KHB için durdurma kuralı; ilk olarak 2008 yılında, maliyet ve ilaca direnç sorunları göz önünde bulundurularak APASL kılavuzlarına eklenmiştir (12). Bu öneriler, hastalarda lamivudin (LAM) tedavisinin kesilmesinden önce korunan bir virolojik yanıt elde edilmişse eğer LAM tedavisinin kesilmesinden 6-12 ay sonra sürekli yanıt oranının yaklaşık %50 olduğunu gösteren, LAM ile tedavi edilen Asyalı hastalarda yapılan birkaç çalışmaya ve Batı ülkelerinde Hadziyannis ve arkadaşlarının, NA’ları kestiklerinde oldukça yüksek bir HBsAg kaybı oranı gösteren çalışmalarına dayanmaktadır (13-16).
HBV e-antijeni negatif KHB hastalarında NA’ların kesilmesi ile ilgili olarak AASLD kılavuzu şunları önermektedir: Hastaya siroz tanısı konmamışsa, tedaviyi kesmek için başka bir neden görülmedikçe, hasta süresiz olarak veya HBsAg kaybına kadar tedavi edilmelidir. Hastaya siroz teşhisi konulursa, hasta süresiz olarak tedavi edilmelidir (3). Avrupa Karaciğer Araştırmaları Derneği Kılavuzu’nda, siroz tanısı konmadığı takdirde hastaların üç yıllık virolojik baskılamanın ardından yakın izleme koşuluyla tedaviyi bırakabilecekleri bildirilmiştir (1). Asya Pasifik Karaciğer Araştırmaları Derneği Kılavuzu’nda ise hasta siroz tanılı değilse ve altı ay arayla üç ayrı ziyarette tespit edilemeyen HBV-DNA ile en az iki yıl tedaviden sonra tedavinin kesilebileceği ifade edilmiştir (17).
Bu çalışmada, NA’larla tedavi edilen HBeAg-negatif KHB hastalarının oral antiviral tedavilerinin kesilmesinin ardından dört yıllık takipte elde edilen gerçek yaşam verilerini sunmayı amaçladık.
YÖNTEMLER
Çalışma Tasarımı
Çalışmamız, Türkiye’de üçüncü basamak bir eğitim ve araştırma hastanesinde kronik hepatit B tanılı olarak tedavi alan hastalarla retrospektif olarak yapıldı. Çalışmaya 69 hasta dâhil edildi. İlerlemiş fibrozu ve sirozu (Ishak fibrozis skoru >4) olan hastalar, immünosüpresif tedavi alanlar, insan immün yetmezlik virusu (HIV), hepatit C virusu veya hepatit D virusu ile infekte olanların yanı sıra HSK, malignite ve karaciğer dekompansasyonu öyküsü olanlar çalışma dışı bırakıldı. Hastaların NA tedavisi başlangıcında HBsAg pozitifliği, HBeAg negatifliği ve anti-hepatit B e-antikoru (anti-HBe) pozitifliği gözlendi. Avrupa Karaciğer Araştırmaları Derneği Kılavuzu’nun durdurma kuralına [HBV-DNA en az üç yıl boyunca polimeraz zincir reaksiyonu (PCR) ile saptanamaz olmalıdır] uygun olarak NA tedavileri kesilmişti (1). Tedavileri belirtilen kriterlere uygun olarak kesilen hastaların verileri incelendi ve dört yıldan fazla süredir takipli olanların son yıl verileri analiz edildi.
On sekiz yaş üstü ve sirozu olmayan hastaların tedavileri kesildikten sonraki takipleri ilk altı ay dört haftada bir, altı aydan sonra ise her üç ayda bir yapılmıştı. NA tedavisi üç kriterden en az birini karşılayan hastalarda yeniden başlatılmıştı. Tedaviyi yeniden başlatma kriterleri sırası ile; HBV’den bağımsız olarak, ilişkili semptomları olan /olmayan ve en az 10 gün arayla doğrulanan iki ardışık laboratuvar sonucunda alanin aminotransferaz (ALT) seviyesinin >10x “upper limit of normal” (ULN) olması veya ALT seviyesinin 5xULN ile 10xULN arasında olmak üzere dört haftadan fazla süre yüksek seyretmesi veya HBV-DNA seviyesinin bir ay arayla iki laboratuvar testi sonucunda >20 000 İÜ/ml olmasıdır (18,19).
Çalışma kapsamında; cinsiyet, yaş, ilk karaciğer fibroz evresi, önceki tedavi(ler), reçete edilen NA’ların tipi, pegIFN kullanımı, başlangıç serum HBV-DNA ve ALT seviyeleri, tedavi süresi ve HBV-DNA negatifliğinin süresi, klinik relaps olan ve sürekli yanıt veren hastalar karşılaştırıldı.
Çalışma için Antalya Eğitim ve Araştırma Hastanesi Etik Kurulu’ndan 12 Mart 2020 tarih ve 5/20 karar numarasıyla onay alındı.
Çalışma Değerlendirmeleri
Çalışmanın izlem ve başlangıç değerlendirmelerinde standart laboratuvar ve klinik değerlendirmelere ek olarak gerçek zamanlı PCR (Abbott TagMan 2000, ABD) (kantifikasyon olarak alt limit, 10 İÜ/ml) kullanılarak serum HBV-DNA düzeyleri ölçülmüştü. HBsAg, HBeAg, anti-hepatit B yüzey antikoru (anti-HBs) ve anti-HBe ölçümleri, kemilüminesans immünolojik testler (cobas e 601 analizörü; Roche Diagnostic, Almanya) kullanılarak belirlenmişti. Standart takipte hepatit B virusu serolojisi, HBV-DNA ölçümü ve anti-HBs, ALT ve karaciğer biyopsisinin sonuçları (Knodell’in modifiye sistemine göre puanlandı) kullanılmıştı (20).
Çalışma Bitiş Noktaları
Birincil etkinlik son noktası, dördüncü yılda HBV-DNA düzeyi 2000 İÜ/ml’nin altında olan hastaların oranıydı. Haftalar itibarıyla NA tedavisine yeniden başlayan hastaların oranı değerlendirildi.
İstatistiksel Analiz
Verilerin analizi, SPSS (Statistical Package for the Social Sciences) versiyon 22.0 programı (IBM Corp., Armonk, NY, ABD) ile yapıldı. Tanımlayıcı istatistikler her değişken için hesaplandı. Veriler medyan ve yüzde olarak ifade edildi. Klinik özelliklerin gruplar arasındaki dağılım farklılıkları Pearson χ2 testi ile analiz edildi. Tüm p değerleri iki taraflıydı ve p<0.05 değerleri anlamlı düzey olarak kabul edildi.
BULGULAR
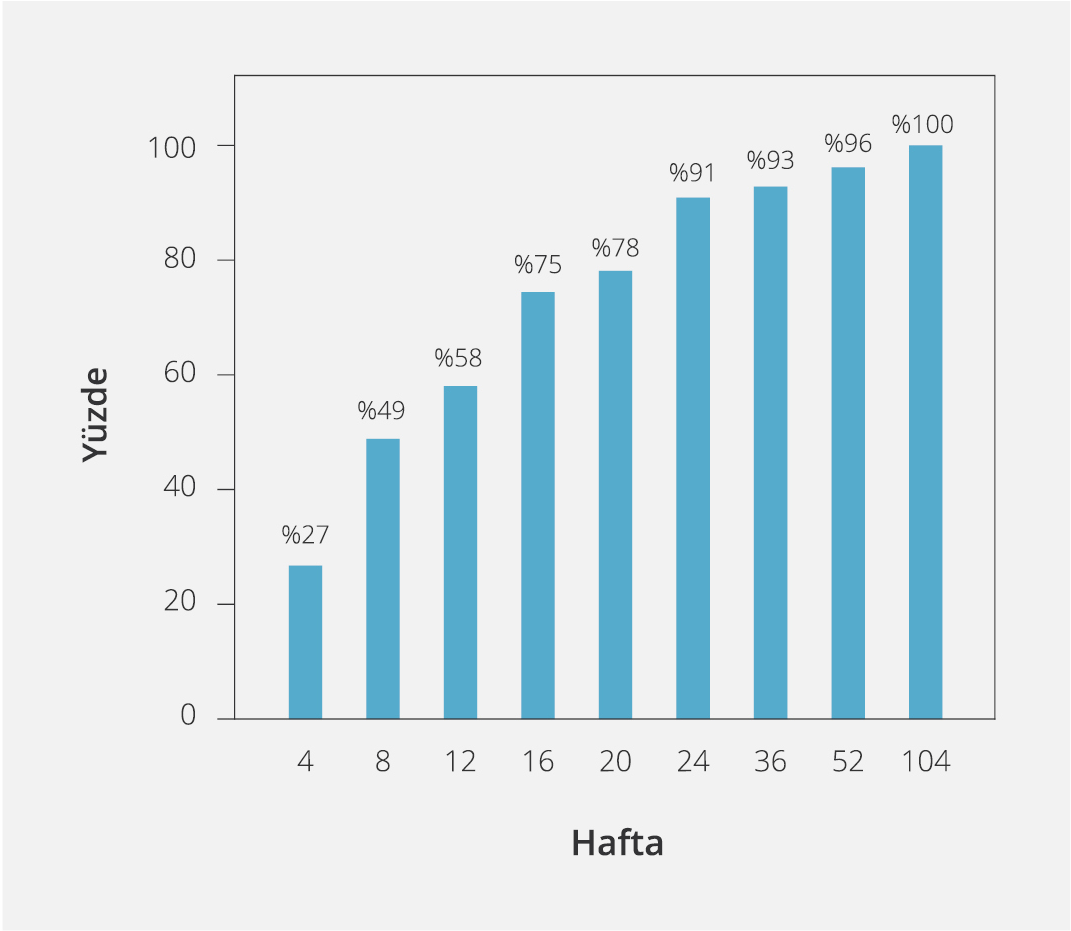
Şekil 1. Tedavi Kesildikten Sonra Nüks Olan Hastaların Kaçıncı Haftada HBV DNA > 2000 İÜ/ml Üzerinde Tespit Edildiğinin Kümülatif Grafiği (n=55)
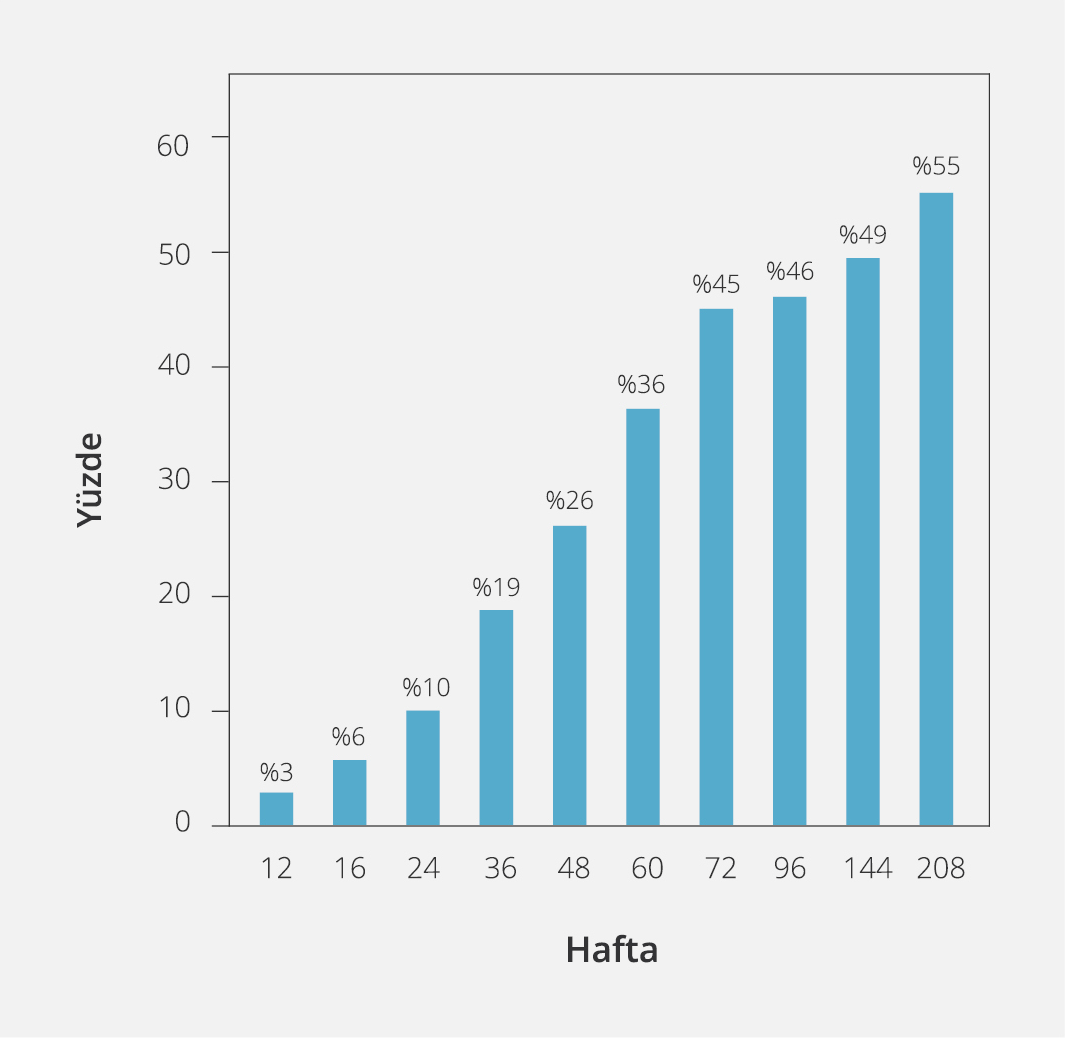
Şekil 2. Nükleo(z)tid Analogu Tedavisi Kesilen Hastalarda Haftalara Göre Yeniden Tedavi Başlanan Hastaların Kümülatif Grafiği
Çalışmamızda, NA’larla tedavi edilen 79 HBeAg-negatif KHB hastasının tedavisi kesilmişti. Hastaların üçü takibe gelmediği, beşinde ekstrahepatik semptomlar geliştiği, biri hamile kaldığı ve biri ise kendi isteği ile tedaviye yeniden başlandığı için çalışmaya dahil edilmedi. Dahil edilme kriterlerini karşılayan 69 hasta değerlendirmeye alındı. Hastaların 38 (%55.1)’i erkekti ve ortanca yaş 51.3 (26-73) idi. Nükleoz(t)id analogları kullanan 69 hastanın 21 (%30.4)’i daha önce diğer NA’larla tedavi edilirken 5 (%7.2)’i pegIFN tedavisi almıştı. Hastaların hiçbiri tedavi sırasında ve dört yıllık dönemde HBsAg kaybı yaşamamıştı. Klinik nüks olan veya olmayan (nüks edenler ve nüks etmeyenler) hastaların başlangıçtaki tedavi özellikleri Tablo 1’de verildi. Hastaların %55’inde relaps gelişmişti. Nüks olan hastalar ile olmayanlar arasında; yaş, cinsiyet, tedavi başlangıcındaki HBV-DNA varlığı, biyopsideki fibrozis sonucu, aldıkları tedavi, tedavinin ve konsalidasyonun süresi yönünden farklılık olmadığı görüldü (Tablo 1).
Hiçbir hastada HBsAg kaybı yaşanmamıştı. Tedavisi kesilen hastaların tamamında ilk 12 haftanın ardından HBV-DNA varlığı saptanabilir düzeydeydi. Hastaların HBV DNA değeri >2000 İÜ/ml olanlarının oranı altıncı ayda %70, 12. ayda %74, 24. ayda %78, 36. ayda %79.7 olup takiplerde dört yılı aşan süreçte diğer hastalarda HBV DNA değeri >2000 İÜ/ml düzeyine ulaşmamıştı. Hastalardaki HBV DNA nüksü özellikle ilk 16 haftada gerçekleşmişti (nükslerin %75’i) (Şekil 1). Dört yıllık süreçte 55 (%79.7) hastada HBV DNA değerinin >2000 İÜ/ml olduğu görüldü. İlk yılın sonunda 23 hastada HBV DNA >20 000 İÜ/ml iki kez görülürken altı hastada hem virolojik hem de biyokimyasal nüks gözlendi. Ardışık iki testte ALT değeri yüksek çıkan hastalarda klinik semptom tespit edilmedi. Bu hastalarda ALT alevlenmesi sırasında bilirubin seviyesi yükselmemişti. Bir yıl sonrasında virolojik alevlenme yaşayan hastalarda biyokimyasal alevlenme görülmemişti. Nüks nedeniyle tedavi başlanan hastaların oranı ilk bir yılda %26 (n=18), ikinci yılda %46 (n=32), üçüncü yılda %49 (n=34), dördüncü yılda %55 (n=38) idi (Şekil 2). Nüks yaşanan 38 hastada tedavi başlandıktan sonra tekrar virolojik baskılanma sağlanmıştı. Dördüncü yılın sonunda 31 (%45) hasta tedavisiz şekilde izlenmekteydi.
İRDELEME
Kronik hepatit B’de NA’ların kesilmesini değerlendirirken tedavinin durdurulmasının sağlayacağı faydaların neler olacağı iyi düşünülmelidir; uzun süreli NA tedavisi zaten viral baskılamayı sağladığı ve karaciğer hastalık riskini sınırladığı için tedavinin kesilmesi de benzer veya daha iyi sonuçları amaçlamalıdır. Sürekli virolojik remisyon ile immün kontrolü gösteren HBsAg kaybı, uzun vadeli olumlu sonuçların ve dolayısıyla NA kesilmesinin en iyi göstergesi olmaya devam etmektedir. Son yıllarda, uzun süreli NA tedavisini durdurmanın potansiyel yararlarını, güvenliğini ve etkinliğini gösteren artan sayıda çalışma yayımlanmıştır (21). Nükleoz(t)id analoglarını bırakma yaklaşımıyla ilgili ilk önemli çalışmalardan biri, HBeAg-negatif KHB hastalarında uzun süreli NA tedavisini durdurmanın biyokimyasal ve virolojik etkilerini değerlendiren Yunanistan’dan küçük, ileriye dönük bir kohort çalışmaydı. Söz konusu çalışmada, dört-beş yıl süren tedavinin ardından, adefovir tedavisi durdurulmuş olup sonrasında 33 hastanın hepsinde virolojik ve %76’sında ise biyokimyasal nüks gelişmiştir; hastaların %45’i yeniden tedavi edilmiştir. Takip sırasında 18 hastada sürekli biyokimyasal ve virolojik remisyon gelişmiş bunların da 13’ü (toplamın %39’u) 5.5 yıllık takip sırasında HBsAg kaybına ulaşmıştır; bu sonuç NA tedavisi sırasındaki çok düşük HBsAg klirens oranına kıyasla dikkate değer bir bulgudur (15). Chan ve arkadaşları (22) çalışmalarında, LAM tedavisini durdurduktan sonra hastaların %20’sinin HBsAg seroklirensine ulaştığını bildirmiştir; HBsAg seroklirensinin ana belirleyicisi ise tedavi sonunda kantitatif HbsAg (qHBsAg) seviyeleri < 2 log İÜ/ml ve başlangıca göre > 1 log azalması olarak bulunmuştur. Randomize FINITE çalışması, en az 3.5 yıldır NA tedavisi gören HBeAg-negatif hastalarda standart TDF tedavisine devam etme ile bu tedavinin kesilmesini karşılaştırmıştır; NA’ların kesildiği toplam 21 hastanın 13’ü tedavi dışında kalmıştır ve hatta 4 (%20)’ünde 3 yıllık takip sonunda HBsAg seroklirensi gelişmiştir (19). Chang ve arkadaşları (23) öncesinde iki yıldan fazla süredir NA tedavisi alan ve NA tedavisi kesilen hastaların derlendiği çalışmalarında, HBsAg seroklirensi oranı %2 ila %42 arasında bulunmuştur. Tekrar tedaviden kaçınmak veya yeniden tedaviye başlamak için önceden tanımlanmış katı kriterlere gerek vardır. Bununla birlikte, yeniden tedavi kriterleri standardize edilmemiştir ve bu da farklı çalışmalar arasında büyük heterojenliğe neden olmuştur. Kalıcı olarak hafif ile orta derecede karaciğer hastalığı aktivitesi olan hastalarda, tedaviyi bıraktıktan sonra en az altı ay boyunca HBV DNA ve ALT düzeylerinin kalıcı olarak yükselmesi durumunda yeniden tedaviye başlanması uygun bulunmuştur (1,3). Ayrıca DARING-B çalışması, aynı vizitte orta düzeyde ALT yükselmeleri (>3×ULN) ve yüksek HBV DNA seviyeleri (>100 000 İÜ/ml) durumlarında da yeniden tedavinin gerekli olduğunu göstermiştir (24). Alevlenmeleri olan hastalar için, yeniden tedaviyi geciktirmek zararlı olabilirken, yeniden tedaviye çok erken başlamanın, potansiyel nüksetme ile ilişkili fonksiyonel bir iyileşme indüksiyonunu önleyebileceği belirtilmiştir (25). Çalışmamızı literatürden ayıran nokta, dört yılı aşan takiplerinde hiçbir hastada HBsAg seroklirensi gerçekleşmemiş olmasıdır. Hastalarda HBsAg seroklirensi görülememesinin sebebini, biyokimyasal alevlenmelerde aceleci davranıp korumacı yaklaşımla erken yeniden tedavi başlamasına bağlı nüksetme ile ilişkili fonksiyonel bir iyileşme indüksiyonu şansının kaçırılmasına ve hastaların çoğunluğunun D genotip olmasına bağlıyoruz (26). Bu nedenle, yeniden tedavi etmeme kararına yardımcı olacak HBV alevlenmelerinin tipini daha iyi belirlemek için uygun bir değerlendirme çok önemlidir. Bununla birlikte, Asya çalışmalarında görünüşte daha düşük olan yanıt oranlarının daha kısa tedavi süresinden mi yoksa olası etnik faktörlerden mi yoksa HBV genotipinden mi kaynaklandığı açık değildir (24,26,27). Çalışmamızın eksik yönlerinden birinin hastalarda HBsAg kaybının öngörülmesi açısından qHBsAg düzeyinin çalışılmaması olduğunu düşünüyoruz; qHBsAg düzeyi çalışabilmiş olsaydı hastaları literatüre göre HBsAg kaybına daha yakın hasta grubundan seçebilme şansı olurdu. Böylece hastalarda literatürle uyumlu düzeyde HBsAg seroklirensini elde edebilirdik.
Tedavi kesildikten sonra viral nüksü HBV DNA >60 İÜ/ml (27), HBV DNA >70 İÜ/ml (28) veya HBV DNA >200 İÜ/ml (22) olarak tanımlayan çalışmalar, HBeAg-negatif KHB hastalarının çok yüksek bir yüzdesinin viral nüksetme yaşadığını tespit etmiştir. Diğer çalışmalar, nüksü tanımlamak için HBV DNA >2000 İÜ/ml seviyelerini kullanmıştır (21). Çalışmamızda, HBeAg-negatif KHB hastalarında virolojik nükslerin çoğu, tedavinin kesilmesinden sonraki ilk 3-9 ay içinde meydana gelmiştir. Yirmi dört aydan uzun süredir virolojik remisyonda olan 130 HBeAg-negatif KHB hastanın irdelendiği çalışmada hastalar NA kesildikten kısa bir süre sonra HBV DNA >2000 İÜ/ml olarak tanımlanan virolojik nüks yaşamış ve 6, 12 ve 24 aylık kümülatif virolojik nüks oranları sırasıyla %56, %71 ve %83 bulunmuştur. Virolojik nükslerin çoğu NA’nın kesilmesinden sonraki ilk yıl içinde meydana gelmiştir. Tedavi kesildikten 6, 12, 18 ve 24 ay sonra kümülatif yeniden tedavi oranı sırasıyla, %15, %22, %30 ve %40 olmuştur. Yeniden tedavi başladıktan sonra en az 12 aylık takibi olan tüm hastalarda saptanamayan serum HBV DNA’sı ve normal ALT düzeyi elde edilmiştir (29). Nükleoz(t)id analoglarını bırakan ve ardından ≥12 ay takip edilen hastaların dahil edildiği tüm çalışmaları belirlemek için yapılan bir sistemik incelemede, toplam 1716 hastayı içeren 25 çalışma irdelenmiştir. Söz konusu çalışmada, NA tedavileri kesilen hastaların havuzlanmış genel kalıcı virolojik nüks oranı yaklaşık %54 olarak tespit edilmiş ve nükslerin çoğunun NA’nın kesilmesinden sonraki ilk veya ikinci yıl içinde meydana geldiği görülmüştür. Özellikle, havuzlanmış kalıcı virolojik nüks oranları NA kesildikten sonra altıncı ayda %32, 12. ayda %49, 24. ayda %61 ve 36. ayda %62 bulunmuştur (30). DARING-B çalışmasında, 5.3 yıllık medyan virolojik remisyondan sonra tedaviyi bırakan ve medyan 18 aylık takip altında kalan 57 hasta incelenmiş HBV DNA > 2000 İÜ/ml eşik değeri için kümülatif virolojik relaps oranları tedaviden 3, 12 ve 18 ay sonra sırasıyla %56, %70 ve %72 olarak bulunmuştur; altıncı aydan sonra nüks olasılığı azalmıştır (24).
Çalışmamızın benzer diğer çalışmalardan en önemli farkı, NA tedavi süresi [9 (3-14) yıl] ve viral baskılanma süresinin [7 (3-13) yıl] daha uzun olmasıdır. Aslında bu durum çalışmamızın ayırt edici yönüdür; çünkü çalışmamız diğer çalışmalara göre daha uzun tedavi süresine ve daha uzun HBV-DNA baskılanma süresine sahip olmasına rağmen, tespit edilen nüks oranları diğer çalışmalarla benzerdir. Çalışmamızda da literatürle benzer olarak HBV DNA >2000 İÜ/ml olan hastaların oranı altıncı ayda %70, 12. ayda %74, 24. ayda %78, 36. ayda %79.7 olup takiplerde dört yılı aşan süreçte diğer hastalarda HBV DNA >2000 İÜ/ml olmamıştı. Nüks nedeniyle tedavi başlanan hastaların kümülatif oranı ilk bir yılda %26 (n=18), ikinci yılda %46 (n=32), üçüncü yılda %49 (n=34), dördüncü yılda % 55 (n=38) idi. Yeniden tedavi başlanan 55 hastanın hepsinde virolojik baskılama, HBeAg-negatif durum ve ALT normalizasyonu elde edilmişti. Dört yılın sonunda hastaların %45’inin tedavisiz takip ediliyor olması çalışmamızın en önemli kısmıydı.
Uzun süreli NA tedavisinin kesilmesi; hekimlere ve hastalara belirli bir süre için sık takip ziyaretlerine, uzun vadeli sonuçlar hakkında belirsizliğe ve gerekli ancak maliyetli laboratuvar testlerinin sayısında artışa neden olabilir. Ancak nüks olmazsa tedavi masraflarından tasarruf sağlamanın yanı sıra hastalar psikolojik olarak da rahatlar. Uzun vadede, NA tedavisinin kesilmesiyle devam eden remisyon, HBsAg kaybıyla sonuçlanabilir.
Tedavisi kesilen hastalarda klinisyenleri zorlayan konuların başında yeniden tedavi kararının verilmesi gelmiştir. Tüm hastalarda virolojik nüks görüldüğünden, bu kriter yeniden tedavi için uygun değildir. Sonuç olarak; yeniden tedaviye doğru zamanda başlama konusunda klinisyenleri yönlendirecek ve hasta dekompansasyona ilerlemeden alevlenmeleri ayırt etmeye yaracak öngörücülerin ve tedavi kriterlerinin ortaya konulması gerektiğini düşüyoruz. Yayımlanmış verilerin yeniden analizi ve yeni veriler, NA tedavisinin ne zaman ve kimde durdurulacağı konusunda daha faydalı bilgiler sağlayabilir.
Hasta Onamı
Hasta verileri retrospektif olarak incelendiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma, Antalya Eğitim ve Araştırma Hastanesi Etik Kurulu tarafından 12 Mart 2020 tarih ve 5/20 karar numarasıyla onaylanmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – F.S.Y., Ü.Ü., A.T.; Tasarım – F.S.Y.; Denetleme – F.S.Y., Ü.Ü., A.T.; Kaynak ve Fon Sağlama – A.T.; Malzemeler/Hastalar – F.S.Y., Ü.Ü., A.T.; Veri Toplama ve/veya İşleme – A.T., F.S.Y., Ü.Ü.; Analiz ve/veya Yorum – A.T.; Literatür Taraması – A.T., F.S.Y., Ü.Ü.; Makale Yazımı – A.T., F.S.Y.; Eleştirel İnceleme – F.S.Y.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Sunulan Bilimsel Etkinlik
13-16 Ekim 2022 tarihinde gerçekleştirilen Kronik Hepatitlerde Sorunlu Alanlar ve Karşılanmamış İhtiyaçlar Sempozyumu’unda poster olarak sunulmuştur.
Referanslar
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021 [Internet]. Geneva: World Health Organization (WHO). [erişim 28 Ocak 2023]. https://www.who.int/publications/i/item/9789240027077
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99. [CrossRef]
- Cornberg M, Lok AS, Terrault NA, Zoulim F; 2019 EASL-AASLD HBV Treatment Endpoints Conference Faculty. Guidance for design and endpoints of clinical trials in chronic hepatitis B – Report from the 2019 EASL-AASLD HBV Treatment Endpoints Conference. J Hepatol. 2020;72(3):539-57. [CrossRef]
- Bulut R, Kurt-Kepenek E, Kandemir B, Erayman İ, Bitirgen M. [Antiviral treatment results and side effects during treatment in chronic hepatitis B patients]. Klimik Derg. 2021;34(3):192-7. Turkish. [CrossRef]
- Marcellin P, Wong DK, Sievert W, et al. Ten-year efficacy and safety of tenofovir disoproxil fumarate treatment for chronic hepatitis B virus infection. Liver Int. 2019;39(10):1868-75. [CrossRef]
- Dursun-Beştepe Z, Celik İ. [Evaluation of potent antiviral therapy in chronic hepatitis B patients]. Mersin Üniv Sağlık Bilim Derg. 2020;13(2):189-99. Turkish. [CrossRef]
- Tabak F, Yurdaydın C, Kaymakoğlu S, et al, Guidelines Study Group VH. Diagnosis, management and treatment of hepatitis B virus infection: Turkey 2017 Clinical Practice Guidelines. Turk J Gastroenterol. 2017;28(Suppl 2):73-83. [CrossRef]
- Lok AS, McMahon BJ, Brown RS Jr, et al. Antiviral therapy for chronic hepatitis B viral infection in adults: A systematic review and meta-analysis. Hepatology. 2016 Jan;63(1):284-306. [CrossRef]
- Chen CJ, Yang HI, Su J, et al; REVEAL-HBV Study Group. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA. 2006;295(1):65-73. [CrossRef]
- Lampertico P, Berg T. Less can be more: A finite treatment approach for HBeAg-negative chronic hepatitis B. Hepatology. 2018;68(2):397-400. [CrossRef]
- Liaw YF, Leung N, Kao JH, et al; Chronic Hepatitis B Guideline Working Party of the Asian-Pacific Association for the Study of the Liver. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int. 2008;2(3):263-83. Erratum in: Hepatol Int. 2008;2(3):395-6. [CrossRef]
- Chan HL, Wang H, Niu J, Chim AM, Sung JJ. Two-year lamivudine treatment for hepatitis B e antigen-negative chronic hepatitis B: a double-blind, placebo-controlled trial. Antivir Ther. 2007;12(3):345-53.
- Chien RN, Liaw YF. Short-term lamivudine therapy in HBeAg-negative chronic active hepatitis B in Taiwan. Antivir Ther. 2006;11(7):947-52.
- Hadziyannis SJ, Sevastianos V, Rapti I, Vassilopoulos D, Hadziyannis E. Sustained responses and loss of HBsAg in HBeAg-negative patients with chronic hepatitis B who stop long-term treatment with adefovir. Gastroenterology. 2012;143(3):629-36.e1. [CrossRef]
- Akgül F, Müderrisoğlu C, Ceylan B, et al. [The variables identified in the development of exacerbation hepatitis in chronic HBV infection responding to treatment].Istanbul Med J. 2011;12(2):72-8. Turkish. [CrossRef]
- Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int. 2016;10(1):1-98. [CrossRef]
- Liem KS, Fung S, Wong DK, et al. Limited sustained response after stopping nucleos(t)ide analogues in patients with chronic hepatitis B: results from a randomised controlled trial (Toronto STOP study). Gut. 2019;68(12):2206-13. [CrossRef]
- Berg T, Simon KG, Mauss S, et al; FINITE CHB study investigators [First investigation in stopping TDF treatment after long-term virological suppression in HBeAg-negative chronic hepatitis B]. Long-term response after stopping tenofovir disoproxil fumarate in non-cirrhotic HBeAg-negative patients – FINITE study. J Hepatol. 2017;67(5):918-24. [CrossRef]
- Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31(1):241-6. [CrossRef]
- Tout I, Lampertico P, Berg T, Asselah T. Perspectives on stopping nucleos(t)ide analogues therapy in patients with chronic hepatitis B. Antiviral Res. 2021;185:104992. [CrossRef]
- Chan HL, Wong GL, Chim AM, Chan HY, Chu SH, Wong VW. Prediction of off-treatment response to lamivudine by serum hepatitis B surface antigen quantification in hepatitis B e antigen-negative patients. Antivir Ther. 2011;16(8):1249-57. [CrossRef]
- Chang ML, Liaw YF, Hadziyannis SJ. Systematic review: cessation of long-term nucleos(t)ide analogue therapy in patients with hepatitis B e antigen-negative chronic hepatitis B. Aliment Pharmacol Ther. 2015;42(3):243-57. [CrossRef]
- Papatheodoridis GV, Rigopoulou EI, Papatheodoridi M, et al. DARING-B: discontinuation of effective entecavir or tenofovir disoproxil fumarate long-term therapy before HBsAg loss in non-cirrhotic HBeAg-negative chronic hepatitis B. Antivir Ther. 2018;23(8):677-85. Erratum in: Antivir Ther. 2018;23(8):711. [CrossRef]
- Jeng WJ, Yang HI, Chen YC, et al. Increased incidence of HBsAg seroclearance in HBeAg negative chronic hepatitis B patients discontinued Nuc therapy comparing to natural course-a propensity score matched study. J Hepatol. 2018;68:S88. [CrossRef]
- Chu CM, Liaw YF. Hepatitis B surface antigen seroclearance during chronic HBV infection. Antivir Ther. 2010;15(2):133-43. [CrossRef]
- Sohn HR, Min BY, Song JC, et al. Off-treatment virologic relapse and outcomes of re-treatment in chronic hepatitis B patients who achieved complete viral suppression with oral nucleos(t)ide analogs. BMC Infect Dis. 2014;14:439. [CrossRef]
- Jung YK, Yeon JE, Lee KG, Jet al. Virologic response is not durable after adefovir discontinuation in lamivudine-resistant chronic hepatitis B patients. Korean J Hepatol. 2011;17(4):261-7. [CrossRef]
- Papatheodoridis GV, Manolakopoulos S, Su TH, et al. Significance of definitions of relapse after discontinuation of oral antivirals in HBeAg-negative chronic hepatitis B. Hepatology. 2018;68(2):415-24. [CrossRef]
- Papatheodoridis G, Vlachogiannakos I, Cholongitas E, et al. Discontinuation of oral antivirals in chronic hepatitis B: A systematic review. Hepatology. 2016;63(5):1481-92. [CrossRef]