En Çok Okunanlar
Özet
Amaç: Bu makalede, naif kronik hepatit C (KHC) hastalarında ve sağlıklı kontrol grubunda serum “tumor necrosis factor”-alfa (TNF-alfa), “transforming growth factor”-beta (TGF-beta), interlökin-10 (IL-10) ve alanin aminotransferaz (ALT) düzeyleri ölçüldü. Bulunan değerler ile karaciğerin histolojik aktivite (HAİ) skorları arasındaki ilişki değerlendirildi.
Yöntemler: Çalışmaya, 43 hasta ve 43 kişilik kontrol grubu olmak üzere toplam 86 kişi dâhil edildi. Hasta ve kontrol gruplarında serum AST, ALT, TNF-alfa, TGF-beta ve IL-10 değerleri incelendi. Karaciğer fibroz derecesi (evre) ve HAİ skorları ile hasta ve kontrol grubunun TNF-alfa, IL-10, TGF-beta değerleri arasındaki bağlantı araştırıldı.
Bulgular: HAİ ile TNF-alfa arasında çok güçlü bir korelasyon (rho=0.965); HAİ ile TGF-beta arasında da önemli bir ilişki bulundu (rho=0.446). HAİ ve IL-10 arasında istatistiksel olarak bir korelasyon bulunmadı. Hasta grubunda HAİ ve serum ALT değerleri arasında önemli bir ilişki bulundu.
Sonuç: Karaciğer biyopsisi, sonuçları ağır olabilecek komplikasyonları olan invazif bir girişimdir. Bu durum, karaciğer biyopsi incelemesini dolaylı yoldan gösteren biyokimyasal veya radyolojik belirteçlere olan ihtiyacı ortaya çıkarmıştır. Çalışmamızın sonuçları, serum sitokin ve ALT değerlerine bakılarak bu ihtiyacın karşılanmasına yardımcı olabilecek noninvazif bir yöntem önerilebileceğini ortaya koymaktadır. Ancak bu kapsamda yeni çalışmaların yapılmasına ihtiyaç vardır.
GİRİŞ
Hepatit C virusu (HCV), kronik hepatit ve hepatoselüler karsinoma (HSK) neden olan nonsitopatik bir virustur. Flaviviridae ailesinin Hepacivirus cinsine ait, tek zincirli pozitif kutuplu RNA virusudur. Kronik hepatit C infeksiyonu küresel olarak önemli bir sağlık sorunu olup dünya nüfusunun %1’i infekte durumdadır. Ülkemizde, HCV infeksiyonu seroprevalansı bölgelere göre farklılık göstererek %0.1-0.8 oranında değişmektedir. En sık bildirilen HCV genotipi, genotip 1b’dir (1).
Klinik belirti vermeden gizli ve sinsice ilerleyen hastalığın siroza ve karaciğer kanserine yol açması, geliştirilebilen bir aşısının olmayışı hastalığın önemini artırmaktadır. HCV; günümüzde kronik hepatit, son evre karaciğer hastalığı, HSK ve karaciğer transplantasyonunun en önemli sebebidir. HCV infeksiyonunda spontan virus klirensine yol açan mekanizmalar tamamen anlaşılmış olmamakla birlikte T hücre aracılı hücresel immün yanıtın rolü önemli görünmektedir (2). Hepatit C yavaş seyirli sinsi bir hastalıktır. Hepatit C virusu ile oluşan akut ve kronik infeksiyonlarda karaciğer hasarından sorumlu mekanizma halen net olarak anlaşılamamış, hastalığın doğal seyri de tam olarak çözülememiştir. Doğal bağışıklık sistemi, infeksiyonun başlangıç evresindeki kontrolü ve sonraki adaptif immün yanıtın aktivasyonu için son derece önemlidir. Viral iyileşme şiddetli ve yaygın hücresel immün yanıtla ilişkilidir (3). Hepatit C virusu ile infekte hastaların yaklaşık %85’inde virus klirensi sağlanamamaktadır; gelişen kronik infeksiyon sonucu hastalarda siroz, hepatoselüler karsinom ve ölüm gelişebilmektedir (4). Kronik hepatit C (KHC) tedavisi, 1996 yılında interferon (İFN) ile başlamış ve bu alanda geliştirilen tedavi rejimleriyle kalıcı virolojik yanıt oranında önemli artış sağlanmıştır. Günümüzde; tüm HCV genotiplerine etkili, iyi tolere edilebilen, kısa tedavi süresi olan ve kolay kullanılabilen doğrudan etkili antiviral ajanların kullanıma girmesiyle tedavideki başarı oranı artmıştır (7).
Sitokinler immün sistemin ve inflamasyonun düzenlenmesinde kritik rol oynar. Kronik hepatit C ’de yeni yaklaşım, viral kalıcılığın ve hastalığın doğal seyrinin mekanizmalarını sitokin ağının açıkladığı yönündedir. Düşük serum tümör nekroz faktör-alfa (TNF-alfa) düzeyleri KHC’li hastalarda, kalıcı virolojik yanıtta önemli bir belirteçtir. KHC infeksiyonlarında sitokin aktivitesinin değiştiği tespit edilmiştir. Viral hepatitlerde oluşan karaciğer hücre hasarı, çoğunlukla virus ile infekte hücrelerin neden olduğu immün yanıt ile ilişkilidir. Virusla karşılaşma sonrasında CD4+ T lenfositlerden ve diğer birçok immün efektör hücreden Th1 sitokinler, interlökin-2 (IL-2) ve IFN-gamma üretilir; viral çoğalma etkin bir şekilde inhibe edilir.
Th2 tip sitokinler (IL-4, IL-5 ve I-10) üretildiğinde ise virusun konakta kalması kolaylaşarak hastalık kronik seyredebilir. Viral hepatitlerde; Th1 ve Th2 sitokin kalıbının önemi ve bu iki zıt sitokin yanıtın, infeksiyon sonucunu ne yönde etkilediği konusunda çalışmalar devam etmektedir.
YÖNTEMLER
Çalışma tek merkezli olarak Necmettin Erbakan Üniversitesi Meram Tıp Fakültesi Hastanesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği’nde gerçekleştirildi. Fakülte Etik Kurulu 25 Temmuz 2008 tarih ve 206 karar numarasıyla çalışmayı onayladı; dahil edilen hastalardan ve kontrol grubundan yazılı onam alındı.
Hastalar ve Kontrol Grubu
Sitokinler ve kemokinler, KHC tanılı hastalarda, bağışıklık ve inflamasyonun düzenlenmesinde kritik rol oynayan proteinlerdir. Çalışmamızda, tedavi edilmemiş KHC’li hastalarda serum sitokinleri ve alanin aminotransferaz (ALT) değerleri ile karaciğer histolojik aktivite indeksi (HAİ) skorları arasındaki ilişki araştırıldı. Diğer araştırmalardan farklı olarak kontrol grubu da çalışmaya dahil edildi.
Çalışmaya, 43 hasta ve 43 kişilik kontrol grubu olmak üzere toplam 86 kişi dâhil edildi. Hasta grubuna, Ocak 2009-Ocak 2011 tarihleri arasında kliniğimize başvurarak KHC tanısı alan bireyler alındı. Kronik hepatit C tanısında; Amerikan Karaciğer Hastalıkları Araştırmaları Derneği (American Association for the Study of Liver Diseases – AASLD)’nin belirlemiş olduğu tanı kriterleri kullanıldı. Buna göre, altı aydan daha uzun süre anti-HCV ve HCV-RNA pozitifliğinin devam ettiği olgular KHC olarak tanımlandı. Çalışmaya daha önce tedavi almamış (naif), tamamı genotip 1b KHC’li hastalar dâhil edildi. Kronik alkol kullanımı, gebelik, HCV dışı kronik karaciğer hastalığı nedenlerinden en az biri pozitif olanlarla ciddi sistemik hastalığı olanlar, hepatotoksik veya karaciğer yağlanmasına neden olabilecek ilaç kullananlar (kortikosteroid, yüksek doz östrojen, metotreksat, tetrasiklin, amiodaron), 50 g/gün üzerinde düzenli alkol kullananlar, klinik olarak dekompanse siroz tanısı alanlar ve ek hastalığı (HBsAg pozitifliği, anti-HIV pozitifliği, hematolojik hastalık, otoimmün hastalık, konjestif kalp yetmezliği, kronik böbrek yetmezliği, hemokromatozis) olanlar çalışmaya dahil edilmedi. Kronik hepatit C tanısı alan olgulardan, daha önce antiviral ve/veya interferon tedavisi alanlar da çalışmaya dâhil edilmedi. Kontrol grubuna daha önce belirtilen ek hastalıkları olmayanlar ve anti-HCV’si negatif olan bireyler alındı.
Karaciğer Biyopsisi
Kronik hepatit C tanısı koyulan hastalara karaciğer biyopsisi yapıldı. Karaciğer biyopsileri derece ve evrelemenin ayrı ayrı değerlendirilmesini sağlayan Ishak skorlama sistemi kullanılarak deneyimli bir patolog tarafından değerlendirildi. Hastaların; biyopsi skoru, aminotransferaz ve viral yük değerlerinin tedavi öncesi dönemi yansıtmasına ve korelasyon testlerinde yanılma payını azaltmak amacıyla aynı hafta içinde yapılmasına özen gösterildi. Kontrol grubuna karaciğer biyopsisi yapılmadı.
Mikrobiyolojik Analiz
Anti-HCV; kemilüminesans yöntemi ile VITROS® ECiQ (Ortho Clinical Diagnostics, ABD) cihazında 3. kuşak anti-HCV kitleri ile çalışıldı. Serumda anti-HCV pozitifliği saptanan hasta örnekleriyle mikrobiyoloji seroloji laboratuvarında COBAS® AmpliPrep / COBAS® TaqMan® (Roche Diagnostic Systems, ABD) kiti kullanılarak kantitatif HCV RNA tayini (viral yük) yapıldı. Hastaların HCV RNA’ları IU/ml olarak belirlendi ve 50 IU/ml altındaki değerler negatif olarak kabul edildi. HCV RNA pozitif hastalarda HCV genotip tayini ABI PRISM® 310 Genetic Analyzer (Perkin Elmer, Applied Biosystems Division, ABD) ile yapıldı.
Biyokimyasal Analiz
Hasta ve kontrol gruplarında; serum aspartat aminotransferaz (AST), ALT, “tumor necrosis factor”-alfa (TNF-alfa), “transforming growth factor-beta” (TGF-beta), IL-10 değerleri çalışıldı. TNF-alfa, TGF-beta ve IL-10 değerlerini ölçmek için 10 cc venöz kan, parafin içeren biyokimya tüplerine alındı. Kanlar beş dakika boyunca 5000 devirde santrifüj edildi. Bu işlemler bir saat içerisinde gerçekleştirildi. Santrifüj işleminden sonra Eppendorf tüpüne konulan serumlar çalışma gününe kadar -80 °C’de derin dondurucuda saklandı. Serum sitokin düzeyleri kit prosedürleri uyarınca ELISA yöntemiyle ölçüldü. DiaSource® TNF-α -ELISA kiti (BioVendor Group, Belçika) ile çalışılan TNF-alfa, DiaSource® IL-10 ELISA kiti (BioVendor Group, Belçika ) ile çalışılan IL-10 ve ELISA- Multispecies TGF-β1 kiti (BioVendor Group, Belçika) ile çalışılan TGF-beta düzeylerine, hasta grubunda tedavinin 0. 12. ve 48. haftasındaki serum örneklerinden ve kontrol grubunda ise tek bir serum örneğinden çalışıldı. Serum örneklerinde saptanan değerler pg/ml olarak kaydedildi. Hasta ve kontrol grubundaki serum ALT değerleri hastanemiz biyokimya laboratuvarında çalışıldı.
İstatistiksel Analiz
Karaciğer fibrozis derecesi (evre) ve HAİ skorları ile olgu ve kontrol grubunun TNF-alfa, IL-10, TGF-beta değerleri arasındaki ilişki araştırıldı. İstatistiksel analiz için Spearman korelasyon testi kullanıldı. Verilerin analizi, SPSS 23.0 (IBM Corp., ABD) programında yapıldı. Tanımlayıcı istatistiklerde, yüzde dağılımları ve ortalama standart sapma kullanıldı. Kategorik verilerin analizinde χ² testi kullanıldı. Normal dağılıma uyan yaş verisinde iki kategorili değişkenler karşılaştırılırken bağımsız örneklerde t testi, ikiden fazla kategorili değişkenlerde tek yönlü varyans analizi (ANOVA) testi kullanıldı. Tüm bağımsız değişkenler normal dağılım göstermektedir. Yorumlamalarda anlamlılık düzeyi p<0.05 olarak alındı.
BULGULAR
Çalışmaya, 43 hasta ve 43 kişilik kontrol grubu olmak üzere toplam 86 kişi dâhil edildi. Hasta grubunun yaş ortalaması 49.54±13.02 ve kontrol grubunun yaş ortalaması 48.3±14.1 idi. Hasta grubunda yaşlar 36 ile 65 arasında kontrol grubunda ise 34 ile 63 arasında değişmekte olup her iki grup arasında istatistiksel olarak fark gözlenmedi.
Hasta ve kontrol grubunda; IL-10, TNF-alfa, TGF-beta ve ALT değerleri ile HAİ arasında pozitif korelasyon bulundu. Değerler karşılaştırıldığında istatistiksel olarak anlamlı bir sonuç elde edildi ancak HAİ ile IL-10 arasında istatistiksel olarak bir korelasyon bulunamadı.
IL-10, TNF-alfa ve TGF-beta ortalama değerleri; hasta grubunda sırasıyla 43.33 pg/ml, 318 pg/ml ve 14 159 pg/ml olarak tespit edilirken söz konusu oranlar kontrol grubunda sırasıyla 6.84 pg/ml, 6.53 pg/ml ve 3267 pg/ml idi. Her üç sitokin düzeyi değerlendirildiğinde hasta ile kontrol grupları arasında istatistiksel olarak anlamlı düzeyde fark saptandı (p=0.000) (Tablo 1).
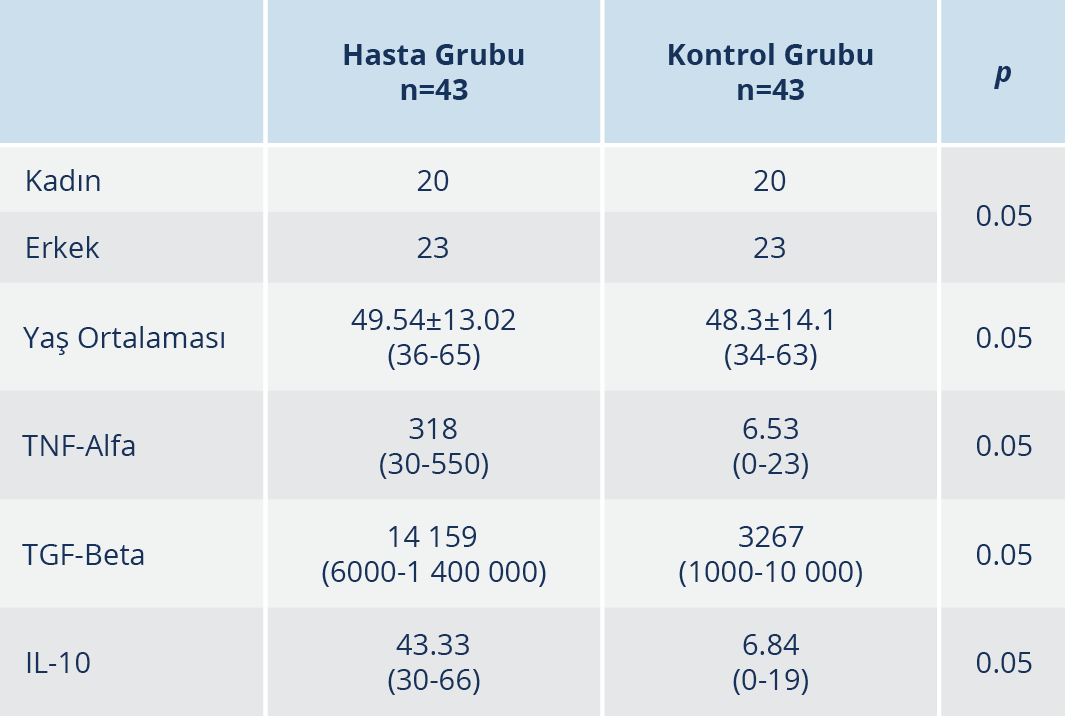
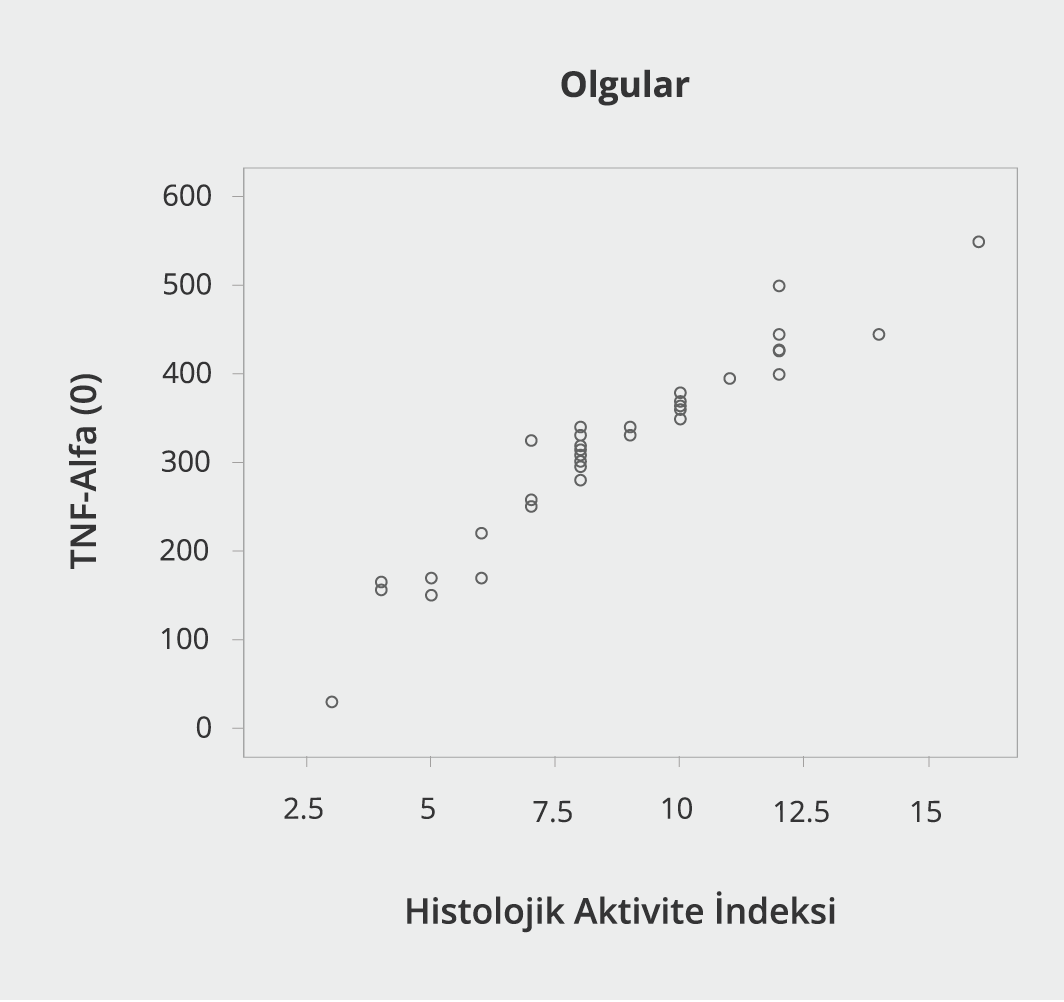
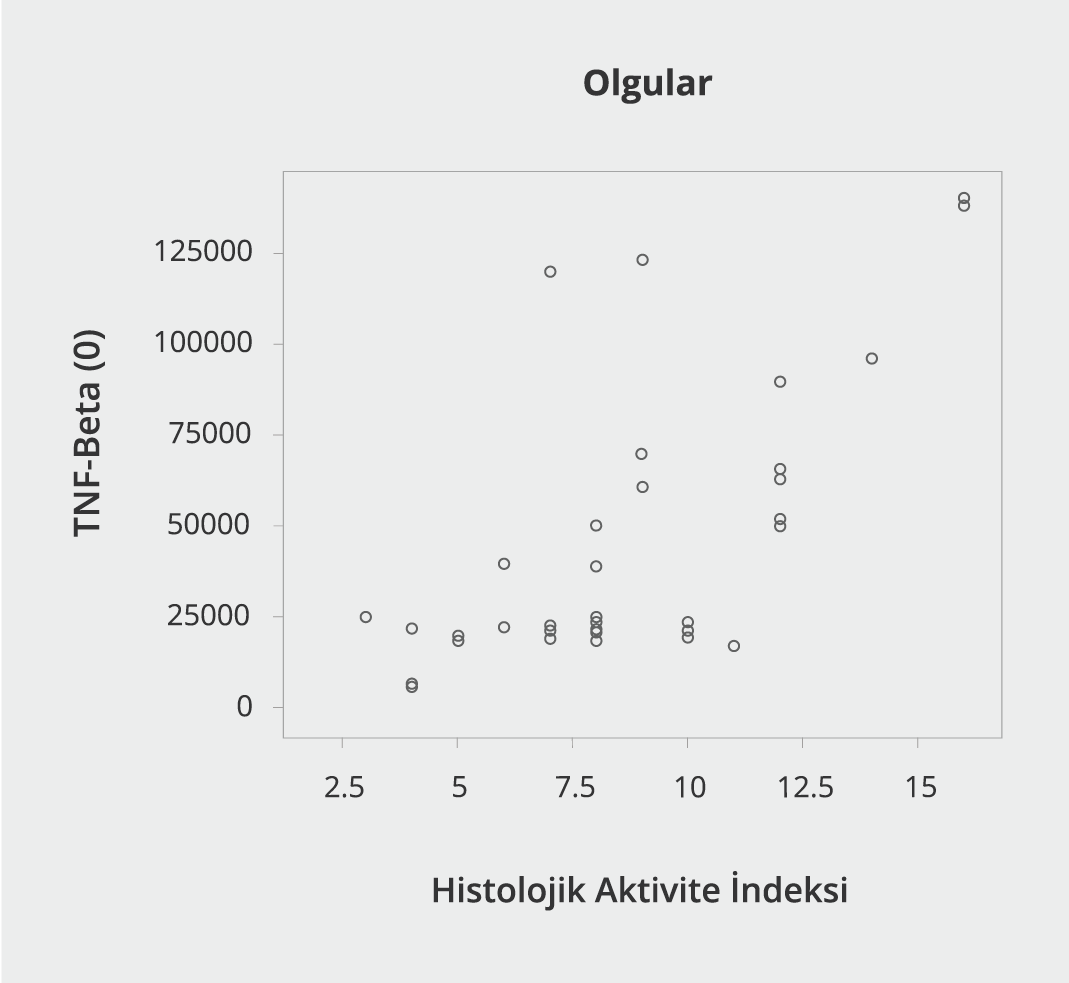
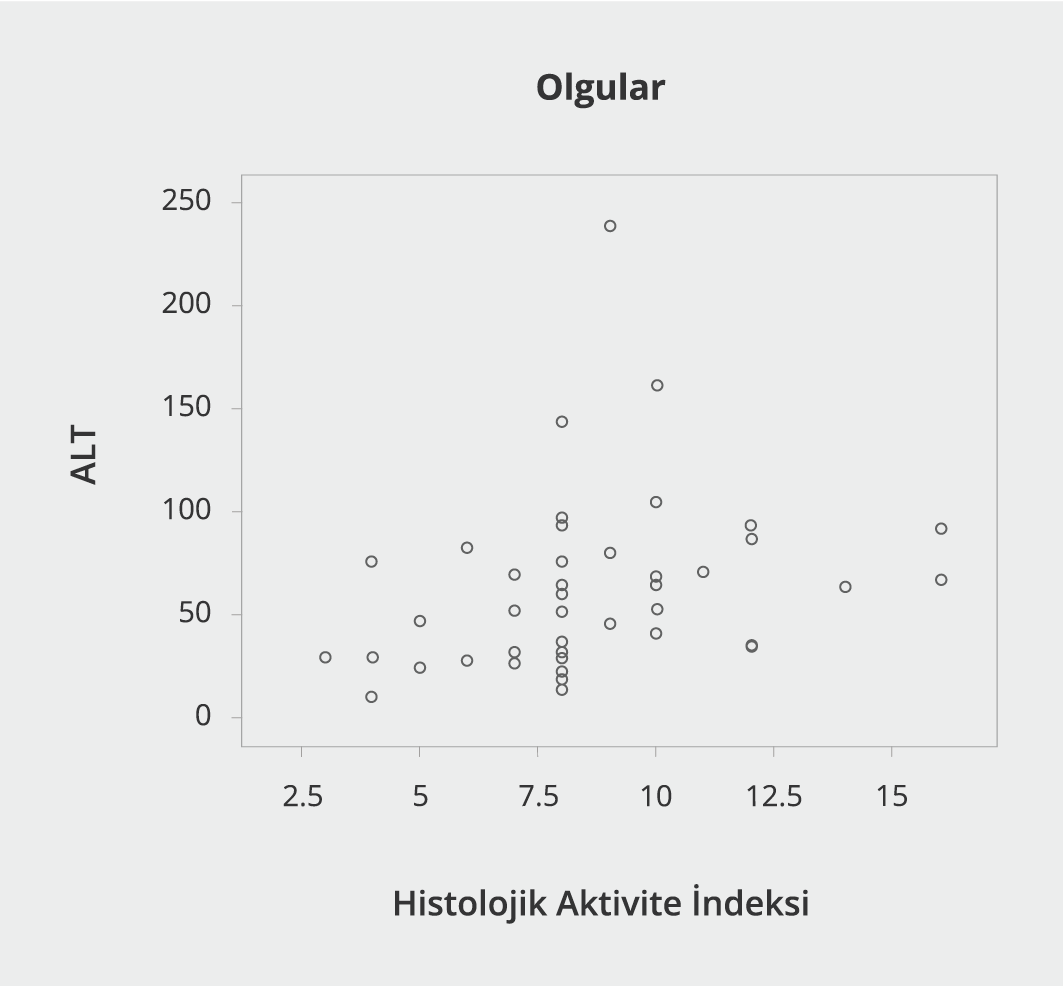
Histolojik aktivite indeksi skoru ile TNF-alfa arasında çok kuvvetli tam korelasyon bulunmuş [Spearman sıralama korelasyon katsayısı (rho)=0.965)] olup istatistiksel olarak anlamlı düzeydedir (p=0.0027) (Şekil 1). HAİ ile TNF-beta arasında da belirgin ilişki (rho=0.446) olup istatistiksel olarak anlamlı düzeydedir (p=0.0035) (Şekil 2). Histolojik aktivite indeksi skoru ile IL-10 arasında istatistiksel olarak bir korelasyon bulunamadı (p=0.159) (Şekil 3). Hasta grubunda HAİ ile serum ALT değerleri arasında belirgin ilişki bulundu (rho=0.438) (Şekil 4).
İRDELEME
Hücresel immün cevap KHC’li hastalarda karaciğer hastalığı patogenezinde temel bir role sahiptir (5). Pro- ve anti-inflamatuar sitokinler arasındaki dengesizlik, sitolizin ve/veya hepatik lezyonların veya fibrozisin ilerlemesine neden olur (6). Hepatit virusuna karşı etkili bağışıklık yanıtı Tc (CD8+) ve Th (CD4+) hücreleri ile sağlanır. B lenfositlerin, “class 2 major histocompatibility complex” (MHC) molekülleri ile viral peptidleri CD4+ T lenfositlere sunarak sitokin salınımını ve bu sitokinlerin B ve CD8+ T hücre aktivitesini düzenledikleri düşünülmektedir. HCV’ler çeşitli düzeylerde sitokin ağına müdahale ederek Th2/Tc2 sitokin profilini uyarmakta ve bu sayede bağışıklık yanıtından kaçmaktadır. İnfeksiyon kontrol mekanizmasındaki yetersizlik pro-inflamatuar kemokinler tarafından uyarılan inflamatuar hücrelerin sürekli karaciğer parankimi içine infiltrasyonlarına ve karaciğer hasarına yol açar, sonuç olarak karaciğer sirozu gelişir (3).
Hepatit C virusu ile infekte hastaların, fibrozise ilerleyişi henüz tam olarak anlaşılmış değildir. Tc (CD8+) hücrelerinin erken cevabı viral klirenste önemli olabilir (8). TNF-alfa, TGF-beta, IL-10 gibi bazı sitokin ve kemokinler antiviral mekanizmada rol oynar. Akut ve kronik karaciğer hastalıkları, pro- ve anti-inflamatuar sitokinlerin artmış ekspresyonuna bağlı inflamatuar süreçlerdir (9). Bu bağlamda virusa karşı oluşan farklı sitokin cevapları farklı karaciğer hasarlarına sebep olabilmektedir (10).
Bizim çalışmamızda, karaciğer inflamasyonu ve fibrozise etkili olabilecek sitokinlerden TNF-alfa, IL-10 ve TGF-beta araştırıldı. İnfeksiyöz patojenlerin neden olduğu akut inflamatuar cevabın ana mediyatörü olan TNF-alfa, antiviral defans mekanizmasını tetikleyerek inflamasyonun progresyonunu sağlamaktadır (11,12); antikor üretimini tetikleyerek infeksiyonun şiddetlenmesine de sebep olabilir (8). Karaciğerde lokal inflamatuar alanlarda infiltrasyon yapan mononükleer hücrelerde üretilip sekrete edilir ve bu TNF-alfa’nın kronik karaciğer hastalığında inflamatuar aktivitede rol oynayabileceğini düşündürmektedir (13).
Çalışmamızda, serum TNF-alfa seviyeleri; hasta grubu ve sağlıklı kontrol grubu ile karşılaştırıldı; HCV ile infekte hastalarda, kontrol grubuna göre daha yüksek bulundu (p<0.05). Benzer şekilde, Zylberberg ve arkadaşlarının 60 KHC’li hastada yaptıkları çalışmada, TNF-alfa düzeyi KHC infeksiyonlu hastalarda, sağlıklı kontrol grubundan daha yüksek ve istatistiksel olarak anlamlı düzeyde bulunmuştur (14). TNF-alfa’nın inflamatuar süreçte rol oynayan bir sitokin olması bu durumu açıklamaktadır.
Bir diğer önemli sitokin olan TGF-beta, karaciğer rejenerasyonunda hepatosit proliferasyonunu inhibe eder ve karaciğer sirozunda hepatositler tarafından ekstraselüler matriks proteinlerin yapımını güçlü bir şekilde uyarır. Kronik hepatit ve sirozda, fibrozis patogenezinde önemli rol oynar. Çalışmamızda, serum TGF-beta seviyeleri hasta ve kontrol gruplarında karşılaştırıldı ve serum TGF-beta değerleri HCV ile infekte hastalarda, kontrol grubuna göre daha yüksek bulundu. Yapılan bir çalışmada, TGF-beta’nın histolojik evreyi yansıttığı ve TGF-beta’nın aktivasyonunun fibrogenezisin başlangıç noktası olduğu belirtilmiştir (15). Kırmaz ve arkadaşlarının (16) yaptıkları çalışmada da serum TGF-beta düzeyleri kontrol grubuna göre KHC’li hastalarda yüksek bulunmuştur.
IL-10, aktive olmuş makrofajlarca salgılanan ve onların fonksiyonlarını inhibe eden bir sitokindir. Sitokin sekretuar inhibitör faktörü olarak da bilinen IL-10, anti-inflamatuar etkiye sahiptir. Anti-inflamatuar etkisiyle ALT düzeyini normalleştirir, hepatik lezyonları sınırlar ve fibrozisi azaltır. Ayrıca IFN-gamma sentezi, IL-10 tarafından inhibe edilir (6). Çalışmamızda serum IL-10 seviyeleri hasta ve kontrol grubunda karşılaştırıldı ve hasta grubunda IL-10 serum değerleri, sağlıklı kontrol grubuna göre yaklaşık 7 kat daha yüksek olarak saptandı (p=0.000). Yapılan farklı çalışmalarda da hepatit C ile infekte hasta grubunda IL-10 düzeyi, sağlıklı kontrol grubuna göre istatistiksel olarak anlamlı düzeyde yüksek saptamıştır (17,18).
TNF-alfa’nın HAİ ile ilişkisini belirlemek için hasta grubundaki bireylerin TNF-alfa değerleri ile HAİ dereceleri karşılaştırıldı. Fibrozis skoru ne olursa olsun orta derecede HAİ olanlarda TNF-alfa, minimal HAİ olanlara göre istatistiksel olarak anlamlı düzeyde daha yüksek bulundu. Neuman ve arkadaşları da çalışmalarında benzer sonuca ulaşmıştır (19); yapılan 778 KHC’li hastayı kapsayan farklı bir çalışmada ise karaciğer inflamasyon derecesi ile TNF-alfa seviyeleri arasında pozitif korelasyon saptanmıştır (rho=0.92) (20).
Çalışmamızda, TGF-beta ve HAİ arasında lineer ilişki saptanırken; IL-10 değerleri ile HAİ arasında istatistiksel olarak anlamlı düzeyde bir ilişki bulunmadı.
Hepatit C virusu infeksiyonu olan hastalarda karaciğerdeki inflamasyonun göstergesi HAİ ile belirlenmektedir. HAİ ile ALT düzeyleri arasında da anlamlı bir ilişki vardır. HAİ arttıkça ALT değerlerindeki yükseklik dikkat çekmektedir (21,22).
Sonuç olarak; karaciğer biyopsisi zahmetli ve komplikasyonları ciddi sonuçlar doğurabilecek bir işlemdir. Çalışmanın yapıldığı dönemde KHC hastalarına tedavi öncesi zorunlu karaciğer biyopsisi yapılmaktaydı. Günümüzde biyopsi zorunluluğu ortadan kalkmıştır. Kronik hepatit C hastalığı sinsi seyreden bir hastalık olduğu için tedavi öncesi karaciğer hasarının tespiti son derece önemlidir. Karaciğer biyopsi incelemesinin sonuçlarını dolaylı yollardan gösterebilecek olan biyokimyasal belirteçler hastalığın ve karaciğerin durumu hakkında fikir yürütmemize yardımcı olabilir. Çalışmamızda HAİ ile ALT’nin yanı sıra sitokinler arasında lineer ilişki tespit edildi. Serum sitokin ve ALT değerlerinin birlikte değerlendirilmesinin, KHC’li hastalarda başlangıç karaciğer biyopsisinde saptanan HAİ progresyonu hakkında öngörüde bulunmamıza yardımcı olabileceğini düşünmekle birlikte bu konuda daha kapsamlı çalışmalara ihtiyaç olduğu kanısındayız.
Hasta Onamı
Hastalardan ve kontrol grubundan yazılı onam alındı.
Etik Kurul Kararı
Çalışma, Necmettin Erbakan Üniversitesi Meram Tıp Fakültesi Etik Kurulu tarafından 25 Temmuz 2008 tarih ve 206 karar numarasıyla onayladı; dahil edilen hastalardan ve kontrol grubundan yazılı onam alındı.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – ETA, B.B.; Tasarım – İE, B.B.; Denetleme – E.T.A., İ.E.; Malzemeler/Hastalar – B.B.; Veri Toplama ve/veya İşleme – E.T.A., İ.E., B.B.; Analiz ve/veya Yorum – E.T.A., İ.E., B.B.; Literatür Taraması – B.B.; Makale Yazımı – B.B.; Eleştirel İnceleme – ETA, İ.E.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Ertem GT, Sayan M, Hekimoğlu Ş, Tülek N. [Cross resistance to HCV NS3 inhibitor developing during treatment with peginterferon, ribavirin and telaprevir]. Klimik Derg. 2015;28(2):92-4. Turkish. [CrossRef]
- Kang W, Shin E. Clinical implications of chemokines in acute and chronic hepatitis C virus infection. Yonsei Med J. 2011;52(6):871-8. [CrossRef]
- Aygen B, Demirtürk N, Türker N, et al. [Management of chronic hepatitis C virus infection: a consensus report of the study group for viral hepatitis of the Turkish Society of Clinical Microbiology and Infectious Diseases-2017 update]. Klimik Derg. 2017;30(Suppl. 1):2-36. Turkish. [CrossRef]
- Öztürk-Çerik H, Esen Ş, Altıntaş-Öner B, Çelik M, Özdemir T, Tanyel E. [Evaluation of the effectiveness of direct-acting antiviral agents in patients with hepatitis C]. Klimik Derg. 2020; 33(3): 297-306. Turkish. [CrossRef]
- Aygen B. Kronik hepatit C’de tedavi ve izlem. In: Köksal İ, Leblebicioğlu H, eds. Kronik hepatitlerin tanı ve tedavisinde güncel yaklaşımlar. Ankara: Bilimsel Tıp Yayınevi, 2009: 223-33.
- Li H, Huang MH, Jiang JD, Peng ZG. Hepatitis C: From inflammatory pathogenesis to anti-inflammatory/hepatoprotective therapy. World J Gastroenterol. 2018;24(47):5297-311. [CrossRef]
- Tekin S, Sümer Ş, Demirtürk N, Aygen B. [Chronic hepatitis C in the pandemic]. Klimik Derg. 2021;34(1):13-7. Turkish. [CrossRef]
- Akhan SC, Gurel E, Sayan M. The sustained virologic response of nonresponder hepatitis C virus patients with retreatment. Indian J Pathol Microbiol. 2011;54(1):81-4. [CrossRef]
- Fallahi P, Ferrari SM, Giuggioli D, et al. Chemokines in the pathogenesis and as therapeutical markers and targets of HCV chronic infection and HCV extrahepatic manifestations. Curr Drug Targets. 2017;18(3):786-93. [CrossRef]
- Kronenberger B, Welsch C, Forestier N, Zeuzem S. Novel hepatitis C drugs in current trials. Clin Liver Dis. 2008;12:529-55. [CrossRef]
- Altunok ES, Sayan M, Akhan S, et al. Protease inhibitors drug resistance mutations in Turkish patients with chronic hepatitis C. Int J Infect Dis. 2016;50:1-5. [CrossRef]
- Perlin CM, Ferreira VL, Borba HHL, et al. Quality of life in Brazilian patients with treated or untreated chronic hepatitis C. Rev Inst Med Trop SaoPaulo. 2017;59:e81. [CrossRef]
- Post J, Ratnarajah S, Lloyd AR. Immunological determinants of the outcomes from primary hepatitis C infection. Cell Mol Life Sci. 2009;66(5):733-56. [CrossRef]
- Zylberberg H, Rimaniol AC, Pol S, Mason A. Solubl tumor necrosis factor reseptorsin chronic hepatitis C. J Hepatol.1999;30:185-91. [CrossRef]
- Flamm SL. Chronic hepatitis C virus infection. Jama. 2003;289:2413-7. [CrossRef]
- Kirmaz C, Terzioglu E, Topalak O, et al. Serum transforming growth factor-beta1(TGF-beta1) in patients with cirrhosis, chronic hepatitis B and chronic hepatitis C [corrected]. Eur Cytokine Netw. 2004;15(2):112-6. Erratum in: Eur Cytokine Netw. 2004;15(3):272.
- Avrămescu CS, Comănescu V, Popescu SN, et al. Correlations among the serum levels of some interleukins and the histopathological aspects in chronic viral hepatitis C. Rom J Morphol Embryol. 2008;49(1):57-62.
- Abayli B, Canataroğlu A, Akkiz H. Serum profile of T helper 1 and T helper 2 cytokines in patients with chronic hepatitis C virus infection. Turk J Gastroenterol. 2003;14(1):7-11.
- Neuman MG, Benhamou JP, Malkiewicz IM, et al. Kinetics of serum cytokines reflect changes in the severity of chronic hepatitis C presenting minimal fibrosis. J Viral Hepat. 2002;9(2):134-40. [CrossRef]
- Neuman MG, Benhamou JP, Marcellin P, et al. Cytokine – chemokine and apoptotic signatures in patients with hepatitis C. Transl Res. 2007;149(3):126-36. [CrossRef]
- Mohamadnejad M, Montazeri G, Fazlollahi A, et al. Noninvasive markers of liver fibrosis and inflammation in chronic hepatitis B-virus related liver disease. Am J Gastroenterol. 2006;101(11):2537-45. [CrossRef]
- Eroğlu, E, Bitirgen M. [Essential mixed cryoglobulinemia in patients with chronic hepatitis C]. Turkiye Klinikleri J Intern Med. 2018; 3(2):56-60. Turkish. [CrossRef]