En Çok Okunanlar
Özet
İnsan immün yetmezlik virusu (human immunodeficiency virus – HIV) ile yaşayan bireylerde, hepatit B virusu (HBV) ve hepatit C virusu (HCV) ile koinfeksiyon, karaciğer komplikasyonlarının artmasına neden olmaktadır. Hepatit B virusu ve HIV, kan yolu ve korunmasız cinsel ilişkiyle bulaşmaktadır. HBV ile infekte olan ve HIV’le yaşayan bireyler, karaciğerle ilişkili morbidite ve mortalite açısından yüksek risk altındadır. Hepatit C virusu ile ilişkili karaciğer hasarı, HIV ile koinfekte kişilerde daha hızlı ilerlemektedir. HCV infeksiyonu, HIV infeksiyonunun yönetimini de etkileyebilir. Bu derlemede, HIV-HCV ve HIV-HBV koinfeksiyonlarının yönetiminin irdelenmesi amaçlandı.
Öne Çıkanlar
- Dünya Sağlık Örgütü’nün Viral Hepatitlerin Eliminasyonu Programı’na göre 2030 yılında HBV, HCV ve HIV infeksiyonlarında azalma beklenmektedir.
- Her üç viral infeksiyonun ayrı ayrı yönetiminde koinfeksiyon durumları da mutlaka dikkatle irdelenmelidir.
- Derlemede özellikli hasta grubunun tanı ve tedavisinde güncellemeler önerilmektedir.
HIV-HBV KOİNFEKSİYONU
Epidemiyoloji
Dünyada, bölgesel farklılıklar olmakla birlikte, insan immün yetmezlik virusu (human immunodeficiency virus – HIV) ile yaşayan bireyler arasında hepatit B virusu (HBV) koinfeksiyonu %7.4 sıklığında görülmektedir (1). Damar içi madde kullanıcıları arasında ise sıklık %11.8 gibi daha yüksek bir oranda seyretmektedir (2).
1997 ve 2021 yılları arasında, İtalyan Antiretroviral-Naif Hastalar Kohortu (Italian Cohort of Antiretroviral-Naive Patients – ICONA)’nda HIV ile yaşayan 19 binden fazla bireyle yapılan bir çalışmada, HBsAg-pozitiflik sıklığı ortalama %6.6 olarak bulunmuştur. 1997’de %7.1 olan bu oranın 2021’de %4.5’e gerilediği görülmüştür. Aynı çalışmada koinfeksiyon prevalansının erkeklerde %6.6 ile kadınlardan (%4.6) daha yüksek olduğu ve HIV bulaşma şekline göre değişiklik gösterdiği belirlenmiştir. Damar içi madde kullanıcıları arasında yaygınlık %8.8, heteroseksüel temaslılar arasında %5.8, homoseksüel/biseksüel temaslılar arasında %5.3 ve HIV bulaş yolu bilinmeyenler arasında %6.4 olarak saptanmıştır (3).
Patogenez
Hepatit B virusunun neden olduğu hepatitin patogenezi esas olarak immün aracılı olup virusun sitopatik etkilerinden kaynaklanmaz. HBV infeksiyonunda spontan olarak iyileşen hastalar, çeşitli HBV epitoplarına karşı güçlü CD4+ ve CD8+ T-hücre yanıtları geliştirir (4,5). Buna karşılık, kronik hepatit B (KHB) infeksiyonu gelişen hastalar, daha zayıf ve kısıtlı T-hücre yanıtına sahiptir. Akut hepatit B’de iyileşme, yaşam boyu koruyucu bağışıklık ile ilişkilendirilmekle birlikte polimeraz zincir reaksiyonu gibi hassas tekniklerle eser miktarda virus tespit edilebilir. Bu, kalıntı virusun hücresel ve humoral bağışıklık tepkileri tarafından kontrol edildiğini ve vireminin immünsüpresyon ortamında yeniden ortaya çıkabileceğini düşündürmektedir. Bu durum, immünsüpresif tedavi (kemoterapi veya kortikosteroid tedavisi) alan hastaların yanı sıra HIV ile infekte ve ileri immünsüpresyonu olan hastalarda, HBV replikasyonunun yeniden aktivasyonu ve alevlenmelerle kendini gösterebilir (6,7). KHB infeksiyonu sırasında spontan serum aminotransferaz alevlenmeleri, HBV’ye karşı immünolojik yanıtlar ile viremideki kantitatif varyasyonlar arasındaki denge değişikliklerine bağlanmıştır. Alevlenmeye eşlik eden HBeAg serokonversiyonundan önce periferik kanda HBV’ye özgü T-hücre yanıtları tespit edilmiştir (8). T-hücre yanıtlarını kendiliğinden artıran faktörler iyi anlaşılamamıştır. T-hücre yanıtları, HBV antiviral tedavisinin neden olduğu HBV DNA’daki bir azalmaya yanıt olarak artabilir. HIV/HBV koinfeksiyonu olan hastalarda, tek başına HBV olan hastalara kıyasla artan HBV replikasyonu ve daha düşük HBeAg serokonversiyon oranlarının gözlenmesi, koinfeksiyonda virolojik faktörlerin de patogeneze katkıda bulunabileceğini düşündürmektedir (9).
İnsan immün yetmezlik virusu ile ilişkili immünsüpresyon, HBV infeksiyonunun doğal seyrini etkiler. Epidemiyolojik çalışmalar, HBV DNA seviyeleri ve reaktivasyon oranlarının, HIV ile yaşayan bireylerde, sadece HBV ile infekte bireylere göre daha yüksek olduğunu, hepatit B yüzey antijeni (HBsAg) ve HBV viremisinin koinfekte geçirilmiş HBV infeksiyonu ile uyumlu serolojik belirteçleri olan hastalarda tekrar ortaya çıkabileceğini, HIV ile yaşayan hastalarda HBeAg’nin spontan klerensinin daha düşük olduğunu göstermiştir (10).
İnsan immün yetmezlik virusu ile yaşayan bireylerde, HBV infeksiyonu sonrasında kronik infeksiyon gelişme riskinin artışı, daha önce HBV ile infekte olmamış HIV ile yaşayan ve HIV negatif bireyleri içeren bir hepatit B aşı çalışmasında gösterilmiştir. Söz konusu çalışmada, KHB infeksiyonunun, HIV ile yaşayan bireylerin %21’inde, HIV ile infekte olmayan hastaların ise %7’sinde geliştiği tespit edilmiştir (11).
İnsan immün yetmezlik virusu infeksiyonu varlığında HBV reaktivasyon riski, 69’u HIV, 141’i HBV ile infekte hasta üzerinde yapılan retrospektif bir çalışmada değerlendirilmiştir. HBV reaktivasyon hızı HIV ile infekte hastalarda yüksek saptanmış ve bu yükseklik düşük CD4+ sayısıyla ilişkili bulunmuştur. HIV koinfeksiyonu; IFN-α monoterapisine daha zayıf yanıt, daha sık HBV reaktivasyonu ve düşük CD4+ sayısı (<200/mm3), siroz ve siroza bağlı ölüm insidansındaki artış ile ilişkilendirilmiştir (12).
Kronik hepatit B’nin HIV’in doğal seyrini etkileyip etkilemediği konusunda tartışmalar devam etmektedir. Bazı gözlemler, HBV infeksiyonunun daha hızlı bir HIV progresyonu seyriyle ilişkili olduğu endişesini artırmıştır (13,14). Nijerya’da HIV’le infekte 1302 hasta ve HIV/HBV ile koinfekte 262 hasta üzerinde yapılan bir çalışmada, yüksek HBV replikasyon düzeylerinin, antiretroviral tedavi (ART) başlatıldığında daha düşük olan CD4+ hücre sayılarıyla ilişkili olduğu bulunmuştur (15). Bununla birlikte iki prospektif ve bir retrospektif çalışmada, HBV koinfeksiyonunun, CD4+ hücre sayısının tükenmesi, kazanılmış immüm yetmezlik sendromu (acquired immune deficiency sydrome- AIDS)’nda ilerleme veya AIDS ile ilişkili ölüm üzerinde herhangi bir etkisi olmadığı gösterilmiştir (16).
Hastaların Yönetimi
Uluslararası kılavuzlar, bulaşma yollarının benzer olması nedeniyle HIV ile yaşayan tüm bireylerin HBV açısından, HBV ile yaşayan bireylerin de HIV açısından test edilmesini önermektedir (17-19). HBV için ilk olarak HBsAg, anti-HBs ve anti-HBc sonuçları değerlendirilmelidir. Bu testler ile hastalarda üç farklı serolojik profil tanımlanabilir;
- HBsAg-negatif, anti-HBs-negatif ve anti-HBc-negatif: HBV infeksiyonu olmayan HIV ile yaşayan bireyler.
- HBsAg-negatif, anti-HBs-negatif/pozitif ve anti-HBc-pozitif: Geçmişte HBV infeksiyonu olan HIV ile yaşayan bireyler.
- HBsAg-pozitif, anti-HBs-negatif, anti-HBc-pozitif: Devam eden HBV infeksiyonu olan HIV ile yaşayan bireyler.
HBV Seronegatif Hastalar
Hepatit B virusu seronegatif (HBsAg-negatif, anti-HBs-negatif ve anti-HBc-negatif) olan ve HBV infeksiyonuna duyarlı HIV ile yaşayan tüm bireyler hepatit B aşısı ile bağışıklanmalıdır. Yapılan çalışmalarda, HIV infeksiyonu olan erişkin bireylerde, rekombinant HBV aşılarına immünolojik yanıt, HIV negatif olan sağlıklı erişkinlere göre daha düşük bulunmuştur (20). Bu nedenle, bağışıklığı baskılanmış hastalarda koruyucu bir anti-HBs yanıtı elde etmek için daha yüksek dozlarda (40 µg) veya güçlendirilmiş (dört doz) veya adjuvanlı aşılar önerilebilmektedir (21,22). Randomize kontrollü ve gözlemsel olarak gerçekleştirilen farklı çalışmalarda ise HBV sayısının ölçülemeyecek kadar düşük olmasının veya minimum HIV RNA yüküne sahip olmanın yanı sıra başlangıçta daha yüksek CD4+ hücre sayısına sahip olmanın, HBV aşısına başarılı bir yanıtla en sık ilişkili olan faktörler olduğu belirlenmiştir (23).
Geçmişte HBV İnfeksiyonu Olanlar
Okült HBV infeksiyonu (OBİ), hepatositlerin çekirdeğinde “covalently closed circular DNA” (cccDNA) olarak tanımlanan viral mini kromozomun kalıcılığı ile karakterize edilen bir tablodur. Geçmişinde HBV infeksiyonu olan bireylerde, cccDNA’nın replikasyon aktivitesi ve viral protein ekspresyonu, konağın immün yanıtı tarafından güçlü bir şekilde baskılanır (24). OBİ, kronik HBV infeksiyonunun doğal seyrindeki olası evrelerden biri olarak kabul edilmektedir (5). Bu hastalarda, immünolojik kontrol azalırsa HBV replikasyonunun yeniden aktivasyonu ile karşılaşılabilir; HIV ile yaşayan hastalarda, OBİ reaktivasyonu sık bildirilmemektedir ve uygun ART alan hastalarda ihmal edilebilir hale gelmiştir (25). Bununla birlikte, HBV’ye karşı aktivitesi bulunan ilaçları içeren antiretroviral rejimler kesildiğinde, koinfekte hastalarda HBV reaktivasyonu meydana gelebilir. Salpini ve arkadaşlarının (26) yaptığı çalışmada, HBsAg-negatif/anti-HBc-pozitif HIV ile yaşayan bireylerin tenofovir disoproksil fumarat (TDF) veya tenofovir alafenamid fumarate (TAF) içeren tedavileri değiştirildiğinde HBV virolojik reaktivasyonunun sık olabileceği gösterilmiştir. Çalışmaya, ICONA kohortundan HIV infeksiyonu olan ve 12 aydan daha uzun süre HIV yükü virolojik olarak baskılanmış, 101 HBsAg-negatif/anti-HBc-pozitif hasta dahil edilmiştir. Tedavi değişikliğinden sonraki 12 ay içinde, hastalar HBV DNA ve HBV RNA için test edilmiş, TDF/TAF’ın kesilmesinden sonra, hastaların önemli bir kısmında (%40) HBV virolojik reaktivasyonu meydana geldiği görülmüştür. TDF/TAF’tan uzun süre yoksun kalınması, serum HBV-DNA düzeyinde ilerleyici bir artışla korele bulunmuş ve HBV replikatif aktivitesinin gelişimini desteklediği görülmüştür. Ayrıca, HBV reaktivasyonu, HIV aracılı immün yetmezlik derecesi açısından da değerlendirilmiş, daha düşük tespit edilen CD4+ T-hücre sayısının (<100 hücre/mm3), çok değişkenli analizle artan HBV virolojik aktivasyonu riski ile korele olduğu saptanmıştır.
Bu bulgular, HIV infeksiyonu olan HBsAg-negatif/anti-HBc-pozitif hastaların, özellikle TDF/TAF içermeyen bir tedaviye geçişlerinin planlanması durumunda uygun bir şekilde taranmasının ve sürekli izlenmesinin önemini göstermektedir. Ek olarak, immünsüpresif tedaviler nedeniyle de HBV reaktivasyonu meydana gelebilir. Bu nedenle, HBV’ye karşı aktivitesi bulunan ve antiretroviral tedavi almayan, ancak düşük riskli immünsüpresif tedavi alan anti-HBc-pozitif HIV ile yaşayan bireyler, lenfoma/lösemi veya kök hücre ya da “solid” organ transplantasyonu gibi durumlar için B lenfositleri tüketen güçlü immünsüpresif ilaçlarla tedavi edilirken, HBV reaktivasyonunun erken tespiti için HBV-DNA ve HBsAg ile izlenmeli ve hatta HBV reaktivasyonunu önlemek için TDF veya TAF içeren tedaviler almalıdır (27).
HBsAg Pozitif HIV ile Yaşayan Kişiler
İnsan immün yetmezlik virusu ile yaşayan ve devam eden HBV infeksiyonu olan kişilerde, infeksiyonun evresini belirlemek ve karaciğer hastalığının aktivitesini ve şiddetini değerlendirmek önemlidir. Bu nedenle, HBsAg pozitif hastaların ilk değerlendirmesi; HBeAg, anti-HBe ve serum HBV DNA düzeylerinin kontrolünü, tam bir tıbbi öykü almayı, fizik muayene ve tam kan sayımını, alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), alkalen fosfataz (ALP), gamma-glutamil transferaz (GGT) ve karaciğer sentez fonksiyonu (pıhtılaşma testleri, albümin vb.) testlerini içermelidir. Karaciğer fibrozu; karaciğer biyopsisi veya karaciğer sertlik ölçümleri ve karaciğer fibrozunun serum biyobelirteçlerini içeren invazif olmayan yöntemlerle belirlenmelidir. Takip sırasında, karaciğer sirozu olan koinfekte hastalara, hepatoselüler karsinom taraması için her altı ayda bir seri karaciğer ultrason muayenesi ve alfa-fetoprotein düzeyi ölçümleri yapılmalıdır; hepatit D virusu (HDV) ve/veya HCV, alkol kullanımı, steatoz veya steatohepatitli metabolik karaciğer hastalığı ve kronik karaciğer hastalığının diğer nedenleri de dışlanmalıdır (17-19).
İnsan immün yetmezlik virusu /hepatit B virusu koinfeksiyonunun doğal seyri üzerine yapılan birkaç çalışmada, sadece HBV ile infekte hastalara kıyasla, koinfekte hastalarda daha yüksek HBV replikasyon seviyeleri olduğu, sirozun daha hızlı ve daha sık geliştiği, hepatik dekompansasyon, hepatoselüler karsinom gelişimi ve karaciğer ile ilişkili mortalite açısından daha kötü bir prognozun olduğu gösterilmiştir (28-30).
Uluslararası kılavuzlar, karaciğer hastalığının ilerlemesini ve komplikasyonlarını önlemek, böylece sağkalımı sağlamak ve yaşam kalitesini iyileştirmek için kronik HBV infeksiyonu olan tüm HIV pozitif hastaların tedavi edilmesini önermektedir (17-19).
Mevcut Tedavi Stratejileri
Hepatit B virusu ile infekte hastaları tedavi etmek için onaylanmış iki ilaç sınıfı bulunmaktadır; pegile interferon-alfa (Peg-IFNα) ve nükleoz(t)id analogları (NA’lar). Nükleoz(t)id analogları, pregenomik RNA’yı DNA’ya revers olarak kopyaladığı için HBV yaşam döngüsünde çok önemli rolü olan bir enzim olan HBV polimeraz/revers transkriptazı (RT) inhibe eden ve oral olarak kullanılan antiviral ajanlardır. HBV polimeraz/revers transkriptaz, HIV gibi retrovirusların, revers transkriptazıyla yüksek homolojiye sahiptir ve aslında NA’ların çoğu ilk olarak ART için araştırılmıştır (31).
Entekavir (ETV), TDF ve TAF; yüksek potensleri ve direnç gelişimine karşı bariyerleri nedeniyle kronik aktif hepatit B infeksiyonu tedavisi için tüm uluslararası kılavuzlar tarafından birinci basamak monoterapi olarak önerilen üçüncü kuşak NA’lardır (18,19). Yeni viryonların üretimini bloke ederek serum HBV DNA’sını aşamalı olarak saptanamayan seviyelere düşürürler; ancak hepatosit çekirdeklerindeki cccDNA üzerinde çok az etkileri vardır veya hiç etkileri yoktur. İntrahepatik cccDNA’nın kalıcı olması, NA tedavisine ara verildikten sonra HBV replikasyonunun reaktivasyonunun nedenidir. Bundan dolayı, viral replikasyon kontrolünü sürekli sağlamak için uzun süreli tedavi gerekmektedir.
Emtrisitabin (FTC), lamivudin (3TC), TDF ve TAF, HBV’ye karşı aktiviteye sahip ART rejimlerinin bileşenleridir. TDF ve TAF, direnç mutasyonlarının gelişimi için yüksek bir genetik bariyere sahiptir. Entekavir, zayıf HIV aktivitesine de sahip olan bir HBV nükleozid analoğudur. Kılavuzlar, HIV ve hepatit B koinfeksiyonu olan tüm bireylerin, TDF veya TAF ve lamivudin veya emtrisitabin içeren kombine ART almasını önermektedir (17-19). CD4+ hücre sayısı ve HBV DNA düzeyi ne olursa olsun, mümkün olan en kısa sürede ART’ye başlanmalıdır (17).
İnsan immün yetmezlik virusu ile yaşayan ve böbrek ve/veya kemik metabolizma bozukluğu olan bireylerde, TAF TDF’ye tercih edilmelidir. Entekavir, HIV ile yaşayan ve önceden lamivudine maruz kalmayan bireylerde ve TAF’nin kesinlikle kontrendike olduğu durumlarda tamamen aktif ART ile kombine edilebilir. Peg-IFN monoterapisi ise artık HIV ile yaşayan bireylerde CD4+ hücre sayısından bağımsız olarak ART verilmesi gerektiği için kullanılmamaktadır (17).
Tedaviye Yanıtın ve İstenmeyen Etkilerin İzlenmesi
Tedavi edilen tüm hastalar, etkinlik ve güvenlik açısından düzenli olarak izlenmelidir. Kılavuzlar, ilk yıl boyunca her üç ayda bir ve sonrasında her 6-12 ayda bir karaciğer enzimlerinin izlenmesini önermektedir. Serum HBV DNA, ilk yıl boyunca her 3-6 ayda bir ve daha sonra 12 ayda bir değerlendirilmelidir. HBsAg, en az HBsAg kaybı olana kadar 12 aylık aralıklarla kontrol edilmelidir. İlaç toksisitesi (böbrek ve karaciğer enzimleri, kemik yoğunluğu) yakından izlenmeli ve böbrek fonksiyon bozukluğu varlığında antiretroviral ilaçların dozu ayarlanmalıdır. HBV reaktivasyon riskinin yüksek olması nedeniyle, HIV/HBV koinfeksiyonu olan hastalarda TDF veya TAF içeren ART’yi durdurmaktan kaçınılmalı ve mümkünse tedavi değişikliği, doğrulanmış HBsAg klirensinden sonra düşünülmelidir (17).
Gerçek Hayat Etkililik ve Güvenlik Verileri
Hepatit B virusu ile infekte hastalarda, uzun süreli ETV veya TDF monoterapisinin karaciğer hastalığının ilerlemesini önlediği ve karaciğer fibrozunun gerilemesini sağladığı önceki çalışmalarda gösterilmiştir (18). Ayrıca sirotik hastalardaki virolojik yanıt, dekompansasyonda azalma ve portal hipertansiyondaki iyileşmeyle birlikte karaciğer transplantasyon ihtiyacındaki azalmayla da ilişkili bulunmuştur (32,33). Bununla birlikte, yakın zamanda yapılan bir çalışmada, kronik hepatit B infeksiyonunda ETV veya TDF tedavisinin ilk beş yılından sonra azalan bir insidans bildirilmiş olmasına rağmen, hepatoselüler karsinomun yine de gelişebileceği ve NA’lar ile tedavi edilen hastalar için önemli bir komplikasyon olmaya devam ettiği gösterilmiştir (34).
Fransa’da gerçekleştirilen prospektif bir kohort çalışmada, ortalama 60 aylık bir süre boyunca izlenen ve TDF içeren ART alan 167 HIV/HBV koinfekte hastada, karaciğer fibrozu gelişimi değerlendirilmiş olup karaciğer fibrozisi seviyelerinin, koinfekte hastaların çoğunda stabil kaldığı ve virolojik olarak baskılanmış hastaların %17’sinde fibrozun ilerlediği gözlenmiştir (35). ICONA kohortunda bulunan 634 HIV/HBV koinfekte hasta, HBV’ye karşı aktif tedavi kullanımına göre (HBV’ye karşı aktivitesi olmayan ve ART tedavisi alan hasta sayısı=357) değerlendirilmiş ve hem tekli hem de ikili tedavinin, HBV tedavisi uygulanmamasına kıyasla anlamlı şekilde daha çok fayda sağladığı gösterilmiştir (36). Ancak yine de HIV/HBV koinfekte hastalarda HBV’ye karşı aktivitesi olan ART’nin karaciğer hastalığı progresyonu ve karaciğerle ilişkili mortalite üzerindeki uzun vadeli faydalarını doğrulamak için ek çalışmalara ihtiyaç vardır.
Gelecekteki Tedavi Seçenekleri
Mevcut tedaviler (ETV, TDF veya TAF); etkili, güvenli, ucuz ve yönetimi kolay olmakla beraber nadiren anti-HBs edinimi olsun veya olmasın HBsAg’nin sürekli kaybı olarak tanımlanan fonksiyonel bir iyileşme sağlar. Tek başına HBV ile infekte hastalarda ve 10 yıla kadar sürekli ETV veya TDF kullanımı olan HBeAg-pozitif hastalarda daha yüksek oranlarda olmakla birlikte, genel HBsAg seroklirens sıklığının %0-5 arasında olduğu görülmüştür (37).
Antiretroviral tedavi sırasında, HIV/HBV koinfekte hastalarda fonksiyonel iyileşme oranı iyi tanımlanmamıştır. Zambiya’da yürütülen geniş bir HIV/HBV kohort çalışmasında, 29/284 (%10.2) HIV/HBV koinfekte hastanın, tenofovir bazlı ART’nin ilk iki yılı içinde HBsAg kaybına (fonksiyonel iyileşme) ulaştığı gösterilmiş, çok değişkenli analizde, bazal CD4+ <350 hücre/mm3, kadın cinsiyet ve düşük bazal HBV DNA seviyeleri, daha yüksek fonksiyonel tedavi olasılığıyla ilişkili bulunmuştur (38). Hollanda’dan çok merkezli bir kohort çalışmasında ise ortalama 57 ay süreyle TDF bazlı ART uygulanan 104 HIV/HBV koinfekte hastada HBsAg kinetiği araştırılmış olup HBeAg-pozitif hastalarda HBsAg seviyelerinde 2.2 log IU/ml’lik bir düşüş gözlenirken, HBeAg-negatif hastalarda altı yıllık TDF tedavisi sırasında sadece 0.6 log IU/ml’lik bir düşüş elde edildiği görülmüştür. HBsAg düşüşü, artan CD4+ hücre sayısı ile korele bulunmuş ve HBV klirensinde immün restorasyonun öneminin altı çizilmiştir (39). Bu iki çalışmanın sonuçlarına dayanarak, tedavi sırasında HBsAg klirensinin, HIV/HBV koinfekte hastalarda HBV monoinfekte hastalardan daha kolay elde edildiği sonucu çıkarılabilir. HBsAg kaybı, HBV replikasyonunun ve viral protein ekspresyonunun büyük ölçüde baskılandığını gösterir ve HBV monoinfeksiyonunda antiviral tedavinin güvenli bir şekilde kesilmesine izin verir. Ayrıca, HBsAg kaybı, NA tedavisi gören hastalarda sağkalımı sağlar ve hepatoselüler karsinom insidansını düşürür (40). Bu nedenle, HBsAg ve HBV DNA’nın tedavi dışı kalıcı klirensini sağlayacak sonlu tedavi stratejilerinin geliştirilmesine büyük ilgi vardır. Bu muhtemelen virusun yanı sıra konakçı immün tepkisini de hedef alan terapötik stratejiler gerektirecektir (41). Günümüzde, immünomodülatörlü veya immünomodülatörsüz yeni antiviral kombinasyonların etkinliği ve güvenliği, HBV monoinfekte hastalarda klinik deneylerle araştırılmaktadır. Koinfekte HIV/HBV hastalarında etkililiği en üst düzeye çıkarmak için küratif HBV tedavilerinin rolünü netleştirmek için daha fazla çalışmaya ihtiyaç vardır.
Güvenli ve etkili aşıların yanı sıra HBV’ye karşı aktivitesi olan ART’nin varlığına rağmen, HIV/HBV koinfeksiyonu karaciğerle ilgili komplikasyonlarda ve AIDS ile ilişkili olmayan ölümlerde önemli bir faktör olmaya devam etmektedir. Güncel çalışmalar, hastalığın ilerlemesi açısından en büyük riske sahip hastaları belirlemeyi ve tedavi edilen hastaların çoğunda işlevsel bir iyileşme sağlayabilecek yeni hepatit B tedavi stratejilerini tanımlamayı hedeflemelidir.
HIV/HCV KOİNFEKSİYONU
Epidemiyoloji
Yaklaşık 40.1 (33.6-48.6) milyon yaşamı etkileyen HIV infeksiyonu günümüzde hala önemli bir küresel halk sağlığı sorunudur. Dünya Sağlık Örgütü (DSÖ) verilerine göre 2021 yılında yaklaşık 1.5 (1.1-2) milyon olgu yeni tanı almış ve 650 bin (510 000-860 000) kişi HIV kaynaklı nedenlerden dolayı hayatını kaybetmiştir. Günümüzde HIV ile yaşayan kişi sayısı yaklaşık 38.4 (33.9-43.8) milyon olup bunların üçte ikisi (25.6 milyon) Afrika Bölgesi’nde yaşamaktadır (42).
Öte yanda, DSÖ verilerine göre küresel olarak tahminen 58 milyon kişi kronik HCV infeksiyonuna sahiptir. Her yıl yaklaşık 1.5 milyon yeni infeksiyon gelişirken kronik HCV infeksiyonu olan bireylerin yaklaşık 3.2 milyonunun adölesan ve çocuk olduğu tahmin edilmektedir. 2019 yılında çoğunlukla siroz ve hepatoselüler karsinomdan olmak üzere yaklaşık 290 000 kişi HCV infeksiyonuna bağlı nedenlerle kaybedilmiştir (43). Avrupa Bölgesi’nde HIV ile infekte bireylerde HCV infeksiyonu prevalansı çok yüksektir. Bu oran ortalama %40 iken kentsel alanlarda %50-90’a yükselebilmektedir. Dünya genelinde bu oran %6 olup ülkemizde %0.9’dur. HCV antikor prevalansı, HIV bulaş grupları arasında da büyük farklılıklar göstermektedir; erkeklerle seks yapan erkekler (ESE)’de %7-8, hemofili hastalarında %60-70 ve damar içi ilaç kullananlarda %80-90 olarak bildirilmiştir. Genotip 3 ve 4, HIV ile koinfekte olgularda daha yaygın izlenmekte olup yakın zamanda yapılan çalışmalarda, ESE’de akut genotip 4 infeksiyonunda bir artış olduğu bildirilmiştir (44,45).
HCV ve HIV Etkileşimi
Hepatit C virusu infeksiyonunun, ART’ye yanıt ve immünolojik, virolojik veya HIV ile ilişkili klinik hastalığın ilerlemesi üzerinde etkisi çok azdır. Antiretroviral tedavi sonrasında kademeli olarak daha hızlı bir CD4+ T lenfosit hücre sayısı artışı beklenirken koinfekte olgularda bu anlamda bir yavaşlık söz konusu olabilir. Çoklu genotiplerle infeksiyonda ise HCV infeksiyonunun HIV/AIDS kliniği üzerine etkisi net olarak bilinmemekle birlikte daha belirgin bir olumsuz etki yaratabileceği düşünülmektedir (44).
İnsan immün yetmezlik virusunun HCV üzerine etkisine bakıldığında ise, koinfeksiyona sahip olan olguların daha hızlı bir fibroz progresyonuna sahip olduğu görülmektedir. Daha ciddi immün yetmezliği olan olgularda HCV viremi seviyesinin 2-8 kat arasında olması, akut hepatitten spontan iyileşmede önemli bir azalmaya neden olmaktadır (17,44). Anneden çocuğa ve cinsel yolla bulaşma risklerinde artış (sırasıyla ortalama %6’dan %20’ye ve %0’dan %3’e kadar) söz konusudur. Yine karaciğer fibrozu (2-5 kat), siroz, dekompanzasyon, hepatoselüler karsinom ve karaciğer ile ilgili ölüm oranlarında artış izlenmektedir (17,44,45).
Tanı
İnsan immün yetmezlik virusu ile infekte olgularda HCV infeksiyonu enzim immünoassay (EIA) ile taranmalıdır. Anti-HCV pozitif bulunanlarda kantitatif HCV RNA testi yapılmalıdır. EIA testlerinin duyarlılık ve özgüllüğü yüksek olmasına rağmen, CD4+ T lenfosit hücre sayısı <200 hücre/mm3 olan hastalarda antikor üretiminin yetersiz olması nedeniyle %5 civarında yalancı negatiflik olabilir. Bu nedenle, HCV infeksiyonu riski yüksek olan, aminotransferaz değerlerinde nedeni açıklanamayan yükseklik bulunan, anti-HCV negatif ve HIV ile infekte olgularda HCV RNA testi yapılmalıdır (17,45).
Akut HCV infeksiyonundan şüphelenilen olgularda ise anti-HCV serokonversiyonu daha geç olabileceği için, anti-HCV ve HCV RNA testleri birlikte yapılmalıdır. Cinsel aktivite gösteren HIV ile infekte bireylerde yıllık anti-HCV taraması önerilmektedir (17,45).
Hastaların Yönetimi
HIV/HCV koinfekte hastaların değerlendirilmesi kapsamında, HCV tedavisinden önce hastalıkla ilgili iyi bir öykü alınmalı, ayrıntılı fizik muayene yapılmalı ve “spider angioma”, palmar eritem, splenomegali, sarılık veya “caput medusae” gibi ileri evre karaciğer hastalığı bulgularının varlığı araştırılmalıdır. Damar içi madde ve alkol kullanımı gibi hepatit C infeksiyonuna neden olabilecek durumlar sorgulanmalıdır. Altta yatan hastalıklar, kullanılan ilaçlar, mevcut ART rejimi, gebelik olup olmadığı, aile öyküsü değerlendirilmeli ve cinsel aktivite gösterenler korunmasız cinsel temas ile HCV infeksiyonu konusunda uyarılmalıdır (45).
Tüm hastalarda karaciğer hasarının evresi değerlendirilmelidir. Bu amaçla, son yıllarda giderek daha az başvurulan karaciğer biyopsisinin yerine karaciğer fibrozisini gösteren noninvazif yöntemler kullanılabilir. HIV/HCV koinfekte ve siroz gelişmiş olgulara, HCV ile infekte hastalara önerildiği gibi, altı ayda bir ultrasonografi yapılmalıdır. Ayrıca hastalarda hepatit B ve A serolojileri değerlendirilmeli ve bağışık olmayan hastalar aşılanmalıdır (45).
Hepatit C infeksiyonunun tedavisinde hedef; kalıcı viral yanıt (KVY) olarak tanımlanan ve tedavi tamamlandıktan sonra 12-24. haftada HCV RNA’nın tespit edilemez düzeyde olmasının sağlanmasıdır. Koinfekte hastalarda, KVY’nin karaciğer ile ilişkili mortalite ve morbiditeyi belirgin olarak azalttığı gösterilmiştir (17).
İnsan immün yetmezlik virusu/hepatit C virusu koinfekte olgularda doğrudan etkili antiviraller (DEA) kullanılmaktadır. Bu ilaçların tolere edilebilirliği HCV ile infekte hastalarda ve koinfekte hastalarda benzerdir. Fibroz düzeyine bakılmaksızın koinfekte tüm olgular DEA’lar ile tedavi edilmelidir (17).
Hastalara ART’nin ve HCV tedavisinin, CD4+ T-hücresi sayısından bağımsız olarak birlikte başlanması önerilmektedir. İnsan immün yetmezlik virusu/hepatit C virusu koinfeksiyonunda, HCV tedavisine karar verilen olgularda, ART’ye başlanırken veya tedavi değiştirilirken, ilaçlar arasındaki sonuçları ciddi olabilecek etkileşimler dikkate alınmalıdır. Hepatit C virusu infeksiyonu tedavisi için ART’ye ara verilmesi önerilmemektedir. Antiretroviral tedaviye önce başlanmış olup HIV RNA negatif ise DEA’lara başlanmadan önce tedavi uygun şekilde değiştirilebilir. Antiretroviral tedavi değiştirildikten sonra 4-8. haftada HIV RNA kontrol edilmelidir. Olası ilaç etkileşimlerinden kaçınmak için HCV infeksiyonu tedavisi tamamlandıktan sonra değiştirilmiş ART’ye en az 2 hafta süreyle daha devam edilmesi önemlidir (45).
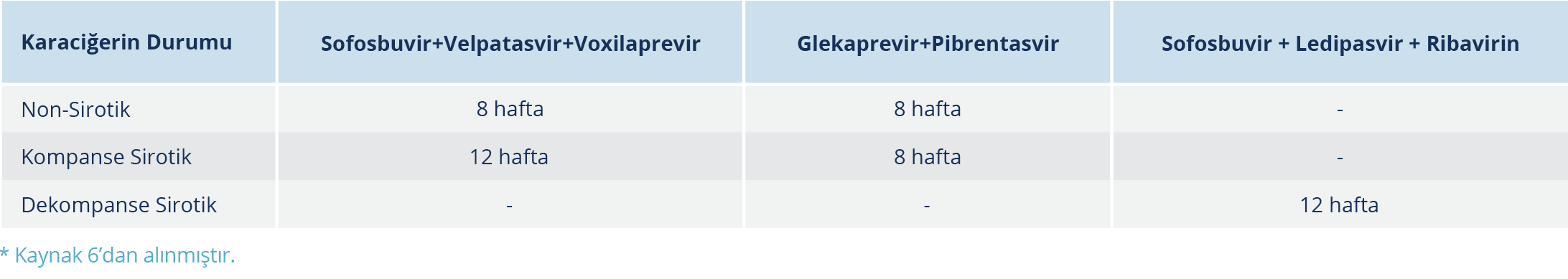
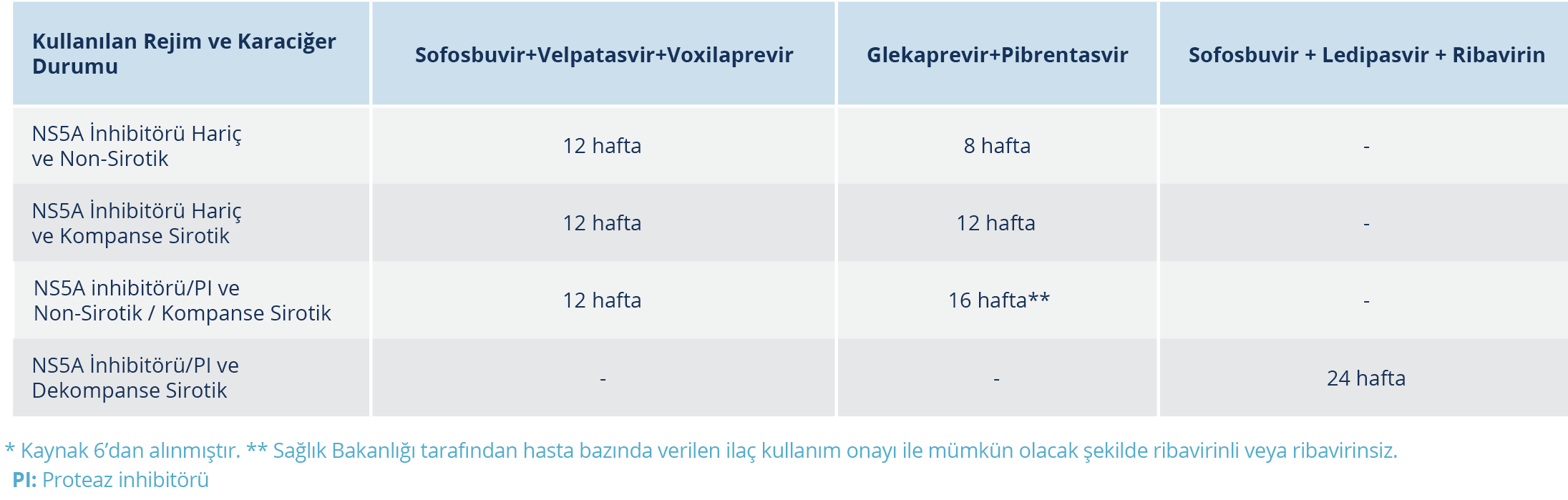
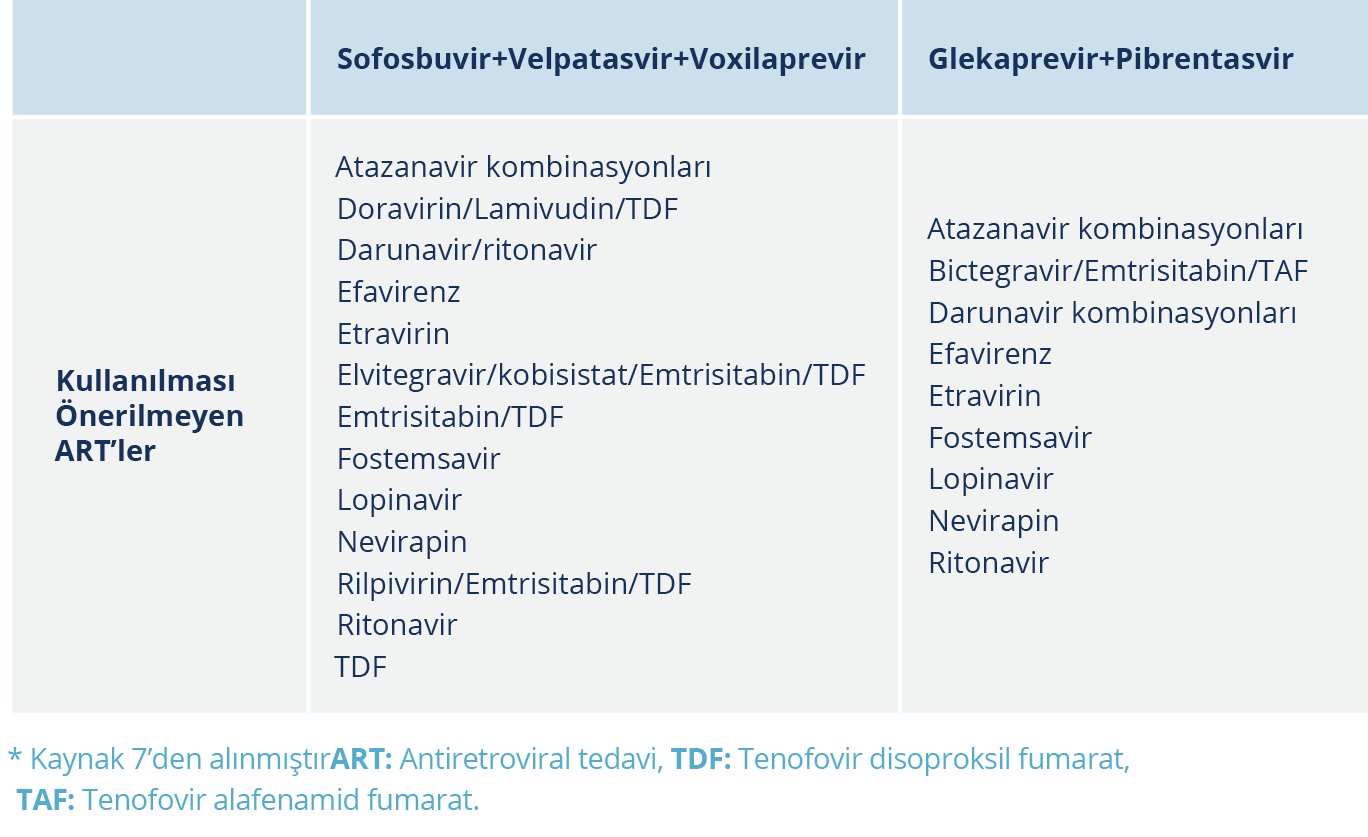
Ülkemizde, HIV/HCV koinfeksiyonu tedavisinde Sağlık Uygulama Tebliği’ne göre seçilebilecek güncel ajanlar Tablo 1 ve 2’de verilmiştir (47). Bu ajanlarla uygulanan HCV infeksiyonu tedavisi sırasında önerilmeyen ART’ler ise Tablo 3’tedir (48).
Sonuç olarak; HIV ile yaşayan bireyler HCV infeksiyonu açısından taranmalıdır (AIII). HCV infeksiyonu riski yüksek olan olgular, yıllık olarak ve HCV infeksiyonundan şüphelenildiğinde taranmalıdır (AIII). HCV/HIV koinfeksiyonu olan tüm olgulara, CD4+ T lenfosit hücre sayısından bağımsız olarak ART başlanmalıdır (AI). Koinfeksiyonu olan çoğu olgu için önerilen başlangıç ART rejimleri, olmayan olgular için önerilenlerle aynıdır. Ancak hem HIV hem de HCV infeksiyonu tedavisi endike olduğunda, ilaç-ilaç etkileşimleri ve toksisiteler açısından dikkatli olunmalıdır (AIII). Olgular aynı zamanda HBV için taranmalı ve gerekirse aşılanmalıdır (AIII). HIV ile infekte bireylerde, HBV ve HCV ile koinfeksiyon karaciğer komplikasyonlarının artmasına neden olmaktadır. Dolayısıyla koinfekte hastaların tedavi yönetiminde daha dikkatli olunmalıdır (46).
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – S.T.; Tasarım – S.T., G.Ç.; Denetleme – S.T.; G.Ç., O.B., İ.Ç.; Veri Toplama ve/veya İşleme – S.T., G.Ç., O.B., İ.Ç.; Analiz ve/veya Yorum – S.T., G.Ç.; Literatür; Taraması – S.T., G.Ç., O.B., İ.Ç.; Makale Yazımı – S.T., G.Ç.; Eleştirel İnceleme – S.T., G.Ç., İ.Ç.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Global progress report on HIV, viral hepatitis and sexually transmitted infections, 2021. Accountability for the global health sector strategies 2016-2021: actions for impact [Internet]. Geneva: World Health organization (WHO). [erişim 22 Ekim 2022]. https://www.who.int/publications/i/item/9789240027077
- Platt L, French CE, McGowan CR, et al. Prevalence and burden of HBV co-infection among people living with HIV: A global systematic review and meta-analysis. J Viral Hepat. 2020;27(3):294-315. [CrossRef]
- Report Icona Foundation Cohort–Update December 2021 [Internet]. Milano: Fondazione ICONA. [erişim 31 Ekim 2021]. https://www.fondazioneicona.org/_new2/pages/publicArea/ICONAcohort/
- Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol. 2005;5:215. [CrossRef]
- Thimme R, Wieland S, Steiger C, et al. CD8+ T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection. J Virol. 2003;77:68. [CrossRef]
- Kawatani T, Suou T, Tajima F, et al. Incidence of hepatitis virus infection and severe liver dysfunction in patients receiving chemotherapy for hematologic malignancies. Eur J Haematol. 2001;67:45. [CrossRef]
- Martel N, Cotte L, Trabaud MA, et al. Probable corticosteroid-induced reactivation of latent hepatitis B virus infection in an HIV-positive patient involving immune escape. J Infect Dis. 2012;205:1757. [CrossRef]
- Tsai SL, Chen PJ, Lai MY, et al. Acute exacerbations of chronic type B hepatitis are accompanied by increased T cell responses to hepatitis B core and e antigens. Implications for hepatitis B e antigen seroconversion. J Clin Invest. 1992;89:87. [CrossRef]
- McGovern BH. The epidemiology, natural history and prevention of hepatitis B: implications of HIV coinfection. Antivir Ther. 2007;12 Suppl 3:H3-13.
- Piroth L, Sène D, Pol S, et al. Epidemiology, diagnosis and treatment of chronic hepatitis B in HIV-infected patients (EPIB 2005 STUDY). AIDS. 2007;21:1323. [CrossRef]
- Konopnicki D, Mocroft A, de Wit S, et al. Hepatitis B and HIV: prevalence, AIDS progression, response to highly active antiretroviral therapy and increased mortality in the EuroSIDA cohort. AIDS. 2005;19:593. [CrossRef]
- Di Martino V, Thevenot T, Colin JF, et al. Influence of HIV infection on the response to interferon therapy and the long-term outcome of chronic hepatitis B. Gastroenterology. 2002;123:1812. [CrossRef]
- Thio CL, Smeaton L, Saulynas M, et al. Characterization of HIV-HBV coinfection in a multinational HIV-infected cohort. AIDS. 2013;27(2):191-201. [CrossRef]
- Chun HM, Roediger MP, Hullsiek KH, et al; Infectious Disease Clinical Research Program HIV Working Group. Hepatitis B virus coinfection negatively impacts HIV outcomes in HIV seroconverters. J Infect Dis. 2012;205(2):185-93. [CrossRef]
- Idoko J, Meloni S, Muazu M, et al. Impact of hepatitis B virus infection on human immunodeficiency virus response to antiretroviral therapy in Nigeria. Clin Infect Dis. 2009;49:1268. [CrossRef]
- Nikolopoulos GK, Paraskevis D, Hatzitheodorou E, et al. Impact of hepatitis B virus infection on the progression of AIDS and mortality in HIV-infected individuals: a cohort study and meta-analysis. Clin Infect Dis. 2009;48:1763-71. [CrossRef]
- Guidelines version 11 October 2021 [Internet]. Brussels: European AIDS Clinical Society (EACS). [erişim 22 Ekim 2022]. https://www.eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-98. [CrossRef]
- Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67(4):1560-99. [CrossRef]
- Tayal SC, Sankar KN. Impaired response to recombinant hepatitis B vaccine in asymptomatic HIV-infected individuals. AIDS. 1994;8:558-9. [CrossRef]
- Kim MJ, Nafziger AN, Harro CD, et al. Revaccination of healthy nonresponders with hepatitis B vaccine and prediction of seroprotection response. Vaccine. 2003;21(11-12):1174-9. [CrossRef]
- Launay O, van der Vliet D, Rosenberg AR, et al; ANRS HB03 VIHVAC-B Trial. Safety and immunogenicity of 4 intramuscular double doses and 4 intradermal low doses vs standard hepatitis B vaccine regimen in adults with HIV-1: a randomised controlled trial. JAMA. 2011;305:1432-40. [CrossRef]
- Mena G, García-Basteiro A, Bayas J. Hepatitis B and A vaccination in HIV-infected adults: A review. Hum. Vaccines Immunother. 2015;11:2582-98. [CrossRef]
- Raimondo G, Locarnini S, Pollicino T, Levrero M, Zoulim F, Lok AS; The Taormina Workshop on Occult HBV Infection Faculty Members. Update of the statements on biology and clinical impact of occult hepatitis B virus infection. J Hepatol. 2019;71:397-408. [CrossRef]
- Rouphaela NG, Talatia NJ, Rimland D. Hepatitis B reverse seroconversion in HIV-positive patients: Case series and review of the literature. AIDS. 2007;21:771-4. [CrossRef]
- Salpini R, D’Anna S, Alkhatib M, et al. Reactivation of hepatitis B virus is a frequent event in anti-HBc positive/HBsAg-negative HIV-infected patients switching to Tenofovir sparing therapy as revealed by highly sensitive HBV assays. In: Proceedings of the 14th Congress National-ICAR, Montreal, QC, Canada, 30 May–3 June 2022.
- Perrillo RP, Gish, R, Falck-Ytter YT. American Gastroenterological Association Institute Technical Review on prevention and treatment of hepatitis B reactivation during immunosuppressive drug therapy. Gastroenterology. 2015;148-221. [CrossRef]
- Thio CL, Seaberg EC, Skolasky R, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet. 2002; 360:1921-6. [CrossRef]
- Puoti M, Torti C, Bruno R, Filice G, Carosi G. Natural history of chronic hepatitis B in co-infected patients. J Hepatol. 2006;44(1 Suppl):S65-70. [CrossRef]
- Hoffmann CJ, Seaberg EC, Young S, et al. Hepatitis B and long-term HIV outcomes in coinfected HAART recipients. AIDS. 2009; 23:1881-9. [CrossRef]
- Robinson WS, Miller RH, Marion PL. Hepadnaviruses and retroviruses share genome homology and features of replication. Hepatology. 1987;7(1 Suppl):64S-73S. [CrossRef]
- Papatheodoridis GV, Sypsa V, Dalekos G, et al. Eight-year survival in chronic hepatitis B patients under long-term entecavir or tenofovir therapy is similar to the general population. J Hepatol. 2018;68:1129-36. [CrossRef]
- Lampertico P, Invernizzi F, Viganò M, et al. The long-term benefits of nucleos(t)ide analogs on esophageal varices in compensated HBV cirrhotics with no or small esophageal varices: A 12-year prospective cohort study. J Hepatol. 2015;63:1118-25. [CrossRef]
- Papatheodoridis GV, Idilman R, Dalekos GN, et al. The risk of hepatocellular carcinoma decreases after the first 5 years of entecavir or tenofovir in Caucasians with chronic hepatitis B. Hepatology. 2017;66:1444-53. [CrossRef]
- Boyd A, Bottero J, Miailhes P, et al. Liver fibrosis regression and progression during controlled hepatitis B virus infection among HIV-HBV patients treated with tenofovir disoproxil fumarate in France: A prospective cohort study. J Int AIDS Soc. 2017;20(1):21426. [CrossRef]
- Calcagno A, Alessandro C, Saracino A, et al. Long-term follow-up of HIV-HBV coinfected patients according to the use of anti-HBV active drugs. In: Proceedings of the HIV/Drug Therapy, Glasgow, UK, 28–31 October 2018.
- Yip TCF, Wong GLH, Wong VWS, et al. Durability of hepatitis B surface antigen seroclearance in untreated and nucleos(t)ide analogue-treated patients. J Hepatol. 2018;6:S0168-8278(17)32332-2. [CrossRef]
- Chihota BV, Wandeler G, Chilengi R, et al. High rates of hepatitis B virus (HBV) functional cure among human immunodeficiency Virus-HBV coinfected patients on antiretroviral therapy in Zambia. J Infect Dis. 2020;221(2):218-22. [CrossRef]
- Zoutendijk R, Zaaijer HL, De Vries-Sluijs T, et al. Hepatitis B surface antigen declines and clearance during long-term tenofovir therapy in patients coinfected with HBV and HIV. J Infect Dis. 2012;206:974-80. [CrossRef]
- Kim GA, Lim YS, An J, et al. HBsAg seroclearance after nucleoside analogue therapy in patients with chronic hepa-titis B: Clinical outcomes and durability. Gut. 2014;63:1325-32. [CrossRef]
- Fanning GC, Zoulim F, Hou J, Bertoletti A. Therapeutic strategies for hepatitis B virus infection: towards a cure. Nat Rev Drug Discov. 2019;18:827-44. [CrossRef]
- HIV: Key facts [Internet]. Geneva: World Health Organization. [erişim 22 Ekim 2022; güncelleme 09 Kasım 2022]. https://www.who.int/news-room/fact-sheets/detail/hiv-aids
- Hepatitis C: Key facts [Internet]. Geneva: World Health Organization. [erişim 22 Ekim 2022]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
- Management of hepatitis C and HIV coinfection. Clinical protocol for the WHO European region chapter 6 [Internet]. Geneva: World Health Organization. [erişim 22 Ekim 2022]. https://www.euro.who.int/__data/assets/pdf_file/0007/91924/E90840_Chapter_6.pdf
- Akalın H, Aksoy F, Atalay S, et al. HIV/AIDS Tanı İzlem ve Tedavi El Kitabı, Aralık 2021 Sürüm 2.0. Gökengin D, Korten V, Kurtaran B, Tabak F, Ünal S, eds. Türk HIV/AIDS Platformu.
- Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV [Internet]. Department of Health and Human Services. [erişim 14 Ekim 2022]. https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/adult-adolescent-arv/guidelines-adult-adolescent-arv.pdf
- Sağlık Uygulama Tebliği [Internet]. Ankara: Sosyal Güvenlik Kurumu. [güncelleme 27 Temmuz 2022; erişim 14 Ekim 2022]. https://www.sgk.gov.tr/Duyuru/Detay/27072022-SUT-Degisiklik-Tebligi-Islenmis-Guncel-2013-SUT-2022-07-27-05-04-57
- HIV drug interactions [Internet]. University of Liverpool. [erişim 14 Ekim 2022]. https://www.hiv-druginteractions.org/checker#