En Çok Okunanlar
Özet
Amaç: Kolistin direncinin belirlenmesinde sıvı mikrodilüsyon (SMD) referans yönteminin kullanılması önerilmekle birlikte alternatif yöntemlerin arayışı da devam etmektedir. Çalışmamızda; kolistin için altın standart yöntem olan sıvı mikrodilüsyon yöntemini; ticari SMD yöntemi olan Sensititre™ (Thermo Fisher Scientific, ABD)’nin yanı sıra BD Phoenix™ 100 (Becton Dickinson, ABD) ve MicroScan WalkAway™ (Beckman Coulter, ABD) otomatize sistemleriyle karşılaştırarak kolistin duyarlılığını saptamadaki etkinliğini belirlemek amaçlandı.
Yöntemler: Çoklu antibiyotik dirençli, 100 adet Acinetobacter baumannii suşu kolistin duyarlılığı yönünden incelemeye alındı. SMD, Sensititre™ mikrodilüsyon yöntemi (Thermo Fisher Scientific, ABD), BD Phoenix™ 100 sistemi (Becton Dickinson, ABD) ve MicroScan WalkAway™ sistemi (Beckman Coulter, ABD) ile antibiyotik duyarlılıkları karşılaştırmalı olarak çalışıldı.
Bulgular: Sensititre™ (Thermo Fisher Scientific, ABD) ve BD Phoenix™ 100 (Becton Dickinson, ABD) mikrodilüsyon yöntemleri altın standart yöntem SMD ile karşılaştırıldığında “kategorik uyum” (KU), “büyük hata” (BH) ve “çok büyük hata” (ÇBH) oranları Uluslararası Standartlar Teşkilatı (“International Organization of Standardization – ISO”) tarafından belirlenen kriterlere göre kabul edilebilir performansta değilken, MicroScan WalkAway™ sistemi (Beckman Coulter, ABD) yönteminin KU (%97), BH (%1) ve ÇBH (%2) oranlarının kabul edilebilir değerlerde olduğu tespit edildi.
Sonuç: SMD pratik bir yöntem olmadığı için kullanımı tercih edilmemektedir. Rutin mikrobiyoloji laboratuvarlarında kolistin direncinin belirlenmesi için henüz basit ve doğru fenotipik saptama yöntemleri tanımlanmamıştır. Çalışmalarda farklı sonuçlar elde edilmekle birlikte çalışmamızda, MicroScan WalkAway yöntemi kabul için gerekli kriterleri sağladı.
GİRİŞ
Acinetobacter baumannii, özellikle yoğun bakım ünitelerinde artan morbidite ve mortalite ile ilişkili ciddi hastane infeksiyonlarından giderek daha fazla sorumlu tutulmaktadır. Kolistin, ilk olarak 1949’da Paenibacillus polymyxa’dan izole edilmiş olup A’dan E’ye kadar beş farklı yapısal analoğa sahiptir; polimiksin B ve E (kolistin) klinik kullanımda olanlardır. Bir ekzosiklik zincir, bir heptapeptit halkası ve pozitif yüklü bir yağ asidi kuyruğu ile Gram-negatif lipopolisakkarit membranı ile etkileşime giren katyonik bir polipeptittir. Nefrotoksik, nörotoksik etkileri ve doz optimizasyonundaki sıkıntılar nedeniyle 1959’da klinik kullanıma girmiş olsa da 1980’lerde kullanımı sınırlandırılmıştır. Kolistin sülfatın intravenöz formunun bazı çalışmalarda daha güvenilir olduğunun gösterilmesinin ardından Gram-negatif bakterilerin neden olduğu çoklu ilaca dirençli infeksiyonlarda kullanılması tekrar gündeme gelmiştir. Kolistinin geniş spektrumlu olması, bakterisidal etkisinin hızlı olması ve yeni geliştirilen antibiyotiklerin sayısının yetersiz olması gibi nedenlerden dolayı klinisyenler tarafından 1990’lardan itibaren yeniden kullanılmaya başlanmıştır (1, 2).
Enterobacteriaceae, Pseudomonas aeruginosa ve Acinetobacter spp.’de kolistin duyarlılığının tespiti için Klinik ve Laboratuvar Standartları Enstitüsü (“Clinical and Laboratory Standards Institute – CLSI”) ve Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (“European Committee on Antimicrobial Susceptibility Testing – EUCAST”) ortak çalışma grubu ISO standardı 20776-1’e göre polisorbat-80 gibi yüzey aktif maddeler eklenmeden kolistinin sülfat tuzunu kullanarak polistiren mikrotitre plakları ile sıvı mikrodilüsyon (SMD) çalışılmasını referans yöntem olarak belirlemiştir (3). Ancak SMD plaklarının hazırlanması son derecede yoğun emek ve zaman gerektirdiğinden, çoğu rutin laboratuvar referans metodu uygulayamamaktadır. Bu nedenle son yıllarda ticari birkaç sıvı mikrodilüsyon yöntemi kullanıma sunulmuştur. EUCAST, kolistin direncinin tespitinde gradyan testleri ve yarı otomatize sistemlerin kullanılmamasını önermekte ve konu ile ilgili uyarılarını sürekli güncellemektedir (4).
Kullanılan otomatize sistemlerden BD Phoenix™ 100 sisteminde (Becton Dickinson, ABD), 85 adet kuyucuk ve bu kuyucuklarda kuru toz halinde antibiyotikler bulunmaktadır. Test, sıvı bazlı mikrodilüsyon prensibiyle çalışmaktadır. MicroScan WalkAway™ sistemi (Beckman Coulter, ABD) mikrodilüsyonun yarı otomatize edilmiş halidir. Sıvı mikrodilüsyon yöntemlerinden biri olan Sensititre™ mikrodilüsyon yönteminde (Thermo Fisher Scientific, ABD) ise mikroplakların kuyucuklarında liyofilize halde kolistinin daha önce seyreltilmiş konsantrasyonları (0.125-128 μg/ml) bulunmaktadır (5).
Çalışmamızda, A. baumannii izolatlarında saptanan kolistin duyarlılıklarının karşılaştırılması amaçlandı ve kolistin direncinin belirlenmesinde altın standart yöntem olan SMD yönteminin yanı sıra, ticari bir sıvı mikrodilüsyon yöntemi olan Sensititre™ mikrodilüsyon yöntemi, BD Phoenix™ 100 ve MicroScan WalkAway™ otomatize sistemleri kullanıldı.
YÖNTEMLER
Çalışmamızda, çoklu antibiyotik dirençli 100 adet A. baumannii suşu kolistin duyarlılığı yönünden incelemeye alındı. Laboratuvarımıza gelen çeşitli klinik örnekler %5 kanlı agar ve “Eosin methylene blue” (EMB) agara ekilerek 37°C’de 18-24 saat inkübe edildi. Kültürde üreyen bakterilerin tür düzeyinde tanımlanması, BD Phoenix™ 100 ve MicroScan WalkAway™ otomatize sistemleri kullanılarak yapıldı. İzolatlar, çalışmaya alınıncaya kadar %15 gliserol içeren Mueller-Hinton buyyon saklama besiyerlerinde -80°C’de saklandı. Çalışma öncesinde derin dondurucudan çıkarılan izolatları canlandırmak için %5 koyun kanlı agara ekim yapıldı ve besiyerleri 35°C’de 18-24 saat inkübe edildi. Üreyen izolatlardan tekrar pasajlar alınarak saf kültür halinde elde edilmeleri sağlandı. Olası salgın suşlarının dışlanması amacıyla moleküler yöntemlerle bir çalışma yapılmadı. Her hastadan sadece bir izolat çalışmaya dahil edildi. Toplam 100 adet A. baumannii izolatının kolistin duyarlılıkları; sıvı mikrodilüsyon ve Sensititre™ mikrodilüsyon yöntemleri, BD Phoenix™ 100 ve MicroScan WalkAway™ otomatize sistemleri kullanılarak karşılaştırıldı.
BD Phoenix™ 100 ve MicroScan WalkAway™ Otomotize Sistemleri
Bakteri süspansiyonunun bulanıklığı 0.5-0.6 McFarland olacak şekilde hazırlandı. BD Phoenix™ 100 analizleri için 1-4 mg/lt kolistin konsantrasyonlarını test eden ADT paneli ve ID kartları kullanıldı. MicroScan WalkAway™ analizleri için ise 2-4 mg/lt kolistin konsantrasyonlarını test eden ADT paneli ve ID kartları kullanıldı. Sonuçlar, 18-24 saatlik inkübasyondan sonra cihazın çalışma menüsünden değerlendirildi. İki sistemde de EUCAST versiyon 11.0 önerileri doğrultusunda; minimum inhibitör konsantrasyonu (MİK) değeri ≤ 2 mg/lt olan izolatlar duyarlı, >2 mg/lt olan izolatlar dirençli olarak değerlendirildi (3).
Sensititre™ Mikrodilüsyon Yöntemi
Mikrodilüsyon temeline dayanan, 0.125-128 mg/lt konsantrasyon aralığında dehidrate kolistin ve üreme kontrol kuyucuğu içeren mikroplaklar halinde kullanıma hazır bir yöntemdir. Bakteri süspansiyonu, taze kültürden steril distile su içerisinde 0.5 McFarland bulanıklığında olacak şekilde hazırlandıktan sonra, bu çözeltiden 10 µl alınarak 11 ml Mueller-Hinton buyyon içeren tüpe eklendi; buradan 50 µl alınarak, 0.125-128 mg/lt kolistin içeren hazır mikroplaklara inoküle edildi.
Sıvı Mikrodilüsyon Yöntemi
Üreticinin önerileri doğrultusunda; aktif madde olarak kolistin sülfat (Sigma Aldrich, ABD) süspansiyon haline getirilerek 256 μg/ml’lik stok solüsyon hazırlandı. Stok solüsyon kullanılarak, mikrodilüsyon plaklarındaki Mueller-Hinton buyyonunda seri dilüsyonlar (0.125-128μg/ml) yapıldı. Tüm izolatlardan 0.5 McFarland standardı bulanıklığında süspansiyon hazırlandıktan sonra son bakteri konsantrasyonu 5×105 cfu/ml olacak şekilde mikrodilüsyon plaklarına eklendi.
Sensititre™ sisteminde ve sıvı mikrodilüsyon yönteminde, mikroplaklar 18-20 saat boyunca 35°C’de inkübe edildi. Çalışmamız, aynı gün içinde aynı ekip tarafından gerçekleştirildi. İnkübasyon sonrasında sonuçlar, birbirinden bağımsız çift göz kontrollü olarak değerlendirildi. Üremenin olmadığı en düşük kolistin konsantrasyonu, MİK değeri olarak tespit edildi. Kalite kontrolü, kolistin duyarlı ATCC 25922 Escherichia coli ve kolistin dirençli NCTC 13846 (mcr-1 pozitif) E. coli suşları ile gerçekleştirildi. EUCAST versiyon 11.0 önerileri doğrultusunda MİK değeri ≤ 2 mg/lt olan izolatlar duyarlı, >2 mg/lt olan izolatlar dirençli olarak değerlendirildi (3).
İstatistiksel Analiz
Veriler, SPSS (“Statistical Package for Social Sciences”) versiyon 22.0 programı (IBM Corp., ABD) ile değerlendirildi. Çalışmada tanımlayıcı veriler kategorik verilerde n ve % değerleri; sürekli verilerde ise ortalama±standart sapma değerleri ile gösterildi. Gruplar arası kategorik değişkenlerin karşılaştırılmasında χ² analizi uygulandı. Sürekli değişkenlerin normal dağılıma uygunluğu Kolmogorov-Smirnov testi ile değerlendirildi. Normal dağılıma uyan değişkenlerin iki grup arasındaki karşılaştırmasında Student t testi uygulandı. Analizlerde istatistiksel anlamlılık düzeyi p<0.05 olarak kabul edildi.
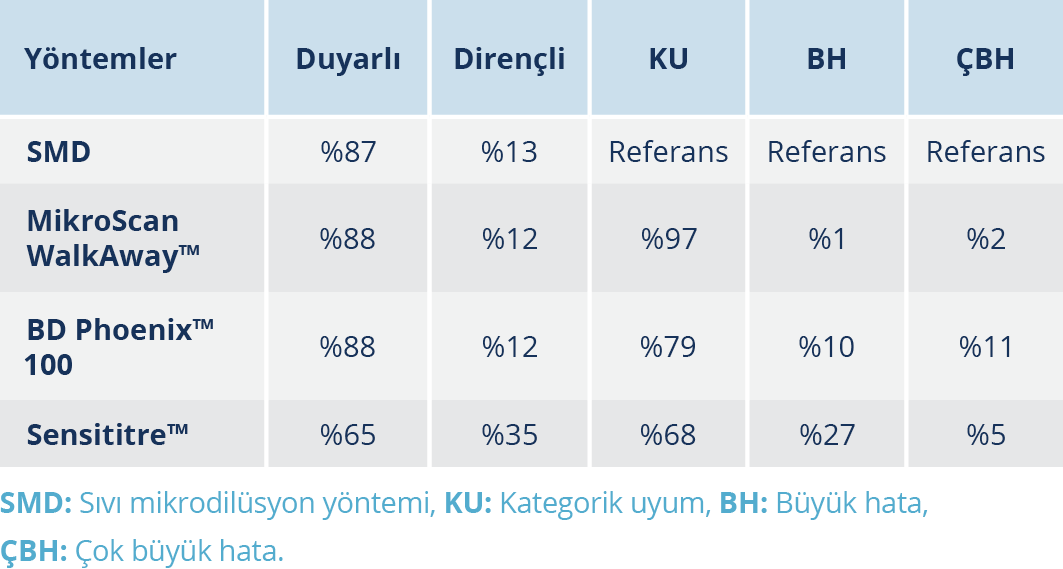
Duyarlılık testlerinin karşılaştırılmasında “kategorik uyum” (KU) oranı dikkate alındı. Kategorik uyum; test suşunun CLSI vb. kriterlere göre yorumlanan duyarlılık sonuçlarının (duyarlı ve dirençli) uyumu olarak tanımlandı. “Büyük hata” (BH), bir antibiyotik duyarlılık testinin dirençli, referans testin duyarlı sonuç vermesi; “çok büyük hata” (ÇBH) ise bir antibiyotik duyarlılık testinin duyarlı sonuç verirken referans testin dirençli sonuç vermesi olarak tanımlandı (6). Referans testi olan MİK sonuçları ile MikroScan™, BD Phoenix™ 100, Sensititre™ sonuçları karşılaştırıldı ve KU, ÇBH ve BH oranları hesaplandı. Uluslararası Standartlar Teşkilatı (“International Organization of Standardization – ISO”) tarafından belirlenen kriterlere göre kabul edilebilir performans; KU için ≥%90; ÇBH ve BH için ≤%3 olarak belirlendi (7).
Çalışma için Fırat Üniversitesi Klinik Araştırmalar Etik Kurulu’ndan 28 Kasım 2019 tarih ve 13281952-514.10-E.1983 karar numarasıyla onay alındı. Çalışma sürecinde araştırma ve yayın etiği ilkelerine uyuldu.
BULGULAR
Tablo 1. Acinetobacter baumannii İzolatlarında Kolistin Duyarlılık Oranlarının Testlere Göre Karşılaştırılması
Tablo 2.İzolatların SMD, BD Phoenix™ 100, MicroScan WalkAway™ ve Sensititre™ Yöntemleri ile Kolistin MİK Sonuçları
Çalışmaya çoklu ilaca dirençli 36’sı trakeal aspirat, 34’ü balgam, 13’ü idrar, 10’u kan ve 7’si yara örneğinden izole edilmiş toplam 100 adet A. baumannii suşu dahil edildi. Suşların 70’i kadın hastalardan, 30’u ise erkek hastalardan alınan örneklerden izole edildi. Hastaların yaş ortalaması 67.1±17.4 (minimum=18-maksimum=93) idi.
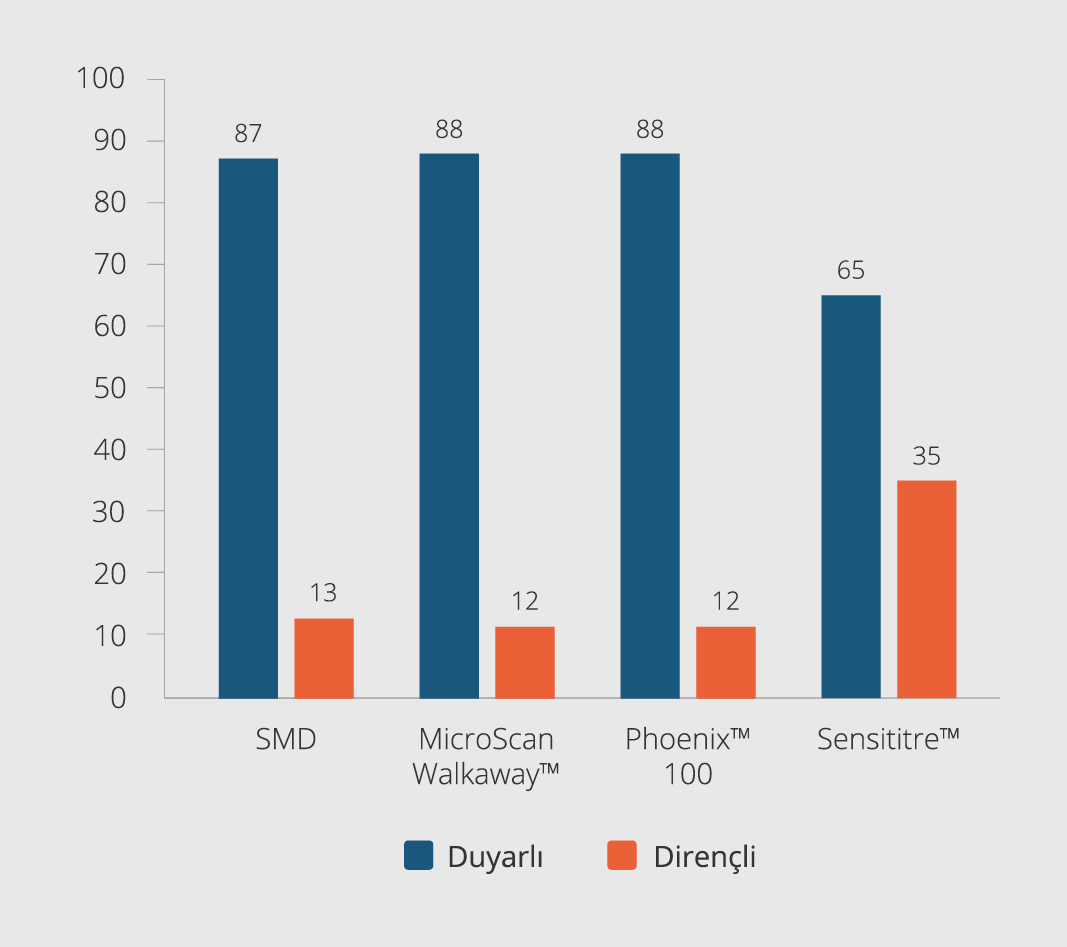
Kolistin için; SMD, MikroScan WalkAway™, BD Phoenix™ 100 ve Sensititre™ mikrodilüsyon yöntemleri kullanılarak 100 suş için tespit edilen duyarlılık ve dirençlilik oranları Şekil 1’de verilmiştir.
Çalışmaya dahil edilen Acinetobacter spp. suşlarının; SMD, MikroScan WalkAway™, BD Phoenix™ 100 ve Sensititre™ ile saptanan kolistin duyarlılıkları, suşların izole edildiği hastaların cinsiyetleri ve yaşları açısından değerlendirildiğinde anlamlı düzeyde bir farklılık görülmedi (p>0.05).
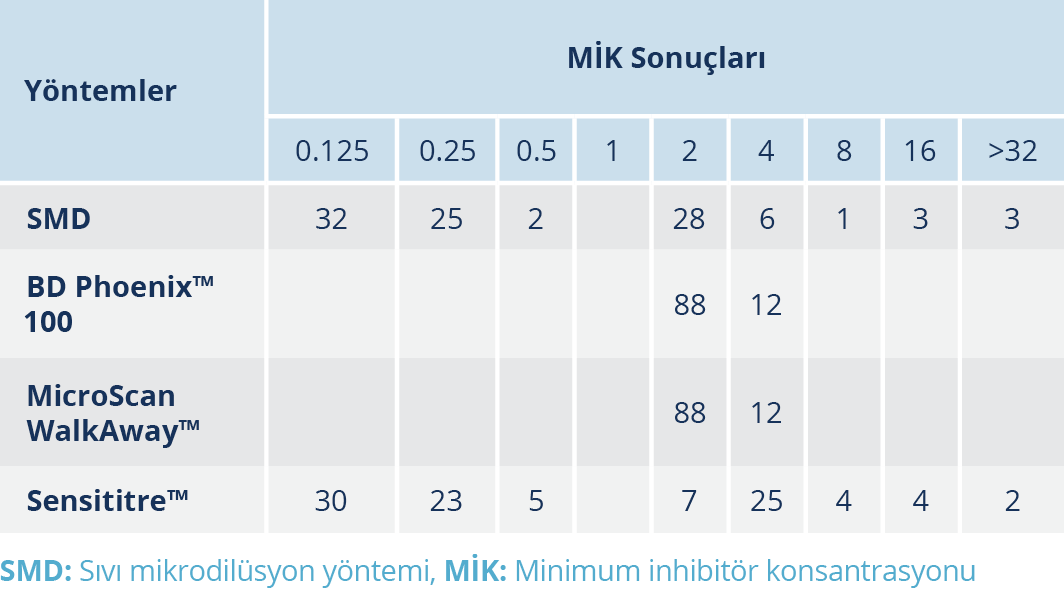
MikroScan WalkAway™, BD Phoenix™ 100, Sensititre™ yöntemleri ile elde edilen kolistin direnç oranları altın standart yöntem olan SMD yöntemi ile karşılaştırıldı. Sıvı mikrodilüsyon yöntemi altın standart kabul edildiğinde; MicroScan WalkAway™ sisteminin KU oranı %97, ÇBH oranı %2 ve BH oranı %1 olarak tespit edildi. Sensititre™ yönteminin ise KU oranı %68, ÇBH oranı %5 ve BH oranı %27 olarak tespit edildi. Sensititre™ yöntemine göre yanlış duyarlı sonuç elde ettiğimiz beş örneğin MİK değeri 2 µg/ml olup SMD testinde bu örneklerin MİK değeri 4 µg/ml olarak tespit edildi. Elde edilen verilere göre MikroScan WalkAway™, BD Phoenix™ 100 ve Sensititre™ yöntemlerinin KU, BH ve ÇBH oranları Tablo 1’de; izolatların SMD, BD Phoenix™ 100, MicroScan WalkAway™ ve Sensititre™ yöntemleri ile elde edilen kolistin MİK sonuçları Tablo 2’de verilmiştir.
İRDELEME
Kolistin, karbapenemlere dirençli Gram-negatif bakteri infeksiyonlarının tedavisinde yan etkilerine rağmen kullanılma sıklığı artan antibiyotiklerden biridir (8). Polimiksinlerin büyük moleküler boyutlarından dolayı agarda difüzyonlarının zayıf olması, katyonik yapıları, ilaç tozu bileşimine ilişkin endişeler ve hetero dirençlerinin bulunması nedeniyle duyarlılık testlerine ilişkin zorluklarla karşılaşılmaktadır (9). Bununla birlikte kolistin duyarlılığının tespitinde önerilen test yöntemi olan SMD’nin yoğun emek, zaman ve tecrübe gerektirmesinden dolayı rutin mikrobiyoloji laboratuvarlarının iş akışına kolayca uyarlanabilecek yeni bir tanı aracı bulma çabası devam etmektedir (10).
Otomatize sistemler, klinik örneklerden izole edilen mikroorganizmaların tanımlanmasında ve antibiyotik duyarlılığının saptamasında önemli bir role sahiptir. Kolistin duyarlılılığını test etmek için yapılan çalışmalar genellikle VITEK® 2 (bioMérieux, ABD) ile yapılmış olup çalışmamızda kullandığımız Phoenix™ 100 ve MicroScan WalkAway™ otomatize sistemiyle karşılaştırma çalışmaları daha azdır (11-15) .
Vasoo (9) yapmış olduğu çalışmada, Sensititre™ mikrodilüsyon yöntemi ile kolistin ve polimiksin B için %90 “kategorik uyum” saptamıştır. Yirmi iki adet Acinetobacter spp. izolatının kolistin duyarlılığını beş farklı ticari SMD test kiti (Sensititre™, MICRONAUT-S, MICRONAUT MIC-Strip, SensiTest ve UMIC) ve iki gradyan test (Etest and MIC Test Strip) ile saptayarak, sonuçları bu izolatların referans agar dilüsyon yöntemi ile elde edilen kolistin duyarlılık sonuçları ile karşılaştıran başka bir çalışmada ise Sensititre™ yöntemi için KU oranı %91, ÇBH oranı %0 ve BH oranı %2 olarak bulunmuştur (16). Janet ve arkadaşlarının (17) çalışmasında, SMD referans yöntemine göre Sensititre™ yöntemi için KU oranı %96, ÇBH oranı %0 ve BH oranı %5 olarak tespit edilmiştir. Ülkemizde yapılan bir çalışmada karbapenem dirençli Gram-negatif bakterilerde kolistin için Sensititre™ panelinin referans yöntem ile KU oranı %94.9, ÇBH ve BH oranları sırası ile %7.1 ve %4.5 olarak tespit edilmiştir (18). Çalışmamızda ise, diğer çalışmalardan farklı olarak Sensititre™ yönteminde KU oranı %68, ÇBH oranı %5 ve BH oranı %27 olarak tespit edildi. Elde ettiğimiz sonuçların ISO tarafından belirlenen kriterlere göre kabul edilebilir performansta olmadığı görüldü (7).
Çalışmamızda; Sensititre™ yöntemindeki kategorik uyumun düşüklüğüne, yöntemin referans testten daha düşük ve referans testten daha yüksek olan, MİK kesme noktası referans testin çevresinde MİK değerine sahip izolatlar neden olmuştur. Sensititre’nin referans testten daha düşük, MİK kesme noktası referans testin çevresinde MİK değerine sahip beş izolat bulunmaktadır (SMD MIK 4; Sensititre™ MIK 2). Bu eğilim, Matuschek ve arkadaşlarının (16) çalışmasının yanı sıra Yusuf ve arkadaşlarının (19) çalışmasında da görülmüştür. Sensititre’nin referans testten daha yüksek ve MİK kesme noktası referans testin çevresinde MİK değerine sahip olan 25 izolat bulunmaktadır (SMD MIK 2; Sensititre MIK 4). Bu iki durum normalde olası teknik hatalar için bir tampon bölge olarak kullanılan EUCAST ve CLSI “breakpoint” tablolarında orta değer (“intermediate”) kategorisinin olmamasıyla açıklanabilir. Ayrıca MİK değeri sınır değere yaklaştıkça, ÇBH ya da BH oranlarının arttığı Matuschek ve arkadaşlarının (16) çalışmasında da bildirilmiştir.
Tüzemen ve arkadaşlarının (20) yapmış olduğu çalışmada, BD Phoenix™ 100 otomatize sisteminin A. baumannii için kolistin duyarlılığının belirlenmesinde referans yönteme göre KU oranı %77.8, ÇBH oranı %0 ve BH oranı %22.2 olarak tespit edilmiştir. Vourli ve arkadaşları (21) tarafından yapılan çalışmada, kolistin duyarlılığının belirlenmesinde kullanılan BD Phoenix™ 100 otomatize sisteminin ÇBH oranı %41.4 olarak tespit edilmiştir. Ülkemizde yapılan bir çalışmanın verilerine göre, BD Phoenix™ 100 otomatize sisteminin referans yönteme göre A. baumannii için kolistinin ÇBH oranı %71.4 olarak saptanmış; BH ise gözlenmemiştir (22). Çalışmamızda BD Phoenix™ 100 için kolistin sonuçlarını SMD yöntemi ile karşılaştırdığımızda KU oranı %79, BH oranı %10, ÇBH oranı %11 olarak bulundu. BD Phoenix™ 100 otomatize sisteminden elde ettiğimiz kolistin duyarlılık sonuçlarının yapılan çalışmalarla uyumlu olduğu ve ISO tarafından belirlenen kriterlere göre kabul edilebilir performansta olmadığı görüldü (7). BD Phoenix™ 100 ile kolistin duyarlı ya da dirençli tespit edilen suşların BMD yöntemi ile doğrulanması gerekmektedir.
Osei ve arkadaşları (23) yapmış oldukları çalışmada, MicroScan WalkAway™ otomatize sistemini, SMD yöntemi ile karşılaştırdıklarında; Enterobacter cloacae, Salmonella ve non-fermanter Gram-negatif bakteriler (Pseudomonas hariç) dışındaki Gram-negatif bakteriler için, kolistine dirençli izolatların %92.31’inin tespit edilebildiğini, özgüllüğün ise %76.92 olduğunu belirtmiştir. Ancak non-fermanter bakteriler için MicroScan WalkAway™ otomatize sisteminden elde edilen kolistin duyarlılık sonuçlarının doğrulanması amacıyla SMD yönteminin kullanılmasını önermişlerdir. Acinetobacter spp. izolatlarıyla agar dilüsyon yöntemini altın standart kabul ederek VITEK® 2, MicroScan WalkAway™, Etest® yöntemlerinin kolistine duyarlılıklarının karşılaştırıldığı başka bir çalışmada ise, MicroScan WalkAway™ otomatize sisteminin A. baumannii için KU oranı % 95.7, ÇBH oranı %0 ve BH oranı %4.3 olarak bulunmuştur (24). Ülkemizde yapılan bir çalışmada, karbapenem dirençli Enterobacteriaceae izolatlarında MicroScan WalkAway™ sistemi referans yöntem ile karşılaştırarak kolistin duyarlılığı KU oranı %90, ÇBH oranı %7.5 ve BH oranı %2.5 olarak tespit edilmiştir (25). Çalışmamızda, A. baumannii izolatlarında MicroScan WalkAway™ sistemi, SMD yöntemi altın standart kabul edildiğinde, KU oranı %97, ÇBH oranı %2 ve BH oranı %1 olarak tespit edildi; ISO tarafından belirlenen kriterlere göre de kabul edilebilir performanstaydı (7).
CLSI-EUCAST Polimiksin Eşik Değer Belirleme Çalışma Grubu, ISO 20776:1 standardına göre kolistin duyarlılığının belirlenmesi için SMD yöntemini “referans yöntem” olarak kabul etmiştir (3). Günümüzde de tek geçerli yöntem olan sıvı mikrodilüsyon ile farklı yöntemlerin karşılaştırıldığı çalışmalar yapılmaktadır. Ancak ticari olarak üretilen otomatize ve manuel sistemlerin sıvı mikrodilüsyon ile karşılaştırıldığı çalışmaların sayısı az olup bu çalışmalardan farklı sonuçlar alınmıştır. Çalışmamızın verilerine göre; kolistin direncinin SMD yöntemiyle doğrulanamadığı durumlarda, MicroScan WalkAway™ otomatize sisteminin MİK değerleri kabul edilebilir bulundu. Ancak, Mikroscan WalkAway™ sistemi de dahil olmak üzere tüm ticari mikrodilüsyon yöntemlerinin kullanıldığı durumlarda sonuçların daha dikkatli olarak değerlendirilmesi ve testlerin kalite kontrollerinin standartlara uygun ve düzenli olarak yapılması uygun olacaktır.
Sonuç olarak; laboratuvar çalışmalarında kolistin duyarlılığının tespiti için altın standart olarak kullanılan ticari yöntemlerin (gerek cihaz gerekse MİK yöntemleri) SMD yöntemi baz alınarak uluslararası kılavuzlara uyumlu hale getirilmesi için optimize ve standardize edilmesi gerekmektedir.
Etik Kurul Kararı
Çalışma için Fırat Üniversitesi Klinik Araştırmalar Etik Kurulu’ndan 28 Kasım 2019 tarih ve 13281952-514.10-E.1983 karar numarasıyla onay alındı.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – Ö.A.; Tasarım – Ö.A., Z.A.T., P.Ö.; Denetleme – Ö.A.; Kaynak ve Fon Sağlama – Ö.A., P.Ö., F.Ş.; Malzemeler/Hastalar – Ö.A., P.Ö., F.Ş., Z.A.T.; Veri Toplama ve/veya İşleme – Ö.A., P.Ö.; Analiz ve/veya Yorum – Ö.A., Z.A.T.; Literatür Taraması – Ö.A., F.Ş.; Makale Yazımı – Ö.A., P.Ö., F.Ş.; Eleştirel İnceleme – Ö.A., Z.A.T.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Ezadi F, Ardebili A, Mirnejad R. Antimicrobial susceptibility testing for polymyxins: challenges, issues, and recommendations. J Clin Microbiol. 2019;57(4):e01390-18. [CrossRef]
- Osei Sekyere J, Govinden U, Bester LA, Essack SY. Colistin and tigecycline resistance in carbapenemase-producing Gram-negative bacteria: emerging resistance mechanisms and detection methods. J Appl Microbiol. 2016;121(3):601-17. [CrossRef]
- Recommendations for MIC determination of colistin (polymyxin E) as recommended by the joint CLSI-EUCAST Polymyxin Breakpoints Working group, 2016 [İnternet]. The European Committee on Antimicrobial Susceptibility Testing and Clinical and Laboratory Standards Institute. [erişim Ağustos 2021]. http://www.bioconnections.co.uk/files/merlin/Recommendations_for_MIC_determination_of_colistin_March_2016.pdf
- Warnings concerning antimicrobial susceptibility testing products or procedures [İnternet]. Copenhagen: European Committee on Antimicrobial Susceptibility Testing (EUCAST). [erişim 16 Temmuz 2021]. www.eucast.org/ast_of_bacteria/warnings
- Alper Y. Klinik örneklerden izole edilen Acinetobacter Baumannii suşlarında kolistin duyarlılığının değerlendirilmesinde standart mikrodilüsyon yönteminin iki farklı ticari MİK yöntemi ile karşılaştırılması [Uzmanlık Tezi]. Atatürk Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı; 2019.
- Clinical and Laboratory Standards Institute. Development of In Vitro Susceptibility Testing Criteria and Quality Control Parameters. Approved Guideline. 3rd ed. CLSI document M23-A3. Wayne, PA: CLSI, 2008.
- International Organization for Standardization. ISO 20776-2:2007: Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility testing of infectious agents evaluation of performance of antimicrobial susceptibility test devices – Part 2: Evaluation of performance of antimicrobial susceptibility test devices. Geneva: ISO, 2007.
- Grégoire N, Aranzana-Climent V, Magréault S, Marchand S, Couet W. Clinical pharmacokinetics and pharmacodynamics of colistin. Clin Pharmacokinet. 2017;56(12):1441-60. [CrossRef]
- Vasoo S. Susceptibility testing for the polymyxins: two steps back, three steps forward? J Clin Microbiol. 2017;55(9):2573-82. [CrossRef]
- Osei Sekyere J. Mcr colistin resistance gene: a systematic review of current diagnostics and detection methods. Microbiologyopen. 2019;8(4):e00682. [CrossRef]
- Tan TY, Ng SY. Comparison of Etest, Vitek and agar dilution for susceptibility testing of colistin. Clin Microbiol Infect. 2007;13(5):541-4. [CrossRef]
- Lellouche J, Schwartz D, Elmalech N, et al; AIDA study group. Combining VITEK® 2 with colistin agar dilution screening assist timely reporting of colistin susceptibility. Clin Microbiol Infect. 2019;25(6):711-6. [CrossRef]
- Şafak B, Tombak Ö, Eren-Topkaya A. [Comparative evaluation of VITEK 2 and broth microdilution methods for colistin antimicrobial susceptibility test]. Namık Kemal Tıp Dergisi. 2020;8(1):73‐8. [CrossRef]
- Arafa RM, Aboelazm AA, Saleh MM, Abd Elhameed HS. Evaluation of colistin and tigecycline susceptibility testing methods for Klebsiella pneumoniae and Acinetobacter baumannii clinical isolates. Egyptian Journal of Medical Microbiology. 2021;30(2):35-42. [CrossRef]
- Dafopoulou K, Zarkotou O, Dimitroulia E, et al. Comparative evaluation of colistin susceptibility testing methods among carbapenem-nonsusceptible Klebsiella pneumoniae and Acinetobacter baumannii clinical isolates. Antimicrob Agents Chemother. 2015;59(8):4625-30. [CrossRef]
- Matuschek E, Åhman J, Webster C, Kahlmeter G. Antimicrobial susceptibility testing of colistin – evaluation of seven commercial MIC products against standard broth microdilution for Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, and Acinetobacter spp. Clin Microbiol Infect. 2018;24(8):865-70. [CrossRef]
- Hindler JA, Humphries RM. Colistin MIC variability by method for contemporary clinical isolates of multidrug-resistant Gram-negative bacilli. J Clin Microbiol. 2013 Jun;51(6):1678-84. [CrossRef]
- Demir-Çuha M, Hazırolan G. [Comparison of MIC COL, Sensititre™ and colistin agar screening plate methods with broth microdilution reference method for detection of colistin susceptibility in carbapenem-resistant Gram-negative bacteria]. Klimik Derg. 2021;34(3):186-91. Turkish. [CrossRef]
- Yusuf E, van Westreenen M, Goessens W, Croughs P. The accuracy of four commercial broth microdilution tests in the determination of the minimum inhibitory concentration of colistin. Ann Clin Microbiol Antimicrob. 2020;19(1):42. [CrossRef]
- Tüzemen NÜ, Efe K, Akalın H, Özakın C. [Retrospective evaluation of colistin-resistant isolates in automated system by gradient diffusion method and broth microdilution method (Corrigendum)]. Klimik Derg. 2019;32(2):57-61. Turkish. [CrossRef]
- Vourli S, Dafopoulou K, Vrioni G, Tsakris A, Pournaras S. Evaluation of two automated systems for colistin susceptibility testing of carbapenem-resistant Acinetobacter baumannii clinical isolates. J Antimicrob Chemother. 2017;72(9):2528-30. [CrossRef]
- Yakut S. Escherichia Coli, Klebsiella Pneumoniae, Pseudomonas Aeruginosa ve Acinetobacter baumannii klinik izolatlarında kolistin direnci saptanmasında BD Phoenix yarı otomatize sistem ve sıvı mikrodilüsyon yöntemlerinin karşılaştırılması [Uzmanlık Tezi]. Dicle Üniversitesi Tıp Fakültesi Tıbbi Mikrobiyoloji Anabilim Dalı; 2019.
- Osei Sekyere J, Sephofane AK, Mbelle NM. Comparative evaluation of CHROMagar COL-APSE, MicroScan Walkaway, ComASP colistin, and colistin MAC test in detecting colistin-resistant Gram-negative bacteria. Sci Rep. 2020;10(1):6221. [CrossRef]
- Lee SY, Shin JH, Lee K, et al. Comparison of the Vitek 2, MicroScan, and Etest methods with the agar dilution method in assessing colistin susceptibility of bloodstream isolates of Acinetobacter species from a Korean university hospital. J Clin Microbiol. 2013;51(6):1924-6. [CrossRef]
- Yiş R. Karbapenem dirençli Enterobacteriaceae (KDE) izolatlarında kolistin duyarlılığı: BD Phoenix, Microscan ve Gradient test duyarlılık sonuçlarının sıvı mikrodilüsyon yöntemi ile karşılaştırılması [Özet]. In: 34. ANKEM Akılcı Antibiyotik Kullanım Kongresi (1-5 Mayıs 2019, Marmaris) Kitabı. İstanbul: ANKEM Derneği, 2019: 78-125.