En Çok Okunanlar
Özet
Amaç: Çalışmada, dispeptik şikayetlerle başvuran hastalardan alınan mide antrum biyopsi örneklerinde, hızlı üreaz testi (HÜT), kültür ve histoloji yöntemleriyle Helicobacter pylori infeksiyonu varlığının araştırılması; izolatların amoksisilin, klaritromisin, levofloksasin ve metronidazole karşı dirençlerinin antibiyotik gradyan yöntemiyle belirlenmesi amaçlandı.
Yöntemler: Antrum ve korpus bölgelerinden alınan 278 biyopsi örneğinin mikrobiyolojik ve histopatolojik incelemeleri yapıldı. Biyopsi örneklerinde H. pylori varlığı; kültür, histoloji ve HÜT testleri ile araştırıldı. İzolatların; amoksisilin, klaritromisin, levofloksasin ve metronidazole karşı antimikrobiyal dirençleri antibiyotik gradyan yöntemiyle tespit edildi. Kültür altın standard yöntem olarak belirlendi ve histoloji ve HÜT için duyarlılık ve özgüllük hesaplandı. Ayrıca histoloji ve HÜT’ün birlikte pozitifliği altın standard kriteri kabul edilerek kültür için duyarlılık ve özgüllük oranları hesaplandı.
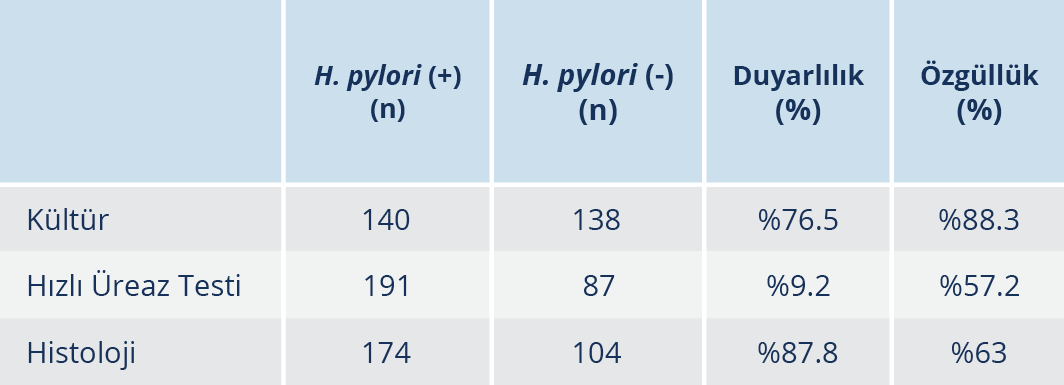
Bulgular: Çalışmada, H. pylori pozitifliği; 278 hastanın 140’ında kültür, 174’ünde histoloji ve 191’nde HÜT ile belirlendi. Kültür, histoloji ve HÜT yöntemlerinin duyarlılık oranları %76.5 ve %88.3, %87.8 ve özgüllükleri %63, %94.2 ve %57.2 olarak tespit edildi. Kültürden izole edilen 140 H. pylori suşunda antibiyotik gradyan yöntemiyle antibiyotik direnci araştırıldı; amoksisilin, klaritromisin, levofloksasin ve metronidazole karşı direnç oranları sırasıyla 9 (%6.4), 22 (%15.7), 17 (%12.1), 57 (%40.7) olarak tespit edildi.
Sonuçlar: Çalışmada; kültür, HÜT ve histoloji yöntemleri arasında en duyarlı testin HÜT olduğu görüldü. Kültür yönteminin özgüllüğünü yüksek olarak tespit etmemize rağmen, duyarlılığı diğer yöntemlere göre oldukça düşüktü. H. pylori kültürünün duyarlılığının düşük olması; bakterinin nazlı, güç üreyen bir mikroorganizma olması, klinik örneğin alınması ve transport koşullarının izolasyon şansını doğrudan etkilemesi gibi faktörlerden kaynaklanabilir.
GİRİŞ
Helicobacter pylori (H. pylori), ilk kez 1983 yılında Warren ve Marshall tarafından insan midesinde gösterilmiş, özellikle peptik ülser hastalığı ile birlikteliği bildirilmiştir (1). H. pylori infeksiyonu dünyada oldukça yaygın olup gelişmiş ülkelerde %20-50; gelişmekte olan ülkelerde ise %50-90 oranında görülmektedir (2). H. pylori çeşitli mide hastalıklarına neden olan bir bakteri olup infeksiyon sonucunda gastrit, peptik ülser, mide mukozası ile ilişkili lenfoid doku lenfoması ve mide kanseri gelişmesi günümüzde önemini artırmaktadır (3, 4).
H. pylori infeksiyonunun tanısında, invazif ve invazif olmayan çeşitli testler kullanılmaktadır. Seroloji, üre nefes testi ve dışkıda antijen testleri invazif olmayan tanı yöntemleridir. İnvazif testler ise; hızlı üreaz testi (HÜT), histoloji, kültür ve moleküler yöntemlerdir. Bu testler için endoskopi ile alınan mide biyopsi örneğine gereksinim duyulur. Tanıda endoskopi ile alınan örneklerde, en az iki testin birlikte kullanılması, yüksek duyarlılık ve özgüllüğünden dolayı önerilmektedir (5).
H. pylori infeksiyonu tedavisinde lansoprazol ile birlikte kombine antibiyotik kullanımı gerekmektedir. Amoksisilin, klaritromisin, levofloksasin ve metronidazol, infeksiyonun tedavisinde seçilen antibakteriyel ajanlardır. Tedavi başarısızlıkları; hastanın yaşı, tedavi öncesi midedeki bakteri yükü, sigara kullanımı, hastanın ilaç uyumu ve ilaç direnci gibi nedenlere bağlanmaktadır.
Bu çalışmada, dispeptik şikayetlerle başvuran hastalardan alınan mide biyopsi örneklerinde kültür, histoloji ve HÜT yöntemleriyle H. pylori infeksiyonu varlığının araştırılması ve izolatların amoksisilin, klaritromisin, levofloksasin ve metronidazole karşı dirençlerinin antibiyotik gradyan yöntemi (Etest® bioMérieux, Marcy-l’Ètoile, Fransa) ile belirlenmesi amaçlandı.
YÖNTEMLER
Çalışmaya, alarm semptomları (kilo kaybı, bulantı, kusma, disfaji, hematemez, melena, vb.) olmayan ancak dispeptik şikayetleri olan ve gastroenteroloji bilim dalına başvurarak, endoskopik incelemeleri yapılan 278 hasta dahil edildi. Antrum ve korpus bölgelerinden alınan biyopsi örneklerinin mikrobiyolojik ve histopatolojik incelemesi yapıldı. Her hastadan histopatolojik inceleme için 2 antrum, 1 korpus; hızlı üreaz testi için 1 antrum, 1 korpus; kültür için 1 antrum, 1 korpus olmak üzere toplam 4 antrum ve 3 korpus biyopsi örneği alındı.
Eradikasyon tedavisi almış, son iki hafta içinde proton pompa inhibitörü kullanmış, son iki ay içinde antibiyotik veya bismut içeren bileşikler almış ve endoskopi için kontrendikasyon kriterlerinden birisi pozitif olan hastalar çalışma dışı bırakıldı.
Selçuk Üniversitesi Meram Tıp Fakültesi Etik Kurulu’ndan 27.02.2009 tarih ve 2009/065 karar numarasıyla onay alındı. Ayrıca, hastaların hepsine çalışma hakkında ayrıntılı bilgi verildi ve aydınlatılmış onam formu alındı.
Hızlı Üreaz Testi
Gastrik biyopsi dokusu, üre içeren bir ortamda tutulacak olursa H. pylori tarafından üretilen üreaz üreyi kısa zamanda amonyak ve bikarbonata parçalar. Amonyak üretiminin sonucu pH yükselir ve ortamdaki renk pembeye dönüşür. Bu sonuç biyopsi materyalinde bakterinin bulunduğunu gösterir (6). Çalışmamızda, biyopsi örneklerinde üreaz aktivitesini araştırmak amacıyla CLO test (Kimberly-Clark Ballard Medical Products, Roswell, GA, ABD) kullanıldı. Bir antrum örneği ve bir korpus biyopsi örneği CLO testine alındı; oda sıcaklığında bekletilen test 1 saat ve 24 saat sonra değerlendirilerek sonuçlar not edildi.
Histopatolojik İnceleme
Hastaların antrum ve korpus biyopsi preparatları, histopatolojik tanı ve organizmanın direkt taranması için sırasıyla; formalinde fiksasyon, rutin hematoksilen-eosin (HE) boyaması ve özel boyama (Giemsa boyaması) işlemlerine tabi tutularak ışık mikroskobunda birbirinden habersiz (kör) iki farklı patolog tarafından incelendi. Sonuçlar preparatlardaki bakteri yoğunluğuna göre; hafif (+), orta (++), şiddetli (+++) pozitiflik olarak raporlandı.
Bakteri Kültürü
Endoskopi ünitesinden alınan mide biyopsi örnekleri, Portagerm pylori (PORT-PYL, bioMérieux, Marcy-l’Étoile, Fransa) transport medyumu içerisinde hızlıca laboratuvara ulaştırıldıktan sonra, at serumu ilave edilmiş pylori besiyerine (PYL, bioMérieux, Marcy-l’Étoile, Fransa) ekim yapıldı. Ekimleri yapılan örnekler hemen jara (bioMérieux, Marcy-l’Étoile, Fransa) yerleştirilip H. pylori’nin üreyebileceği mikroaerofilik atmosfer (1 saat sonraki ortalama O2 konsantrasyonu %7.5 ve 24 saat sonraki ortalama CO2 konsantrasyonu %8) “GENbox microaer” (bioMérieux, Marcy-l’Étoile, Fransa) ile sağlanarak 37°C’de 72 saat inkübe edildi. Besiyerinde üreyen koloniler Gram boyama yapılarak incelendi. Mikroskopta, Gram negatif boyanmış, kıvrık görünümde, bazen de tipik görünümlerinin yanı sıra düz basiller görülmesi, üreaz (Urea-indole medium, bioMérieux, Marcy-l’Étoile, Fransa), katalaz (ID color Catalase, bio-Mérieux, Marcy-l’Étoile, Fransa) ve oksidaz (Oxidase Reagent, bioMérieux, Fransa) pozitifliği saptanan kolonilerin varlığında H. pylori yönünden anlamlı olarak değerlendirildi.
Antibiyotik Duyarlılık Testleri
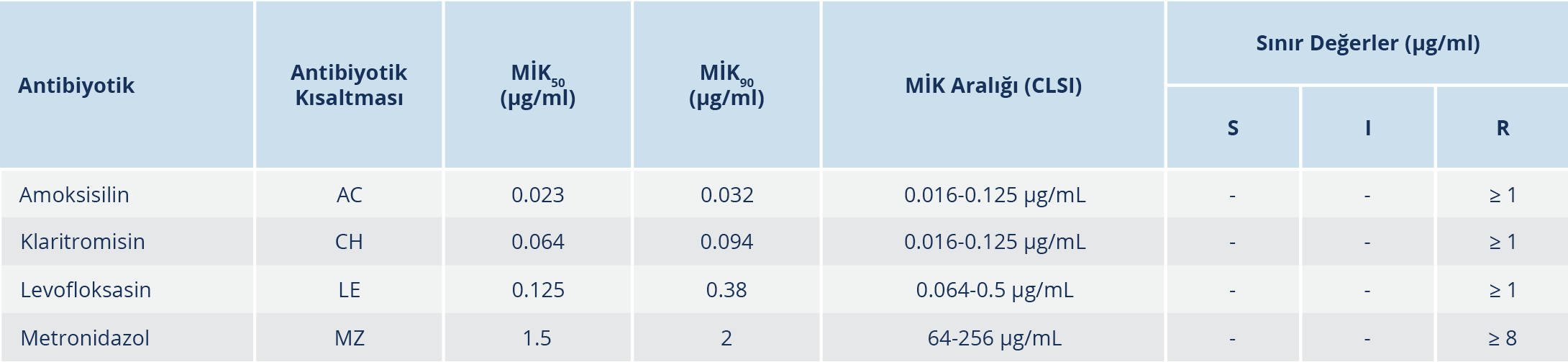
İzolatların; amoksisilin, klaritromisin, levofloksasin ve metronidazol duyarlılığı antibiyotik gradyan yöntemiyle (Etest®, bioMérieux, Marcy-l’Ètoile, Fransa) araştırıldı. Saf olarak elde edilen H. pylori kültürlerinden alınan kolonilerle, sıvı besiyeri içinde McFarland 3 bulanıklığına göre hazırlanan bakteri süspansiyonundan, %5 koyun kanlı Mueller-Hinton besiyeri (bioMérieux, Marcy-l’Étoile, Fransa) yüzeyine ekim yapıldı. Plaklar mikroaerofilik ortamda 37 °C’de 3 ile 5 gün arasında inkübe edildi. İnkübasyon sonunda, elips şeklindeki inhibisyon zonunun Etest® şeridi ile kesiştiği noktaya karşılık gelen antibiyotik konsantrasyonu minimum inhibitör konsantrasyon (MİK) değeri olarak kabul edildi. Kontrol suşu olarak besiyerlerinin denetimi için H. pylori NCTC 11637 ve antibiyotik duyarlılık testleri için H. pylori ATCC 43504 kullanıldı. Sonuçlar Klinik ve Laboratuvar Standardları Enstitüsü (“Clinical and Laboratory Standards Institute”, CLSI) standardlarına göre değerlendirildi (7). Bu çalışmada kullanılan antibiyotiklere ait MİK değerleri Tablo 2’de gösterilmiştir.
Hastalarda altın standard olarak; tek başına kültür yöntemi ya da histoloji ve HÜT ikilisinin birlikte pozitif olması kabul edildi. Kültür, altın standard kriteri alınarak histoloji ve HÜT için duyarlılık ve özgüllük hesaplandı. Ayrıca histoloji ve HÜT’ün ikisinin birlikte pozitifliği altın standard kriteri alınarak kültür için duyarlılık ve özgüllük hesaplandı.
İstatistiksel Analiz
Verilerin istatistiksel analizi “IBM SPSS Statistics for Windows. Version 22.0” (IBM Corp., Armonk, NY, ABD)” programı kullanılarak yapıldı. p değerinin ≤ 0.05 olması istatistiksel olarak anlamlı kabul edildi.
BULGULAR
Çalışmaya; 16-83 yaşları arasında, yaş ortalaması 40.8 olan 156 (%56.1)’sı kadın, 122 (%43.9)’si erkek 278 hasta alındı. Endoskopi işlemi sonrasında; 174 hastada gastrit ve/veya duodenit, 37 hastada duodenal ülser, 14 hastada özofajit, 35 hastada gastrik ülser, 9 hastada gastrik kanser ve 9 hastada normal endoskopik bulgular saptandı.
Çalışmaya alınan 278 hastanın 140’ının kültüründe üreme saptandı; 174’ünde histoloji ile pozitiflik tespit edildi. Ayrıca HÜT ile 191 hastada H. pylori pozitifliği görüldü. Altın standard kriterine göre kültür yöntemiyle 39, histoloji ile 17 ve HÜT ile 8 olguda yalancı negatif sonuç saptandı. Hastaların kültür, histoloji ve HÜT yöntemleri için duyarlılık oranları sırasıyla %76.5 ve %88.3, %87.8 ve özgüllükleri %63, %94.2 ve %57.2 olarak tespit edildi (Tablo 1).
Tablo 2. İzole edilen H. pylori Suşları (N=140) için MİK50, MİK90 Değerleri, MİK Aralıkları ve Sınır Değerleri
Kültürden izole edilen 140 H. pylori suşunda, antibiyotik gradyan yöntemiyle (Etest®) antibiyotik direnci araştırıldı. H. pylori suşlarının 9 (%6.4)’unda amoksisiline, 22 (%15.7)’sinde klaritromisine, 17 (%12.1)’sinde levofloksasine ve 57 (%40.7)’sinde metronidazole karşı direnç saptandı. İzole edilen 140 H. pylori suşu için antibiyotik gradyan yöntemiyle (Etest®) elde edilen MİK50 ve MİK90 değerleri Tablo 2’de gösterilmiştir.
TARTIŞMA
H. pylori, insan ve diğer primatların midesine yerleşen spiral şeklinde, mikroaerofilik, Gram negatif bir bakteridir. Vücuda bir defa girdiğinde, tedavi edilmediği takdirde yaşam boyu varlığını devam ettirmektedir. Ülkemiz gibi gelişmekte olan ülkelerde, H. pylori infeksiyonu, gelişmiş ülkelere göre daha sık ve daha erken yaşlarda saptanmaktadır. Çalışmamızda dispeptik şikayetleri olan hastalarda kültür ile H. pylori pozitifliği %50.3 (140/278) oranında saptandı.
H. pylori infeksiyonunun sık görülmesi ve önemli mide hastalıklarına yol açması, tanı testlerinin hızla gelişmesine neden olmuştur. Kültür, histoloji, HÜT ve moleküler testler gibi invazif; seroloji, üre nefes testi ve dışkıda antijen testleri gibi noninvazif testler tanı amacıyla kullanılmaktadır. Çalışmamızda; kültür, histoloji ve HÜT yöntemleri karşılaştırıldı. Bakterinin oksijene olan duyarlılığı, örneğin alındığı yer, taşınma koşulları ve çalışanın tecrübesi gibi nedenlerden dolayı, kültürün duyarlılığı oldukça düşüktür. Bakterinin mide mukozasında yamalı bohça biçiminde dağılım göstermesi, histoloji ve HÜT ile yalancı negatif sonuçlara yol açmaktadır. Bununla beraber oral kavitede bulunabilen ve üreaz pozitif özellik gösteren diğer bakterilerden veya HÜT’ün 24 saatten sonra değerlendirilmesinden dolayı yalancı pozitif sonuçlar görülebilmektedir (8, 9). H. pylori’nin saptanmasının yanı sıra antibiyotik direncini de gösterebilen moleküler yöntemler duyarlılığı ve özgüllüğü yüksek diğer invazif testlerdir. Bu testler, özel transport şartları gerektirmeyen, düşük sayıdaki bakteriyi tespit edebilen ve hızlı sonuç alınan tanı yöntemleridir.
Yapılan araştırmalarda, endoskopi ve biyopsi gerektiren invazif testlerde, mide antrum ve korpus örneklerinin birlikte incelenmesinin tanının doğruluğunu artırdığı bildirilmektedir (10). Çalışmamızda endoskopi sırasında tüm hastalardan hem antrumdan hem de korpustan biyopsi örneği alındı.
Weiss ve arkadaşları (11) çalışmalarında, kültür ve HÜT duyarlılığı sonuçlarını sırasıyla %70 ve %88 olarak tespit etmiştir. Khalifehgholi ve arkadaşları (12), 91 hasta üzerinde yaptıkları çalışmada, duyarlılık ve özgüllükleri; histolojide %9.6, %77.8 ve HÜT’te %95.6, %100 olarak tespit etmiştir. Ankara’da 2016 yılında 126 hasta üzerinde yapılan bir çalışmada, duyarlılık ve özgüllükler; kültürde %68.1 ve %100; histolojide %94.8 ve %100; HÜT’te %87.9 ve %70 saptanmıştır (13). Ülkemizde 102 çocuk hasta üzerinde yapılan başka bir araştırmada kültürün duyarlılığı %54.9, HÜT’ün duyarlılığı %89.2 olarak bildirilmiştir (14). Kaklıkkaya ve arkadaşlarının (15), 200 antral mide biyopsi örneğinde yaptıkları çalışmada, duyarlılık ve özgüllükler; kültürde %87.1, %99 ve HÜT’te %77.2, %92 olarak saptanmıştır. Çalışmamızda altın standard kriterine göre 278 mide biyopsi örneği değerlendirildiğinde duyarlılık ve özgüllükler; kültürde %76.5 ve %88; histolojide %87,8 ve %63; HÜT’te %94.2 ve %57.2 olarak tespit edilmiştir.
Tedavi başarısızlığının büyük bir kısmı, kullanılan antibiyotiklere karşı direnç nedeniyle ortaya çıkmaktadır (16, 17). Dilüsyon yöntemlerine göre daha kısa zamanda ve kolay uygulanabilir bir yöntem olan antibiyotik gradyan yöntemi (Etest®) antibiyotik duyarlılık araştırmalarında sıklıkla kullanılmaktadır. 2007 yılında Tayvan’da yapılan bir çalışmada amoksisilin direnci %36.1 oranında görülmüştür (18). Ülkemizde son yıllarda yapılan bir çalışmada amoksisilin direnci %3.2 olarak saptanmıştır (19). Çalışmamızda antibiyotik gradyan yöntemiyle (Etest®) %6.4 oranında amoksisilin direnci saptandı. Kanada, İran, Peru ve Türkiye’de yapılan araştırmalarda, klaritromisin direnç oranları, sırasıyla %40, %21.7, %35.5 ve %28 olarak görülmüştür (20-23). Çalışmamızda ise %15.7 oranında klaritromisin direnci tespit edildi.
Amerika’da yapılan bir çalışmada levofloksasin direnci %31.3 olarak görülmüştür (24). Kanada’da 2015 yılında 20 H. pylori izolatında yapılan bir çalışmada levofloksasin direnci %30 olarak saptanmıştır (20). Ülkemizde 2015 yılında yapılan bir çalışmada levofloksasin direnci %29.5 olarak saptanmıştır (25). Çalışmamızda antibiyotik gradyan yöntemiyle (Etest®) %12.1 oranında levofloksasin direnci saptandı. Ülkemizde bölgeler arasında farklılıklar olmakla birlikte H. pylori’de metronidazol direnci %41.9-53 arasında değişmektedir (19, 26). Çalışmamızda antibiyotik gradyan yöntemiyle (Etest®) metronidazol direnci %40.7 oranında saptandı.
Sonuç olarak, çalışmamızda kültür, HÜT ve histoloji yöntemleri arasında en duyarlı testin HÜT olduğu tespit edildi. Ancak özgüllüğü düşük bulunduğu için sonuçların en az bir farklı yöntemle desteklenmesi gerekmektedir. Kültür yönteminin özgüllüğünü yüksek olarak tespit etmemize rağmen, duyarlılığı diğer yöntemlere göre oldukça düşük olarak görüldü. H. pylori kültürünün duyarlılığının düşük olması; bakterinin nazlı, güç üreyen bir mikroorganizma olması, klinik örneğin alınması ve transport koşullarının izolasyon şansını doğrudan etkilemesi gibi faktörlerden kaynaklanabilir. Gelişen teknolojilerle birlikte; kültür, histoloji ve HÜT yöntemlerini, bir diğer altın standard olabilecek moleküler yöntemlerle birlikte inceleyen araştırmalara ihtiyaç bulunmaktadır.
Hasta Onamı
Hastalardan aydınlatılmış onam formu alınmıştır.
Etik Kurul Kararı
Çalışma için Selçuk Üniversitesi Meram Tıp Fakültesi Etik Kurulu’ndan 27.02.2009 tarih ve 2009/065 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman.
Yazar Katkıları
Fikir/Kavram – R.K., H.B., Y.Ü., G.G.; Tasarım – R.K., H.B., Y.Ü., G.G.; Denetleme – R.K., Y.Ü., G.G.; Kaynak ve Fon Sağlama – R.K., Y.Ü., G.G.; Malzemeler/Hastalar – R.K., G.G.; Veri Toplama ve/veya İşleme – H.B., Y.Ü.; Analiz ve/veya Yorum – R.K., H.B., Y.Ü., G.G.; Literatür Taraması – R.K., H.B.; Makale Yazımı – R.K., H.B.; Eleştirel İnceleme – R.K., Y.Ü.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Sunulduğu Bilimsel Etkinlik
27-28 Şubat 2019 tarihinde gerçekleştirilen 7. EuroSciCon Klinik Patoloji ve Bakteriyel Hastalıklar Konferansı’nda bildiri olarak sunulmuştur.
Referanslar
- Warren J. R., Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet. 1983:1273-5.
- Dunn BE, Cohen H, Blaser MJ. Helicobacter pylori. Clin Microbiol Rev. 1997;42:720-41. [CrossRef]
- Rothenbacher D, Brenner H. Burden of Helicobacter pylori and Helicobacter pylori-related diseases in developed countries: recent developments and future implications. Microb Infect. 2003;5:693-703. [CrossRef]
- Lehours P, Yılmaz O. Epidemiology of Helicobacter pylori infection. Helicobacter. 2007;12 Suppl 1:1-3. [CrossRef]
- Pajares-Garcia JM. Diagnosis of Helicobacter pylori: Invasive methods. Ital J Gastroenterol Hepatol. 1998;30 Suppl 3:S320-3.
- Uyanık MH, Aktaş O. Helicobacter pylori’nin Mikrobiyolojik Tanısı. EAJM. 2007;39:205-9.
- Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing. Eighteenth informational supplement, M2-A9, M7-A7, and M100-S18. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
- Brandi G, Biavati B, Calabrese C, et al. Urease-positive bacteria other than Helicobacter pylori in human gastric juice and mucosa. Am J Gastroenterol. 2006;101(8):1756-61. [CrossRef]
- Chomvarin C, Chantarasuk Y, Mairiang P, et al. Sensitivity and specificity of an in-house rapid urease test for detecting Helicobacter pylori infection on gastric biopsy. Southeast Asian J Trop Med Public Health. 2006;37(2):312-9.
- Korkmaz H, Kesli R, Karabaglı P, Terzi Y. Comparison of the diagnostic accuracy of 5 different stool antigen tests for the diagnosis of Helicobacter pylori infection. Helicobacter, 2013, 18(5):384-91.
- Weiss J, Mecca J, da Silva E, Gassner D. Comparison of PCR and other diagnostic techniques for detection of Helicobacter pylori infection in dyspeptic patients. J Clin Microbiol. 1994;32(7):1663-8. [CrossRef]
- Khalifehgholi M, Shamsipour F, Ajhdarkosh H, et al. Comparison of five diagnostic methods for Helicobacter pylori. Iran J Microbiol. 2013;5(4):396-401.
- Cosgun Y, Yildirim A, Yucel M, et al. Evaluation of invasive and noninvasive methods for the diagnosis of Helicobacter pylori infection. Asian Pac J Cancer Prev. 2016;17(12):5265-72. [CrossRef]
- Ozçay F, Koçak N, Saltik Temizel IN, et al. Helicobacter pylori infection in Turkish children: comparison of diagnostic tests, evaluation of eradication rate, and changes in symptoms after eradication. Helicobacter. 2004;9(3):242-8. [CrossRef]
- Kaklıkkaya N, Çubukçu K, Yazıcı Y, et al. Gastrointestinal yakınması olan hastalarda gram boyama, ureaz ve kultur testleri ile Helicobacter pylori varlığının belirlenmesi. İnfeksiyon Derg. 2003;17(3):329-32.
- Dzieniszewski J, Jarosz M. Guidelines in the medical treatment of Helicobacter pylori infection. J Physiol Pharmacol. 2006;57 Suppl 3:143-54.
- Megraud F, Lehours P. Helicobacter pylori detection and antimicrobial susceptibility testing. Clin Microbiol Rev. 2007;20(2):280-322. [CrossRef]
- Hu CT, Wu CC, Lin CY, et al. Resistance rate to antibiotics of Helicobacter pylori isolates in eastern Taiwan. J Gastroenterol Hepatol. 2007;22(5):720-3. [CrossRef]
- Bakir Ozbey S, Ozakin C, Keskin M. [Antibiotic resistance rates of Helicobacter pylori isolates and the comparison of E-test and fluorescent in situ hybridization methods for the detection of clarithromycin resistant strains]. Mikrobiyol Bul. 2009;43(2):227-34.
- Eng NF, Ybazeta G, Chapman K, et al. Antimicrobial susceptibility of Canadian isolates of Helicobacter pylori in Northeastern Ontario. Can J Infect Dis Med Microbiol. 2015;26(3):137-44. [CrossRef]
- Hakemi Vala M, Eyvazi S, Goudarzi H, Sarie HR, Gholami M. Evaluation of clarithromycin resistance among Iranian Helicobacter pylori isolates by E-test and real-time polymerase chain reaction methods. Jundishapur J Microbiol. 2016;9(5):e29839. [CrossRef]
- Boehnke KF, Valdivieso M, Bussalleu A, et al. Antibiotic resistance among Helicobacter pylori clinical isolates in Lima, Peru. Infect Drug Resist. 2017;10:85-90. [CrossRef]
- Demiray-Gürbüz E, Yılmaz Ö, Olivares AZ, et al. Rapid identification of Helicobacter pylori and assessment of clarithromycin susceptibility from clinical specimens using FISH. J Pathol Clin Res. 2016;3(1):29-37. [CrossRef]
- Shiota S, Reddy R, Alsarraj A, El-Seraq HB and Graham DY. Antibiotic resistance of Helicobacter pylori among male United States Veterans. Clin Gastroenterol Hepatol. 2015;13(9):1616-24. [CrossRef]
- Caliskan R, Tokman HB, Erzin Y, blet al. Antimicrobial resistance of Helicobacter pylori strains to five antibiotics, including levofloxacin, in Northwestern Turkey. Rev Soc Bras Med Trop. 2015;48(3):278-84. [CrossRef]
- Ağel E, Durmaz B, Tevfik MR, Aşgın N. The isolation and antibiotic resistant pattern of Helicobacter pylori in dyspeptic patients. Turk J Med Sci. 2000;30(2):143-6.