En Çok Okunanlar
Özet
Amaç: Biyolojik ilaç tedavisi kullananlarda hepatit B virusu (HBV) infeksiyonunun varlığı reaktivasyona neden olabilir. Özellikle tofasitinib, tosilizumab ve sekukinumab gibi yeni biyolojik ilaçların kullanımı sonrasında HBV reaktivasyonu sıklığıyla ilgili yeterli veri yoktur. Bu çalışmanın amacı biyolojik ilaç tedavisi kullanan romatoloji hastalarında HBV seroprevalansını incelemek ve geçirilmiş HBV infeksiyonu olanlarda reaktivasyon sıklığını araştırmaktır.
Yöntemler: Romatoloji bölümünden takipli ve biyolojik ilaç tedavisi kürü (BİTK) kullanmış 275 hastanın dosyası HBsAg, anti-HBcIgG, anti-HBs test sonuçlarını değerlendirmek üzere incelendi. Anti-HBcIgG-pozitif hastalarda BİTK öncesi ve sonrası bakılan HBV DNA test sonuçları ve BİTK boyunca bakılan alaninamino transferaz (ALT) test sonuçları incelenerek reaktivasyon sıklığı araştırıldı.
Bulgular: Hastaların %0.4’ünde HBsAg, %34.4’ünde anti-HBs, %25.1’inde ise anti-HBcIgG pozitifti. Kırk bir hastada uygulanmış 53 BİTK’de HBV reaktivasyonu sıklığı araştırıldı. Reaktivasyonun değerlendirildiği BİTK’lerde HBV için profilaktik antiviral ilaç kullanımı sıklığı TNF-α inhibitörlerinde %28.6, rituksimabda %100, tofasitinibde %0, tosilizumabda %75, abataseptte %50, sekukinumabda %0 oranında tespit edildi. Elli üç BİTK’nin birinde HBV reaktivasyonu tespit edildi. Reaktivasyon olgusu izole anti-HBcIgG ve başlangıç HBV DNA testleri pozitif olan, tosilizumab ve kortizon kullanan, entekavir koruyucu tedavisini düzenli kullanmayan bir hastaydı.
Sonuçlar: Biyolojik tedavi kullanılan hastalarda geçirilmiş HBV infeksiyonunun sıklığı yüksektir. Anti-HBcIgG-pozitif hastalarda rituksimab dışındaki BİTK’lerin kullanımı sırasında HBV için proflaktik antiviral ilaç tedavisi sık kullanılmamış olsa bile reaktivasyon nadirdir. Tofasitinib ve sekukinumab tedavisi alanlarda reaktivasyon riski düşük ve tosilizumab tedavisi alanlarda yüksek olabilir.
GİRİŞ
Hepatit B virusu (HBV) tüm dünyada neden olduğu mortalite ve morbidite nedeniyle önemli bir halk sağlığı sorunu olmayı sürdürmektedir. Tüm dünyada yaklaşık 240 milyon kişi HBV taşıyıcısıdır ve HBsAg pozitifliği bölgesel farklar gösterebilmektedir (1-3). Türkiye’de kronik HBV infeksiyonunun bir göstergesi olan HBsAg pozitifliği ve HBV infeksiyonunun geçirildiğinin bir göstergesi olan HBV kor antijenine karşı gelişmiş IgG yapısında antikor (anti-HBc IgG) pozitifliği yüksektir ve çok merkezli bir çalışmada HBsAg pozitifliği %4 ve anti-HBc IgG pozitifliği %30.6 bulunmuştur (4). HBV infeksiyonunu geçirmiş olan bireyler HBsAg test sonuçları negatif olsa da vücutlarında virusun genetik yapısını yıllarca taşıyabilirler (5). Birtakım nedenlerle bu hastaların immün sistemlerinde zayıflık gelişecek olursa HBV reaktive olabilmektedir. Biyolojik ilaçlar, immün veya genetik aracıları hedef alan ilaçlardır (6). Biyolojik ilaçlardan olan tümör nekroz faktörü-α (TNF-α) inhibitörleri (adalimumab, etanersept, golimumab, infliksimab, sertalizumab), anti-CD20 rituksimab, interlökin (İL)-6 inhibitörü tosilizumab, T hücre kostimülasyon inhibitörü abatasept, İL-17 inhibitörü sekukinumab, İL-1 inhibitörleri (anakinra ve kanakinumab) ve Janus kinaz (JAK) inhibitörü tofasitinib; dirençli romatolojik hastalığı olanlarda hastalık aktivitesini baskılarlar. Bununla birlikte hedefe yönelik moleküller oldukları için HBV reaktivasyonuna neden olabilirler (7).
İnaktif HBsAg taşıyıcısı (HBsAg-pozitif) veya iyileşmiş HBV infeksiyonu (anti-HBc IgG ve anti-HBs pozitif) olan birinde HBV DNA’nın negatif iken pozitif olması veya titresinin 1 log10İÜ/ml artışı reaktivasyon olarak kabul edilmektedir (8-10). Romatoloji rutin pratiğinde biyolojik ilaçlar sık kullanılmaktadır. Geçirilmiş HBV infeksiyonu olan bireylerde TNF-α inhibitörleri, rituksimab ve abatasept gibi ilaçların kullanımına bağlı HBV reaktivasyon riski hakkında sınırlı da olsa literatür bilgisine sahibiz, ancak son yıllarda kullanımı giderek artan tofasitinib, sekukinumab, tosilizumab ve İL-1 inhibitörlerinin (anakinra ve kanakinumab) kullanımından sonra HBV reaktivasyonu riskiyle ilgili yeterli veri bulunmamaktadır.
Biz bu çalışmada biyolojik tedavi başlanmış olan tüm romatoloji hastalarında HBsAg ve anti-HBc IgG seroprevalansını ve bu grup hastalarda biyolojik ilaç kullanımını takiben gelişen HBV reaktivasyonu sıklığını tespit etmeyi amaçladık.
YÖNTEMLER
Çalışma dizaynı ve etik
Bu çalışmanın etik kurul onayı Sağlık Bilimleri Üniversitesi Bursa Yüksek İhtisas Eğitim ve Araştırma Hastanesi Klinik Araştırmalar Etik Kurulundan alınmıştır (2011-KAEK-25 2020/07/13). Çalışmanın tüm aşamalarında Helsinki Bildirgesi’nde belirtilmiş olan etik değerler göz önünde bulundurulmuştur. Bu çalışma retrospektif olarak dizayn edilmiş ve Ocak 2016 ile Ağustos 2020 tarihleri arasında Romatoloji Polikliniğinde takip edilmiş olan hastaların dosyaları incelenmiştir.
Dahil edilme ve hariç tutulma kriterleri
Bu çalışmaya 18 yaş üstünde olan hastalar ve hastanemizin romatoloji bölümü tarafından en az 3 ay süreyle ve en az bir biyolojik ilaç tedavisi kürü (BİTK) kullanan hastalar dahil edildi. Çalışmaya dahil edilen hastaların BİTK’leri içerisinde etki mekanizmalarına göre; TNF-αinhibitörleri (adalimumab, etanersept, golimumab, infliksimab, sertalizumab), JAK inhibitörü tofasitinib, İL-17 inhibitörü sekukinumab, anti-CD20 antikoru rituksimab, T hücresi kostimülasyon inhibitörü abatasept, İL-6 inhibitörü tosilizumab ve İL-1 inhibitörleri olan anakinra ve kanakinumab bulunmaktadır. Bu çalışmaya ve HBsAg veya anti-HBc IgG testi bakılmamış olan hastalar dahil edilmemiştir.
Dosyaların taranması
Hastaların demografik verileri, tanıları, BİTK öncesinde bakılan serolojik testleri (HBsAg, anti-HBs, anti-HBcIgG) hasta dosyalarından temin edildi. Ocak 2016-Ağustos 2020 tarihleri arasında bakılan tüm HBV DNA test sonuçları, her bir BİTK kullanım periyodu boyunca bakılan tüm alanin aminotransferaz (ALT) test sonuçları elektronik dosya arşivinden geriye dönük olarak tarandı. Çalışmaya dahil edilen hastaların elektronik reçete arşivi Ocak 2016-Ağustos 2020 tarihleri arasında antiviral ilaç (entekavir, tenofovir) veya BİTK kullanıp kullanmadıkları doğrultusunda incelendi. Bir hastaya takip süresi içerisinde birden çok BİTK uygulandı ise ilk kullanılan ilaç birinci basamak, ikinci kullanılan ilaç ikinci basamak, üçüncü kullanılan ilaç da üçüncü basamak BİTK olarak kaydedildi.
Serolojik testlerin ve serolojik alt grupların sıklıklarının tespiti
Tüm katılımcılar HBV serolojik test sonuçlarına (HBsAg, anti-HBs ve anti-HBc IgG) göre; doğal bağışık (HBsAg-negatif, anti-HBcIgG-pozitif, anti-HBs-pozitif), kronik HBV infeksiyonu (HBsAg-pozitif), izole anti-HBcIgG pozitifliği (anti-HBcIgG-pozitif, anti-HBs-negatif, HBsAg-negatif) ve aşılı (anti-HBs-pozitif, anti-HBcIgG-negatif, HBsAg-negatif) olan hastalar şekilde serolojik alt gruplara ayrıldılar. HBV serolojik test sonuçlarının ve serolojik alt grupların sıklıkları tüm hastalarda ve aksiyel spondiloartrit (aks-SpA), romatoid artrit (RA) ve psoriatik artrit (PSA) hasta alt gruplarında tespit edildi.
Hepatit B reaktivasyonunun taranması
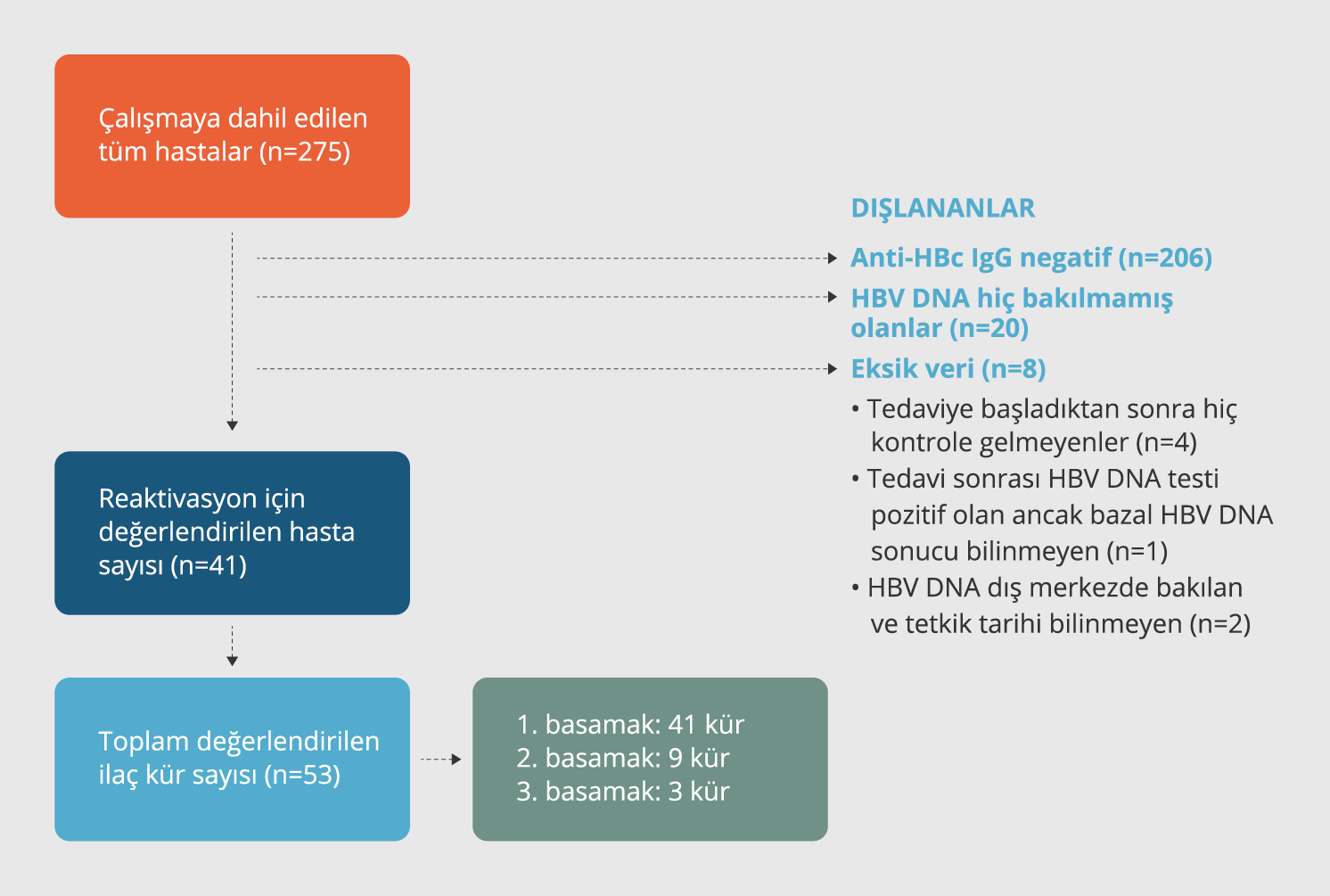
Hepatit B reaktivasyonunun taraması sadece anti-HBc IgG testi pozitif olanlarda yapıldı. Araştırma periyodu içerisinde hiç HBV DNA testi çalışılmamış olan hastalar, BİTK öncesinde veya sonrasında yapılan HBV DNA test sonuçlarından bir tanesi pozitif olup diğer test sonucu araştırılmamış olanlar, BİTK tedavisine başladıktan sonra hiç kontrole gelmemiş olan hastalar reaktivasyon taramasına dahil edilmediler. Reaktivasyon taramasına hastaların dahil edilme sürecini özetleyen akış şeması Şekil 1’de özetlenmektedir. Reaktivasyon taraması BİTK’lerin (birinci, ikinci veya üçüncü) her biri için ayrı yapıldı. Reaktivasyonun araştırıldığı BİTK’de tedavi öncesinde ve sonrasında HBV DNA tetkik edilip edilmediği, BİTK’nin devam edildiği tedavi periyodunda kaç kere ALT testi yapıldığı ve ALT testinin bu periyotlar içerisinde kaç kere 2 kat ve üstünde artış gösterdiği incelendi.
Reaktivasyonu olanlar
- BİTK öncesi HBV DNA testi pozitif olup BİTK kullanım periyodunda bakılan HBV DNA titresinde >1 log10İÜ/ml artış olanlar.
- BİTK öncesinde HBV DNA testi negatif olup BİTK kullanım periyodunda HBV DNA testi pozitif olanlar.
Reaktivasyon olmayanlar
- BİTK öncesi HBV DNA bakılmayan ancak BİTK kullanım periyodunda HBV DNA testleri negatif olup hiç ≥ 2 kat ALT yüksekliği olmayanlar.
- BİTK öncesi ve sonrası HBV DNA negatif olanlar.
- BİTK öncesi ve sonrası HBV DNA testi pozitif olup HBV DNA titre artışı olmayanlar.
- BİTK kullanım periyodunda ≥ 2 kat ALT yüksekliğinin tespit edildiği, ancak bu dönemde yapılan HBV DNA test sonucu negatif olanlar.
Reaktivasyon belirsiz
- BİTK öncesi HBV DNA-negatif olan, tedavi sonrasında HBV DNA testi yapılmayanlar
- BİTK sonrasında ALT’de ≥2 kat yükseklik tespit edilip ALT yüksekliğinin olduğu dönemde HBV DNA testinin çalışılmadığı durumlar.
İstatistiksel analiz
Tüm verilerin analizi IBM SPSS Statistics for Windows. Version 22.0 (Statistical Package for the Social Sciences, IBM Corp., Armonk, NY, ABD) istatistik paket programı kullanılarak yapılmıştır. Çalışma verileri değerlendirilirken tanımlayıcı istatistiksel metotların (frekans, yüzde, ortanca, minimum-maksimum) yanı sıra niteliksel verilerin karşılaştırılmasında χ2 testi kullanıldı. İhtimali (p) α=0.05’ten küçük olan değerler “önemli ve gruplar arasında fark vardır”, büyük olan değerler “önemsiz ve gruplar arasında fark yoktur” şeklinde kabul edildi.
BULGULAR
Hepatit B serolojik test sonuçlarının ve serolojik alt grupların sıklığı
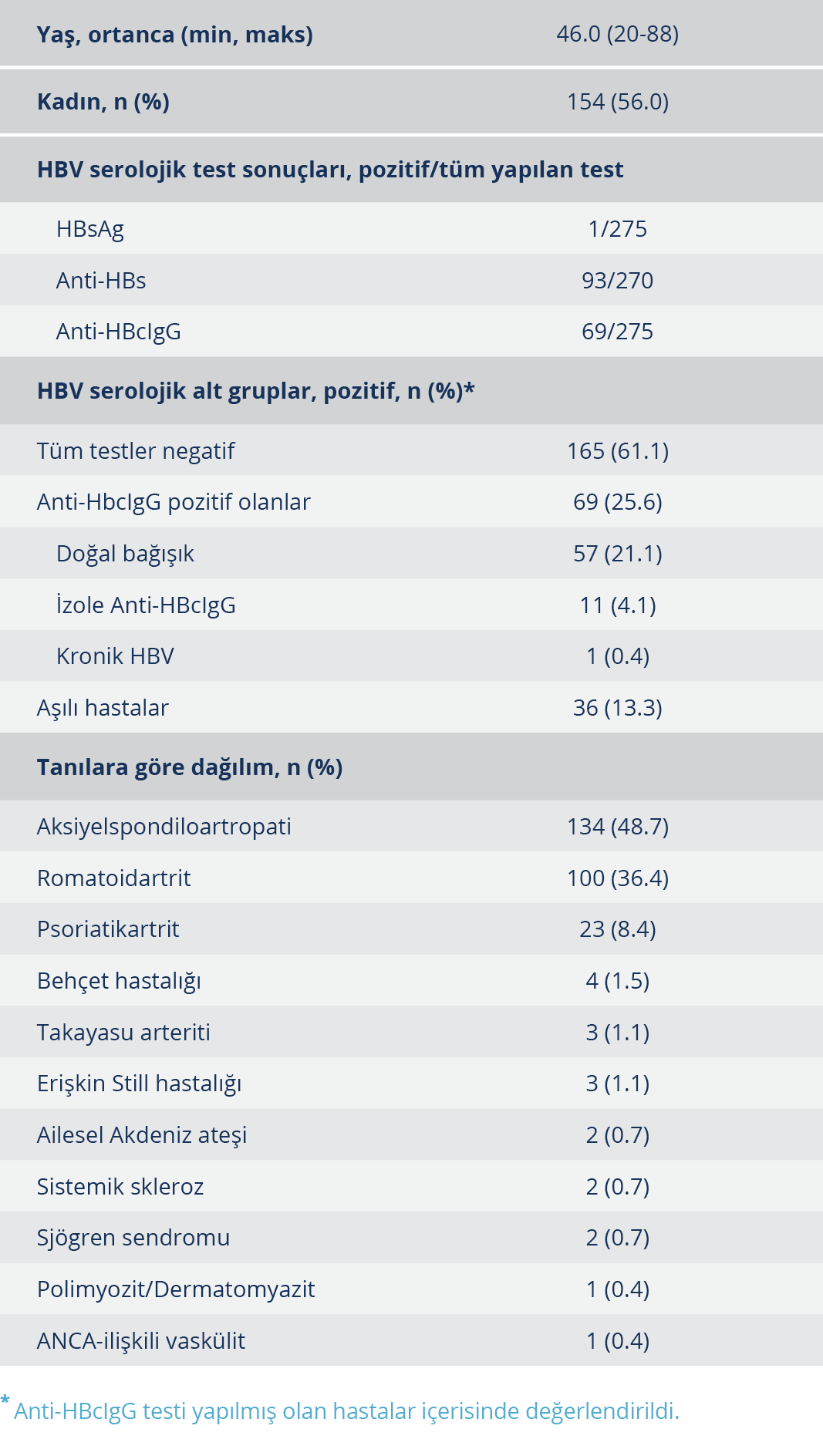
Tablo 1. Biyolojik İlaç Tedavisi Kürü Kullanmış Olan Romatoloji Hastalarının Demografik Verileri, Hepatit B Virusu Serolojik Test Sonuçları, Serolojik Alt Grupları ve Tanılarına Göre Dağılımları
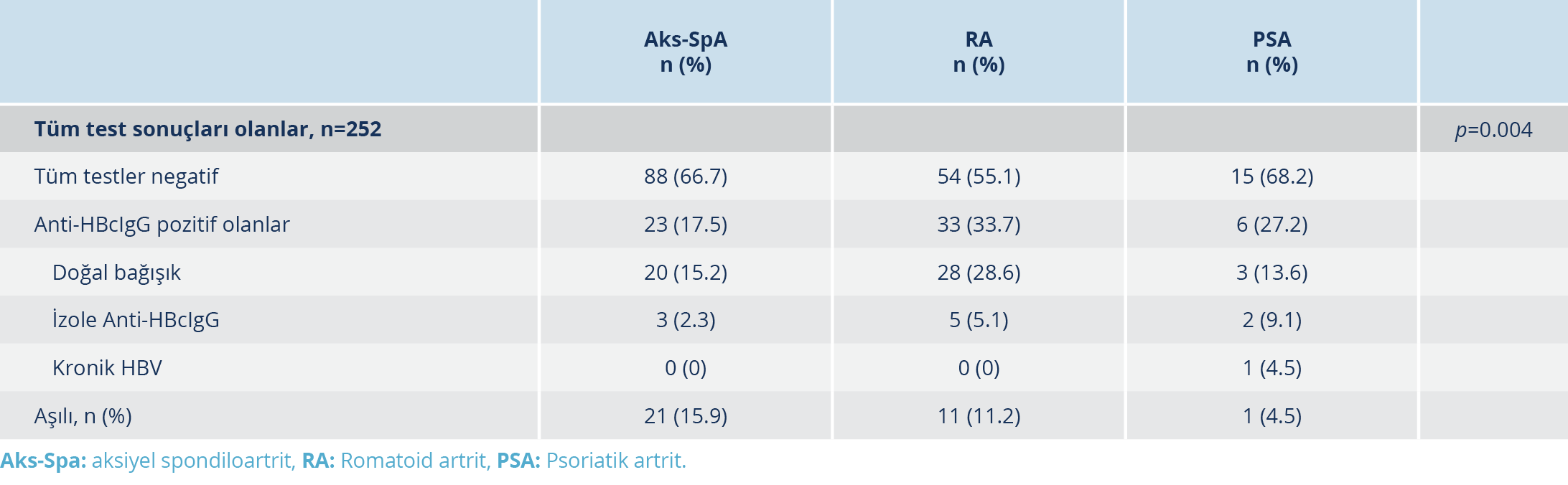
Tablo 2. Aksiyel Spondiloartrit, Romatoid Artrit ve Psoriatik Artrit Hastalarında Hepatit B Virusu Serolojik Alt Gruplarının Sıklıklarının Karşılaştırılması
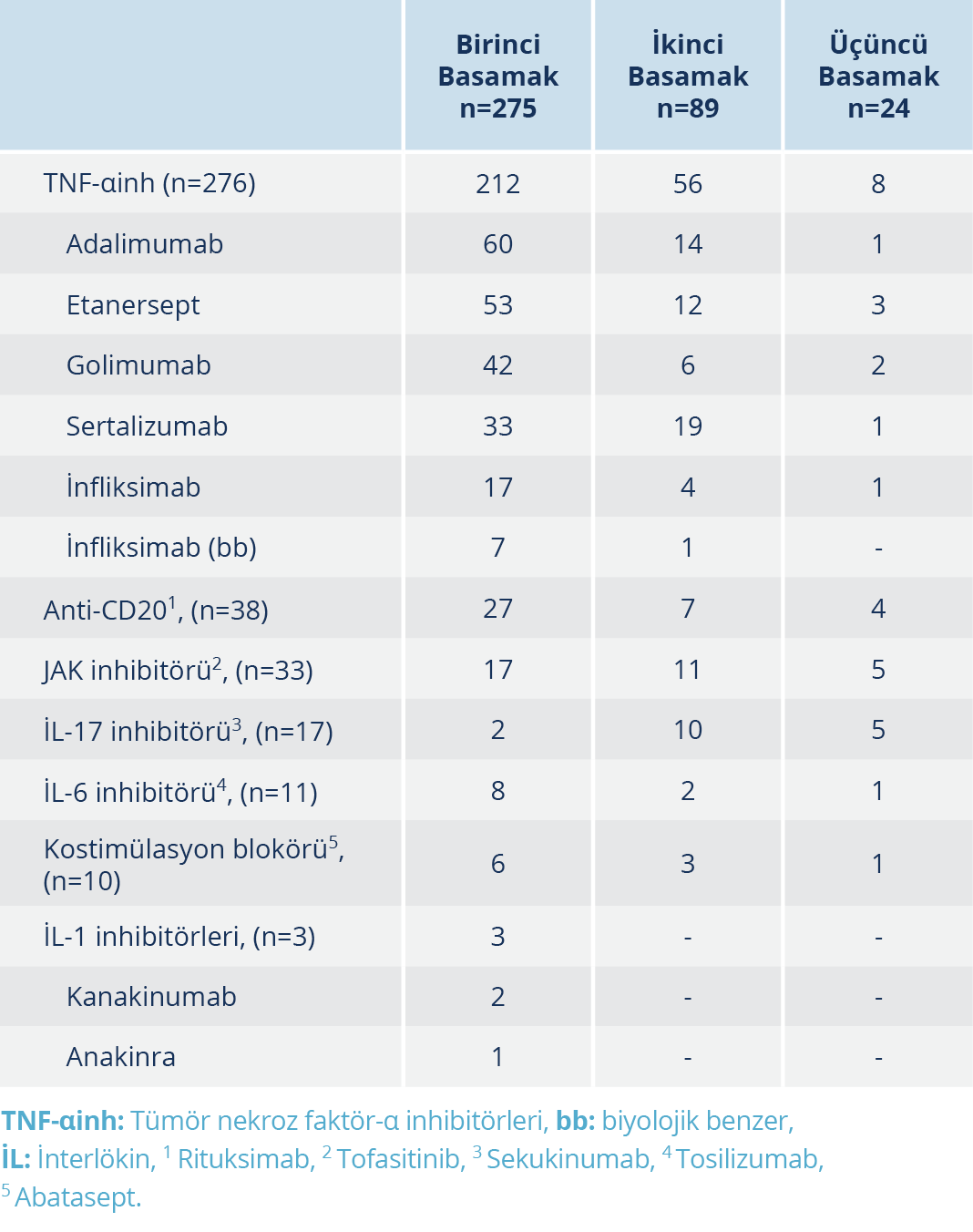
Tablo 3. Çalışma Popülasyonunda Birinci, İkinci ve Üçüncü Basamakta Kullanılan Biyolojik İlaç Tedavisi Kürlerinin Sayısı
Bu çalışmada romatoloji bölümünden takipli olan 3311 hastanın dosyası taranmış ve en az 3 ay süreyle en az bir BİTK uygulanmış olan 289 hasta tespit edilmiştir. Bunlar içerisinden HBsAg ve anti-HBc IgG testi BİTK öncesinde yapılmış olan 275 hasta çalışmaya dahil edildi. Katılımcıların demografik verileri, HBV serolojik test sonuçları, serolojik alt grupları ve tanılara göre dağılımları Tablo 1’de görülmektedir. Aks-SpA, RA ve PSA hastalarında HBV serolojik alt gruplarının sıklıklarının karşılaştırılması Tablo 2’de görülmektedir. RA hastalarındaki anti-HBcIgG pozitifliğinin sıklığı Aks-SpA hastalarından anlamlı düzeyde farklı iken (p=0.05) PSA hastalarından farklı bulunmadı (p=0.521).
Biyolojik ilaç tedavi kürlerinin sıklığı
Çalışma popülasyonunda birinci, ikinci ve üçüncü basamakta kullanılan biyolojik ilaç tedavi kürlerinin sayısı Tablo 3’te gösterilmiştir. Tüm katılımcılar en az bir BİTK kullanmışlardı, ikinci bir BİTK’yı kullanan hastaların sayısı 89, üçüncü bir BİTK’yı kullanan hasta sayısı 24 olmak üzere toplam kullanılan BİTK sayısı 388’di. Katılımcılarda kullanılan BİTK’lerin büyük bir bölümü TNF-αinhibitörü grubu ilaçlardan oluşmaktaydı (%71.1), diğer ilaç grupları azalan sıklıkta sırasıyla; anti-CD20 (%9.8), JAK inhibitörü (%8.5), İL-17 (%4.4) ve İL-6 inhibitörleri (%2.8), kostimülasyon inhibitörü (%2.6) ve İL-1 inhibitörlerinden (%0.8) oluşmaktaydı.
Reaktivasyonun değerlendirilmesi
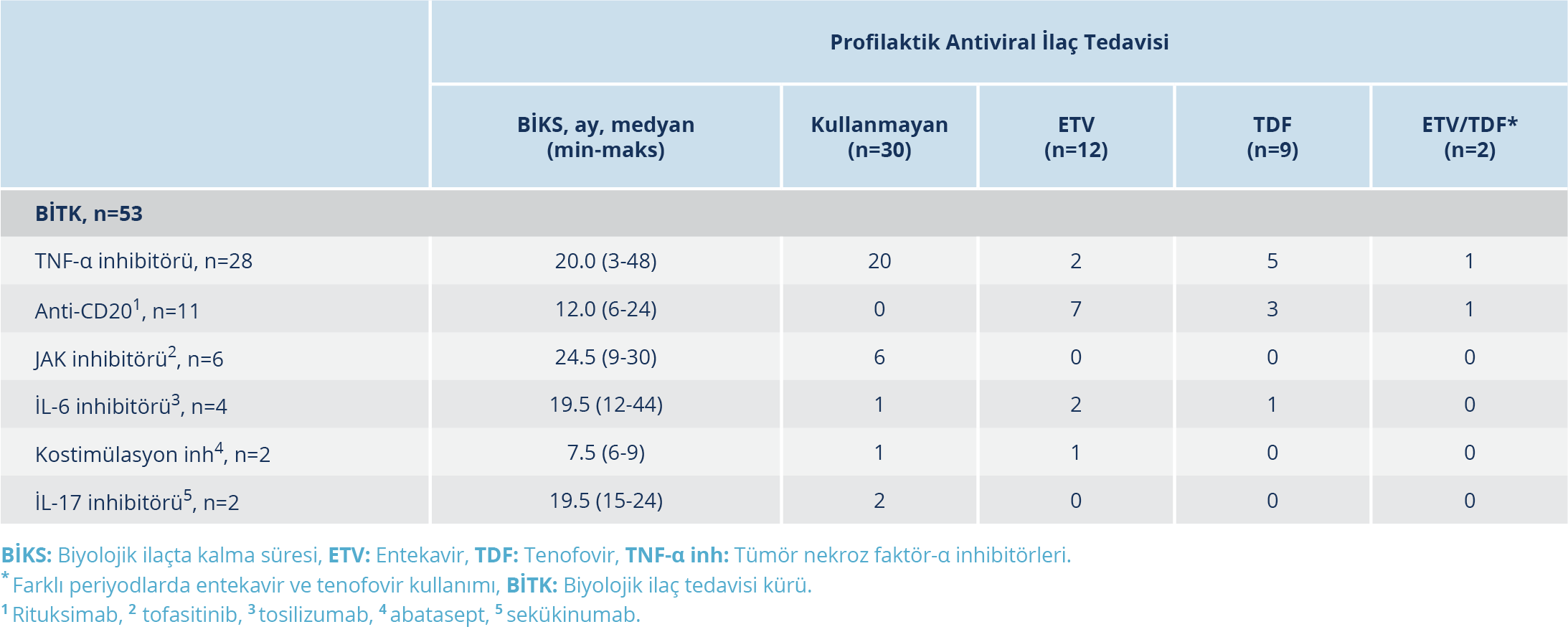
Tablo 4. Biyolojik İlaç Tedavisi Altında Olan Anti-HBc IgG-Pozitif Hastalarda Profilaktik Antiviral Kullanım Sıklıkları
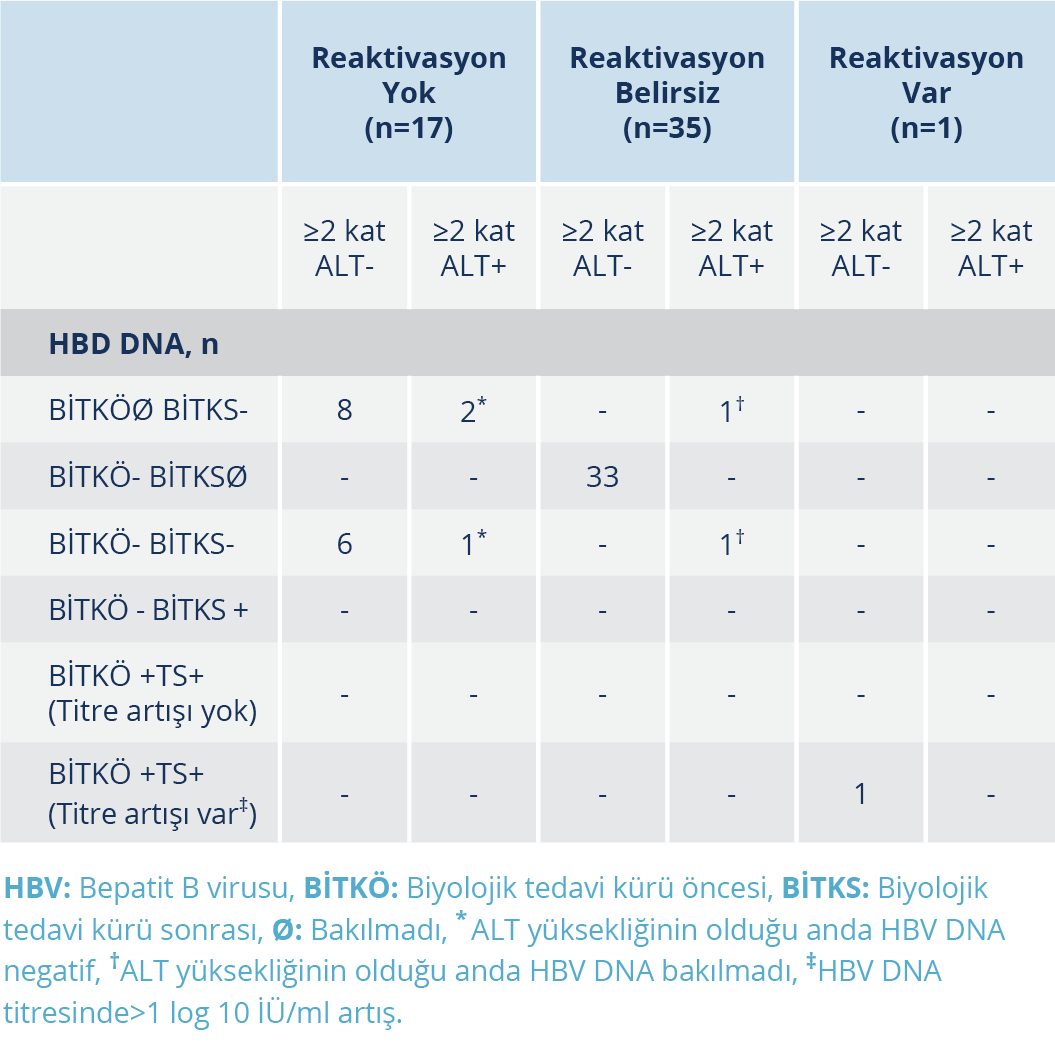
Tablo 5. Katılımcıların Biyolojik İlaç Tedavisi Kürü Öncesi ve Sonrasındaki HBV DNA Test Sonuçlarına ve Tedavi Sürecinde ALT Yüksekliğinin Var Olup Olmamasına Göre HBV Reaktivasyonunun Tespit Edildiği BİTK Sayıları
Reaktivasyonun değerlendirilmesi 275 hasta içinden 41 hastanın kullandığı toplam 53 BİTK için yapılmıştır (Şekil 1). Bu BİTK’lerde hastaların profilaktik antiviral ilaç kullanım sıklıkları Tablo 4’te görülmektedir. Elli üç BİTK’nin 23 (%43.4)’ünde profilaktik antiviral ilaç kullanımı mevcuttu. Kullanılan biyolojik ilaca göre sınıflandırıldığında profilaktik antiviral ilaç kullanımı TNF-αinhibitörü grubunda %28.6, anti-CD20 grubunda %100, JAK inhibitörü grubunda (%0), İL-6 inhibitörü grubunda %75.0, T hücre kostimülasyon inhibitörü grubunda %50, İL-17 inhibitörü grubunda %0 oranında tespit edildi.
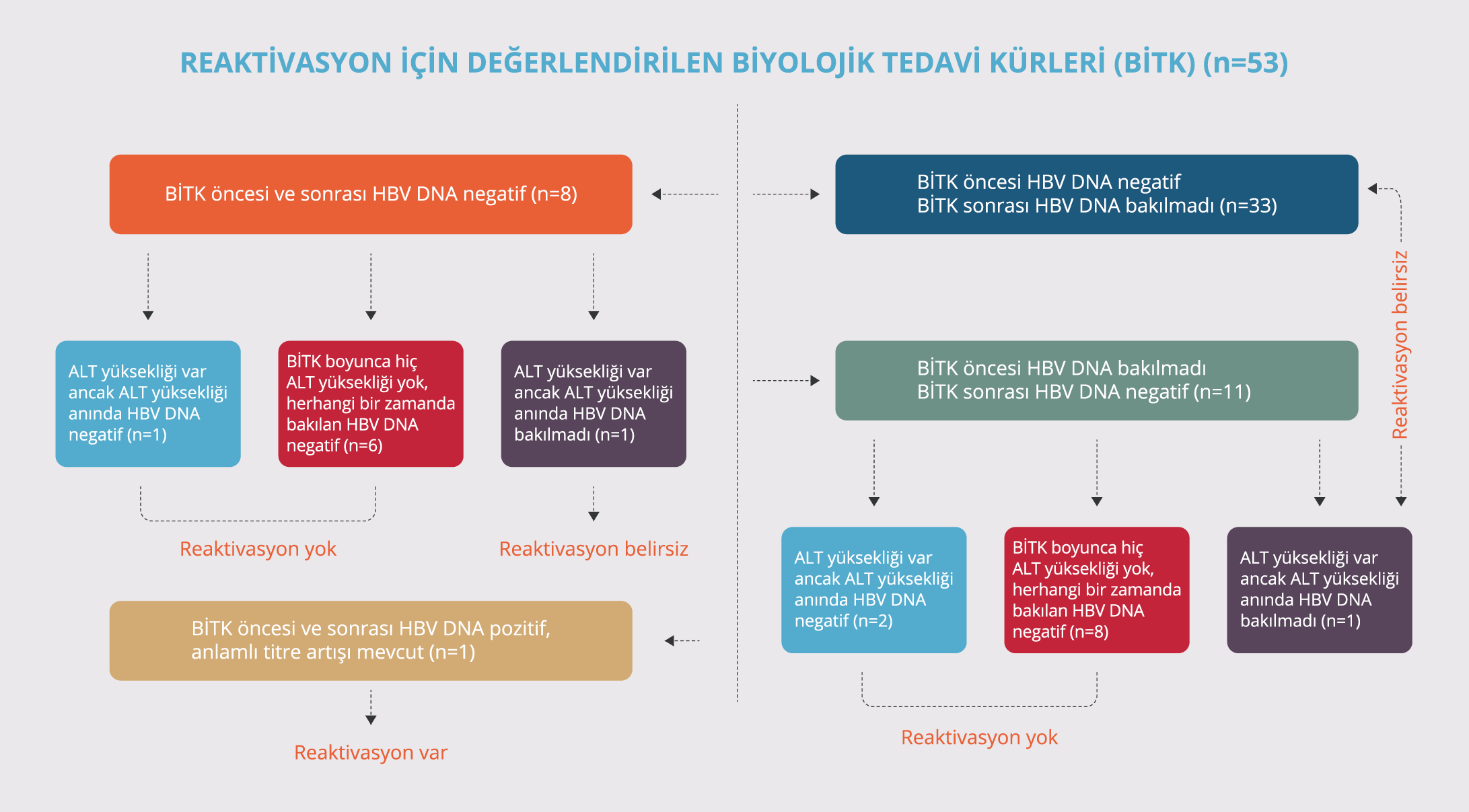
Katılımcıların biyolojik ilaç tedavisi kürü öncesi ve sonrasındaki HBV DNA test sonuçlarına ve tedavi sürecinde ALT yüksekliğinin var olup olmamasına göre HBV reaktivasyonunun tespit edildiği BİTK sayıları Tablo5 ’te gösterilmekte ve HBV reaktivasyonunun değerlendirme süreci Şekil 2’de özetlenmektedir.
a. Tedavi öncesi HBV DNA sonucu olmayıp tedavi sonrası negatif olanlar: Bu grupta değerlendirilen 11 BİTK’nin 3’ünde BİTK kullanım periyodunda ALT yüksekliği tespit edildi. Bunlardan birincisindeki olgu (hasta 9) aks-SpA tanısıyla 17 aydır infliksimab (TNF-α inhibitörü) tedavisine devam eden, serolojik alt grubu doğal bağışık olan, tedaviye başladıktan 13 ay sonra ALT’nin yüksek olduğu tespit edilen, eş zamanlı HBV DNA test sonucunun negatif olduğu ve ALT’nin kendiliğinden normale döndüğü bir olguydu. İkincisi ise (hasta33) Behçet hastalığı tanısıyla yaklaşık 36 aydır infliksimab tedavisine devam etmekte olan, BİTK boyunca 13 kere bakılan ALT’nin sadece son vizitede yüksek saptandığı, HBV serolojik alt grubunun doğal bağışık olduğu tespit edilen bir hastaydı. Bu hastada ALT yüksekliğinin olduğu dönemden farklı bir zamanda (BİTK’ye başladıktan 1 yıl sonra) bir kere HBV DNA testinin negatif olduğu ve ALT yüksekliği tespit edildikten sonrasıyla ilgili herhangi bir bilginin olmadığı tespit edildi, bu nedenle bu hasta “reaktivasyon belirsiz” grubuna dahil edildi. Üçüncüsü (hasta14) aks-SpA tanısıyla takipli bir hastaydı ve hastanın 23 aydır etanersept (TNF-α inhibitörü) BİTK’ye devam etmekte olduğu, HBV serolojik alt grubunun doğal bağışık olduğu, tedavinin 9. ayında ALT yüksekliği tespit edilip o dönemde yapılan HBV DNA test sonucunun negatif olduğu ve sonraki vizitelerde ALT düzeyinin normale geldiği tespit edilen bir olguydu.
b. HBV DNA tedavi öncesi negatif, tedavi sonrası kontrol edilmemiş olanlar: Bu grup içerisinde değerlendirilen 33 BİTK’nin hiçbirinde olguların BİTK’ye devam ettikleri süre boyunca ALT yüksekliği tespit edilmedi. Bu BİTK’ler sırasında katılımcılara ortanca 7.0 (1-14) kez ALT testinin yapıldığı tespit edildi.
c. HBV DNA tedavi öncesi ve sonrası negatif olanlar: Bu grupta değerlendirilen 8 BİTK’nin 2 tanesinde ALT yüksekliği tespit edildi. Bunlardan bir tanesinde (hasta10) hastanın PSA tanısıyla takip edilmekte olduğu, adalimumab tedavisinden sonra 2. basamak sertalizumab tedavisine geçilen hastada tedaviye başlamadan 6 ay önce yapılan HBV DNA test sonucunun negatif olduğu tespit edildi. Bu hastada tedaviye başladıktan sonra 11. ayda ALT yüksekliği tespit edildiği ve yapılan HBV DNA test sonucunun negatif olduğu, eşzamanlı yapılan üst karın ultrasonografisinde evre 2 karaciğer yağlanması tespit edildiği ve sonraki kontrollerde ALT değerlerinin normale geldiği tespit edildi. Diğer hastanın ise (hasta17) erişkin Still hastalığıyla takip altında olup HBV serolojik alt grubunun doğal bağışık olduğu ve 44 aydır tosilizumab BİTK ile takip edildiği tespit edildi. Bu hastaya toplamda 50 kere ALT testinin çalışıldığı, 6 tanesinde yükseklik tespit edildiği, ancak ALT yüksekliğinin olduğu dönemlerde hiç HBV DNA çalışılmamış olsa da BİTK süresince 2 kere HBV DNA çalışıldığı ve test sonucunun negatif tespit edildiği, hastanın ALT yüksekliklerinin her seferinde hastalık aktivasyonunun bir bulgusu olarak değerlendirildiği ve kortizon tedavisi dozunun artırılmasıyla ALT yüksekliğinin gerilediği tespit edildi.
d. HBV DNA tedavi öncesi ve sonrası pozitif olanlar: Bu grup içerisinde bir BİTK mevcuttu. Bu BİTK’nin kullanıldığı olgu erişkin Still hastalığı (hasta 3) ile takip edilen bir hastaydı ve tosilizumab tedavisi öncesinde okült hepatiti mevcut olan hastada izole anti-HBcIgG pozitifliği mevcut olup HBV DNA testi 10 İÜ/ml ölçülmüştü. Bu hastaya BİTK öncesinde entekavir tedavisinin başlandığı ancak hastanın elektronik reçete arşivi kontrol edildiğinde ilacının düzeli olarak reçete edilmediği tespit edildi. Tosilizumab tedavisinin 11. ayında bakılan HBV DNA sonucu 101.2 İÜ/ml (son vizite) ölçülen, aynı tarihte bakılan ALT sonucu normal olup bu tarihten sonrasına ait bilgi elde edilemeyen hastaya tetkik tarihinden 1 ay önce uzun süredir reçete edilmeyen entekavir ilacının reçete edildiği bilgisine elektronik reçete arşivinden ulaşıldı.
Sonuç olarak reaktivasyon olasılığının olabileceği 6 hastanın dosyaları ayrıntılı olarak incelendiğinde tosilizumab BİTK sonrası 1 hastada reaktivasyon olduğu kabul edildi, tosilizumab ve infliksimab kullanan 2 hastada da elde edilen bulgular reaktivasyonu düşündürmüyor olsa da çalışma kriterlerine göre HBV reaktivasyonu belirsizdi. Yine tedavi öncesinde HBV DNA test sonuçları negatif olan ve BİTK’ye başladıktan sonra hiç ALT yüksekliği tespit edilmeyenlerde de çalışma kriterlerine göre HBV reaktivasyonu belirsizdi.
İRDELEME
Bu çalışmadan elde ettiğimiz verilere göre biyolojik ilaç tedavisi kullanan romatoloji hastalarında HBV infeksiyonu geçirmiş olmanın bir göstergesi olan anti-HBc IgG pozitifliğini yüksek bulduk ve bunların büyük bir kısmının da doğal bağışık olduğunu tespit ettik. Kronik HBV sıklığını ise düşük oranda bulduk. Tanılara göre bir karşılaştırma yaptığımızda ise RA hastalarında aks-SpA hastalarına göre anti-HBc IgG pozitifliği yüksekti. HBV reaktivasyonu değerlendirmesinde rituksimab tedavisi dışındaki BİTK’lerde profilaktik antiviral ilaç tedavisinin sık kullanılmamış olmasına rağmen kanıtlı HBV reaktivasyonunun çok nadir olduğunu saptadık. Son yıllarda kullanılmaya başlanan tofasitinib biyolojik tedavisini kullananların hiçbirinde profilaktik antiviral ilaç kullanımı olmadığı ve sekukinumab biyolojik tedavisini kullanan hastaların birinde profilaktik antiviral ilaç kullanımı olduğu halde, bu hastaların hiçbirinde kanıtlı reaktivasyon tespit edilmedi. Rituksimab kullanan hastalarda da profilaktik antiviral ilaç tedavisinin rutin bir uygulama olarak tüm hastalarda kullanıldığı ve hiçbir hastada reaktivasyon görülmediğini saptadık Reaktivasyon olan hastanın ise başlangıçta HBV DNA pozitifliği olan ve tosilizumab tedavisine ek olarak yüksek doz kortizon tedavisi almakta olan bir hasta olduğunu, hastanın profilaktik antiviral ilaç tedavisini de düzenli kullanmadığını ve HBV reaktivasyonunun ALT düzeylerini yükseltmeyecek kadar sınırlı olduğunu gördük.
Ülkemizde biyolojik ilaç kullanan hasta kohortundaki seropozitiflik sıklıkları hakkında yeterli bilgi bulunmamaktadır, ancak ülkemizde HBV seroprevalansının araştırıldığı çok merkezli bir çalışmada normal popülasyonda anti-HBc IgG pozitifliği %30.6, HBsAg pozitifliği %4.0 bulunmuştur (4). Ülkemizde yürütülmüş diğer bazı çalışmalarda da HBsAg pozitifliği %2.5-4 aralığında tespit edilmiştir (11-13). Bizim çalışmamızda HBsAg pozitifliği ülkemizde HBV seroprevelansının araştırıldığı diğer çalışmalardaki sıklıklardan düşüktür (%0.4) ve bunun nedeni kronik HBV infeksiyonu olanlara biyolojik ilaç tedavisini başlama konusunda romatologların daha çekimser kalmasıyla açıklanabilir. Çalışmamızda tespit edilen anti-HBs ve anti-HBc IgG pozitiflik oranı ise Tözün ve arkadaşları(4)’nın çalışmasındaki verilerle benzer bulunarak Türkiye’nin genel popülasyon verileriyle uyumludur. Çalışmamızda anti-HBc IgG pozitiflik oranı RA hastalarında aks-SpA hastalarından yüksek bulunmuştur. Bu konuyla ilgili yeterli literatür bilgisi olmamakla birlikte ülkemizde yürütülmüş olan çok merkezli bir çalışmada HBsAg pozitifliği RA hastalarında ankilozan spondilit hastalarından farklı bulunmamıştır (14). Kronik HBV infeksiyonunun bir göstergesi olan HBsAg pozitifliğiyle HBV infeksiyonunu geçirme sıklığı (anti-HBc IgG pozitifliği) birebir ilişkili olmayabilir ve HBV infeksiyonunun kronikleşmesini etkileyen pek çok değişken bulunmaktadır. Bu yüzden Yılmaz ve arkadaşları (14)’nın çalışmasında RA hastalarıyla ankilozan spondilit hastaları arasında HBsAg sıklıkları farklı bulunmamış olsa da geçirilmiş infeksiyon sıklıkları farklı olabilir, ancak bu çalışmada bu konu hakkında bilgi bulunmamaktadır. Biyolojik tedavi kullanan RA hastalarıyla aks-SpA hastaları arasında bazı klinik farklar bulunmaktadır. RA hastalarında en az 3 hastalığı modifiye edici ilaca direnç durumunda biyolojik tedavilere geçilmektedir. Bu yüzden bu hastalar genellikle uzun yıllardır biyolojik ilaçlar dışındaki ilaçlarla takip edilen, RA hastalığının doğası gereği çoğunlukla periferik eklemlerinde dirençli kronik artriti olup eklem içi injeksiyonlar gibi mükerrer girişimsel işlemlerin sıklıkla uygulanmış olduğu hastalardır. Bu tarz uygulamaların HBV’nin endemik olduğu ülkemizde HBV’nin bulaşma riskini artırması muhtemeldir. Aks-SpA hastalarında ise biyolojik ilaçlar genellikle kortizon olmayan yangı giderici ilaçlara dirençli hastalarda 2. basamak tedavi olarak kullanıldığı için, bu grup hastaların klinik takip süreleri genellikle daha kısadır ve aks-SpA hastalığının doğası gereği bu hastalarda periferik eklem tutulumu nadirdir. Bu nedenle eklem içi kortizon injeksiyonu gibi girişimsel işlemler bu hasta grubunda daha seyrek olarak uygulanmaktadır. Çalışmamızda RA hastalarında geçirilmiş HBV infeksiyonunun sıklığının aks-SpA hastalarından daha yüksek çıkmış olmasının nedeni, bu iki hasta grubunun genel klinik özellikleriyle ilgili olabilir. Bu konuyla ilgili literatür verisi yoktur ve bu konunun etraflıca araştırılmasına ihtiyaç vardır.
Çalışmamızda TNF-αinhibitörü tedavisi kullanmakta olan hastaların büyük bir bölümü profilaktik antiviral ilaç tedavisi kullanmamaktaydı ve TNF-α inhibitörü tedavisi kullananların hiçbirinde kanıtlı reaktivasyon tespit edilmedi. Her ne kadar güncel önerilerde HBcIgG pozitif hastalarda TNF-α inhibitörü tedavisinin kullanımı reaktivasyon için orta riskli kabul ediliyor ve bu gruba da profilaktik anti-antiviral tedavi öneriliyor olsa da bu grup hastalara profilaktik tedavi verilmesi konusu halen tartışmalıdır ve literatürde bu hastalarda TNF-α inhibitörü tedavisinin riskli olmadığını gösteren bilgiler bulunmaktadır. Örneğin Chiu ve arkadaşları(15)’nın çalışmasında yaklaşık 9 yıllık bir süre içerisinde ALT değerlerinin yükselme sıklıkları değerlendirildiğinde TNF-α inhibitörü tedavisinin kullanıldığı infekte olmamış hastalarla anti-HBcIgG pozitif hastalar arasında fark saptanmamıştır. Yine Lan ve arkadaşları(16)’nın çalışmasında da beraberinde profilaktik antiviral tedavinin verilmediği ve TNF-α inhibitörü tedavisinin kullanıldığı, anti-HBc IgG pozitif 68 hastanın sadece 1’nde reaktivasyon görülmüş, bu hastanın da tedavi öncesinde HBV DNA testi pozitif olan bir hasta olduğu tespit edilmiştir. Çalışmamızda anti-HBcIgG testi pozitif olan ve rituksimab tedavisi kullanılmış hastaların hepsi profilaktik entekavir veya tenofovir antiviral tedavisi almışlardı. B hücre deplesyonu yapan ilaçların geçirilmiş HBV infeksiyonunun varlığında HBsAg pozitifliği olmasa dahi reaktivasyon riskini arttırdığı iyi bilinen bir durumdur (17). Nitekim HBsAg-negatif, anti-HBcIgG-pozitif lenfoma tanılı hastalarda rituksimab tedavisini takiben 2 yıllık kümülatif HBV reaktivasyonu riski %41.5 bulunmuştur. Bu grup hastalarda kullanılacak olan antiviral ilaç da önemlidir. Huang ve arkadaşları(18)’nın çalışmasında rituksimab içeren kemoterapi alan B hücre lenfomalı 121 hastanın değerlendirilmesinde, entekavir profilaktik tedavisi kullananlarda HBV reaktivasyonu 61 hastanın 3 (%6.6)’nde görülürken, lamuvidin grubunda 60 hastanın 18 (%30.0)’inde reaktivasyon tespit edilmiştir. Bizim çalışmamızdaki verilere göre romatoloji kliniğinde rituksimab tedavisiyle takip edilmekte olan hastalarda entekavir veya tenofovir profilaktik antiviral tedavisinin rutin bir uygulama olarak tüm hastalara titizlikle uygulanmış olduğu ve hiçbir hastada reaktivasyon olmadığı tespit edilmiştir. Bulgularımız literatür verileriyle uyumludur.
Çalışmamızda reaktivasyon değerlendirmesi 53 BİTK’de yapılmıştır. Bunların büyük bir bölümünü TNF-α inhibitörü tedavisi grubu ilaçlar oluşturmaktadır. Bu ilaç grubunu kullanan hastaların yaklaşık dörtte üçünde profilaktik antiviral ilaç kullanılmamış ve tedavi öncesinde HBV DNA testleri negatif bulunmuştu. Çalışmamızda TNF-α inhibitörü tedavisi kullanan hastaların hiçbirinde kanıtlı reaktivasyon tespit edilmemiş olup, bulgularımız literatür verisiyle uyumludur. Nitekim Lan ve arkadaşları (16)’nın çalışmasında anti-HBcIGg-pozitif olup HBV DNA testi negatif olan ve antiviral profilaktik tedavi verilmemiş 64 hastanın hiçbirinde TNF-α inhibitörü tedavisini takiben reaktivasyon olmadığı tespit edilmiştir.
Literatürde tofasitinib kullanımına bağlı HBV reaktivasyonuna yönelik bilgiler yetersizdir. Bir editöre mektup yazısında tofasitinib kullanmakta olan, profilaktik antiviral ilaç tedavisinin kullanılmadığı ve anti-HBc IgG testi pozitif olan 75 hastada antikor varlığından bağımsız olarak hiç reaktivasyon görülmediği rapor edilmiştir (19). Bu yazının dışında tofasitinib kullananlarda HBV reaktivasyonuna yönelik literatür verisi bulunmamaktadır. Çalışmamızda anti-HBc IgG testi pozitif olup tofasitinib tedavisini kullanan 6 hastanın hepsinde tedavi öncesi HBV DNA testi sonuçları negatif bulunmuştur ve bu hastaların hiçbirinde tedavi sonrası HBV DNA sonucu bakılmamış olsa da ALT yüksekliği veya reaktivasyonu düşündürür bulguya rastlanmamıştır. Dolayısıyla bulgularımız literatür verisiyle uyumlu bulunmuştur. Literatürde anti-HBcIgG-pozitif olan ve sekukinumab kullanan hastalarda HBV reaktivasyonuna yönelik bilgi de neredeyse yoktur. Bizim tespit ettiğimiz kadarıyla bir editöre mektup yazısında 4 vaka serisi rapor edilmiştir (20). Bu olgulardan 2’si HBsAg testi pozitif olan ve geçirilmiş HBV infeksiyonu olan PSA hastalarıdır ve biri lamuvidin, biri entekavir, biri de tenofovir profilaksisi kullanmış; anti-HBcIgG-pozitif, HBsAg-negatif bir hastada ise hiç profilaktik antiviral ilaç tedavisi kullanılmamış ve hastaların hiçbirinde reaktivasyon tespit edilmemiştir. Bizim çalışmamızda da anti-HBc IgG testi pozitif olan 2 olgumuzda tedavi öncesi HBV DNA testleri negatif olup birinde tedavi sonrası HBV DNA testi negatif olup birinde de HBV DNA bakılamamış ve ikisinde de takipleri süresince ALT yüksekliği tespit edilmeyerek reaktivasyon bulgusuna rastlanmamıştır.
Literatürde geçirilmiş HBV infeksiyonu olanlarda tosilizumab tedavisi sonrasında reaktivasyon gelişimiyle ilgili de sınırlı veri bulunmaktadır. RA hastalarında tosilizumab tedavisinden kısa süre sonra HBV reaktivasyonunun değerlendirildiği bir çalışmada anti-HBc IgG-pozitif, HBsAg-negatif hastalarda başlangıçta HBV DNA-negatif olan 41 hastanın hiçbirinde 3. ayda reaktivasyon tespit edilmemiştir (21), yine Ahn ve arkadaşları (22)’nın çalışmasında da aynı koşullardaki 15 hastanın hiçbirinde reaktivasyon tespit edilmemiştir. Sonneveld ve arkadaşları (23) tosilizumabla ilişkili HBV reaktivasyonunun olduğu ve ani gelişen karaciğer yetmezliği sonucunda karaciğer nakline ihtiyacı olan bir olgu sunmuşlardır. Bizim çalışmamızda da tosilizumab kullanmakta olan 4 hastanın 1 tanesinde tosilizumab tedavisinden sonra reaktivasyon tespit edilmiş, bir hastada da reaktivasyon dışlanamamıştır. Her iki hastanın da erişkin Still hastalığıyla takip edilmekte olan ve yüksek doz kortizon tedavisine ek olarak tosilizumab tedavisinin kullanıldığı hastalar olduğu ve yüksek doz kortizon tedavisinin reaktivasyon yapabilme potansiyelinin olduğu göz önünde bulundurulursa, çalışmamızda tespit edilen HBV reaktivasyonu üzerinde tosilizumab tedavisinin ne kadar etkisinin olduğu ayırt edilemez. Literatürde bu konuyla ilgili az veri olması ve ciddi reaktivasyonun geliştiği bir olgunun rapor edilmiş olması nedeniyle tosilizumab tedavisi tofasitinib ve sekukinumab tedavilerinden farklı olarak reaktivasyon riskini daha fazla artırıyor olabilir. Bu konunun aydınlatılması için daha geniş kapsamlı prospektif çalışmalara ihtiyaç vardır.
Elde ettiğimiz bulgulara dayanarak anti-HBcIg-pozitif, HBsAg-negatif hastalarda tofasitinib veya sekukinumab tedavisine bağlı önemli bir reaktivasyon riski görünmemekle birlikte, bu ilaçları yoğun olarak kullanan hekimlerin nasıl bir yol izleyeceğiyle ilgili önerilerin oluşabilmesi için daha çok hastanın verilerinin araştırıldığı çalışmalara ihtiyaç vardır.
Bu çalışmada reaktivasyon taraması yapılırken BİTK öncesinde HBV DNA testi negatif olup, BİTK sonrası HBV DNA testi yapılmayanlar da dahil edildiler. Her ne kadar bu hastaların hiçbirinde ALT yüksekliği tespit edilmemiş olsa bile, bazı hastalarda ALT normal olup HBV DNA testinde pozitiflik gelişmiş olabilir. Bu yüzden tarama stratejimiz doğrultusunda sub-klinik reaktivasyonun gelişmiş olduğu bazı hastalar tespit edilmemiş olabilir. Bu çalışmanın tarama stratejisinin yeterince hassas olmaması çalışmanın en önemli eksikliğidir. Hastaların antiviral kullanımı elektronik reçete arşivinden ilacın reçete edilip edilmediğine göre yapıldı. Bazı hastalarda ilaçların elle yazılmış olabileceği ve bazı hastalarında ilaç reçete edilmiş olmasına rağmen ilacı kullanmamış olabilecekleri göz ardı edilemez. Bu çalışmada bir hastada 2. veya 3. basamak BİTK’yı kullanıldı ise aynı hastada reaktivasyon birden fazla kez değerlendirilmiş oldu. İkinci ve 3. basamak ilaçların etkisi değerlendirilirken birinci ve ikinci basamak ilaçların uzamış etkilerinin göz önünde bulundurulmamış olması da çalışmanın eksikliklerindendir. Her ne kadar bu çalışmada değerlendirilen BİTK’lerin bazıları çok sık kullanılmayan ilaçlar olsa da, bu çalışmada birden fazla ilaç grubu değerlendirilmiş ve her bir ilaç başına değerlendirilen hasta sayısının, dolayısıyla örneklem büyüklüğünün sınırlı olması çalışmanın gücünü düşürmüştür.
Sonuç olarak, ülkemizde normal popülasyonda görüldüğü gibi biyolojik tedavi kullanılan romatoloji hastalarında da geçirilmiş HBV infeksiyonunun sıklığı yüksektir. Anti-HBcIgG-pozitif hastalarda rituksimab dışındaki biyolojik ilaçlarda antiviral profilaktik tedavi seyrek kullanılmış olmasına rağmen reaktivasyon çok nadirdir. Yeni biyolojik ajanlardan olan tofasitinib ve sekukinumab tedavisi alanlarda reaktivasyon riski düşük, tosilizumab tedavisinin kullanıldığı hastalarda ise reaktivasyon riski artmış olabilir.
Çıkar çatışması
Yazarlar, herhangi bir çıkar çatışması bildirmemiştir.
Referanslar
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017; 67(2): 370-98.
- Schweitzer A, Horn J, Mikolajczyk RT, Krause G, Ott JJ. Estimations of worldwide prevalence of chronic hepatitis B virus infection: A systematic review of data published between 1965 and 2013. Lancet. 2015; 386(10003): 1546-55.
- Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: A systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012; 380(9859): 2095-128.
- Tozun N, Ozdogan O, Cakaloglu Y, et al. Seroprevalence of hepatitis B and C virus infections and risk factors in Turkey: A fieldwork TURHEP study. Clin Microbiol Infect. 2015; 21(11): 1020-6.
- Rehermann B, Ferrari C, Pasquinelli C, Chisari FV. The hepatitis B virus persists for decades after patients’ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med. 1996; 2(10): 1104-8.
- Staren ED, Essner R, Economou JS. Overview of biological response modifiers. Semin Surg Oncol. 1989; 5(6): 379-84.
- Ramiro S, Gaujoux-Viala C, Nam JL, et al. Safety of synthetic and biological DMARDs: A systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis. 2014; 73(3): 529-35.
- Karadağ Ö, Kaşifoğlu T, Özer B, et al.Romatolojik hastalarda biyolojik ilaç kullanımı öncesi (viral) hepatit tarama kılavuzu. RAED Derg. 2015; 7(1):28–32.
- Yeo W, Chan PK, Ho WM, et al. Lamivudine for the prevention of hepatitis B virus reactivation in hepatitis B s-antigen seropositive cancer patients undergoing cytotoxic chemotherapy. J Clin Oncol. 2004; 22(5): 927-34.
- Hui CK, Cheung WW, Au WY, et al. Hepatitis B reactivation after withdrawal of pre-emptive lamivudine in patients with haematological malignancy on completion of cytotoxic chemotherapy. Gut. 2005; 54(11): 1597-603.
- Igde FA, Taskin H, Igde M, Yazici Z, Atilla A. Where we are in the fight against hepatitis B infection: Trends in hepatitis B virus seroprevalence in Black Sea Region of Turkey. Niger J Clin Pract. 2018; 21(1): 87-92.
- Akcam FZ, Uskun E, Avsar K, Songur Y. Hepatitis B virus and hepatitis C virus seroprevalence in rural areas of the southwestern region of Turkey. Int J Infect Dis. 2009; 13(2): 274-84.
- Altay T, Uskun E, Akcam FZ. Seroprevalence of hepatitis B surface antigen and its correlation with risk factors among new recruits in Turkey. Braz J Infect Dis. 2012; 16(4): 339-44.
- Yılmaz N, Karadağ Ö, Kimyon G, et al. Prevalence of hepatitis B and C infections in rheumatoid arthritis and ankylosing spondylitis: A multicenter countrywide study. Eur J Rheumatol. 2014; 1(2): 51-4.
- Chiu YM, Lai MS, Chan KA. Commensurate incidence and outcomes of liver enzyme elevation between anti-tumor necrosis factor users with or without prior hepatitis B virus infections. PLoS One. 2018; 13(4): e0196210.
- Lan JL, Chen YM, Hsieh TY, et al. Kinetics of viral loads and risk of hepatitis B virus reactivation in hepatitis B core antibody-positive rheumatoid arthritis patients undergoing anti-tumour necrosis factor alpha therapy. Ann Rheum Dis. 2011; 70(10): 1719-25.
- Di Bisceglie AM, Lok AS, Martin P, Terrault N, Perrillo RP, Hoofnagle JH. Recent US Food and Drug Administration warnings on hepatitis B reactivation with immune-suppressing and anticancer drugs: Just the tip of the iceberg? Hepatology. 2015; 61(2): 703-11.
- Huang H, Li X, Zhu J, et al. Entecavir vs lamivudine for prevention of hepatitis B virus reactivation among patients with untreated diffuse large B-cell lymphoma receiving R-CHOP chemotherapy: A randomized clinical trial. JAMA. 2014; 312(23): 2521-30.
- Chen YM, Huang WN, Wu YD, et al. Reactivation of hepatitis B virus infection in patients with rheumatoid arthritis receiving tofacitinib: A real-world study. Ann Rheum Dis. 2018; 77(5): 780-2.
- Moneva-Leniz LM, Sahuquillo-Torralba A, Vila-Payeras A, Mateu-Puchades A. [Risk of hepatitis B Virus reactivation in patients on secukinumab for psoriasis: A series of 4 cases]. Actas Dermosifiliogr. 2020; 111(7): 613-14.
- Chen LF, Mo YQ, Jing J, Ma JD, Zheng DH, Dai L. Short-course tocilizumab increases risk of hepatitis B virus reactivation in patients with rheumatoid arthritis: A prospective clinical observation. Int J Rheum Dis. 2017; 20(7): 859-69.
- Ahn SS, Jung SM, Song JJ, Park YB, Park JY, Lee SW. Safety of tocilizumab in rheumatoid arthritis patients with resolved hepatitis B virus infection: Data from real-world experience. Yonsei Med J. 2018; 59(3): 452-6.
- Sonneveld MJ, Murad SD, van der Eijk AA, de Man RA. Fulminant liver failure due to hepatitis B reactivation during treatment with tocilizumab. ACG Case Rep J. 2019; 6(12): e00243.