En Çok Okunanlar
Özet
Amaç: HIV infeksiyonu kemik mikro mimarisini olumsuz etkileyerek düşük kemik mineral yoğunluğu (KMY)’na yol açabilir. Bu çalışmada, 50 yaş altındaki HIV ile yaşayan bireylerin KMY’si HIV negatif kontrol grubuyla karşılaştırıldı ve antiretroviral tedavi (ART)’nin KMY üzerindeki etkisi değerlendirildi.
Yöntemler: Aralık 2021–Mart 2022 tarihleri arasında Ümraniye Eğitim ve Araştırma Hastanesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği’nde yürütülen bu kesitsel olgu-kontrol çalışmasında, 18–49 yaş aralığında 72 HIV pozitif ve 44 HIV negatif bireyin tıbbi kayıtları retrospektif olarak incelendi. Kemik mineral yoğunluğu ölçümleri çift enerjili X-ışını absorbsiyometrisi (DEXA) yöntemiyle değerlendirildi.
Bulgular: HIV ile yaşayan bireylerde düşük KMY prevalansı %16.7 iken HIV negatif bireylerde bu oran %6.8 olarak bulundu. Lomber vertebra T- ve Z-skorları HIV pozitif bireylerde anlamlı düzeyde daha düşüktü (p<0.05). Üç yıldan uzun süredir HIV tanısı olan ve ART kullanan bireylerde femur boynu Z-skorları daha düşüktü (p<0.05). Sigara kullanımı ve düşük vücut kitle indeksi KMY azalmasıyla ilişkili bulundu (p<0.05). CD4+ T hücre sayısı, viral yük, D vitamini ve kalsiyum düzeyleri ile KMY arasında anlamlı düzeyde bir ilişki saptanmadı.
Sonuç: HIV ile yaşayan 50 yaş altı bireyler, HIV negatif popülasyona kıyasla daha düşük KMY’ye sahiptir. Bulgular, HIV infeksiyonunun genç yaşta da KMY azalmasına neden olabileceğini göstermektedir. Bu nedenle, 50 yaş altı ve KMY düşürücü risk faktörleri bulunan HIV pozitif bireylerde DEXA taraması yapılması uygun olacaktır. Bulguların doğrulanması için daha geniş örneklemli ve çok merkezli çalışmalara gereksinim vardır.
GİRİŞ
Metabolik bir kemik hastalığı olan osteoporoz, kemik mikromimarisinin bozulmasına neden olarak kırık duyarlılığının artmasına ve düşük kemik kütlesine yol açar (1). Türkiye’de 50 Yaş Üstü Nüfusta Osteoporotik Kırıkların ve Osteoporozun Prevalansı (FRACTURK) çalışmasının sonuçlarına göre; 50 yaş ve üzerindeki bireylerden erkeklerin %7.5’inde, kadınların %12.9’unda osteoporoz görülmektedir (2).
HIV infeksiyonunda, virusun kendisi ve antiretroviral tedavi (ART) kemik kaybına katkıda bulunur. Gp120 gibi viral proteinler kemik kaybının artmasında rol oynar (3). Kronik bağışıklık aktivasyonu ve inflamasyon, osteoporozun başlangıcını hızlandırır (4-6). HIV infeksiyonu ikincil osteoporozun nedenlerinden biri olarak kabul edilir. Bunun yanında, yaşam tarzıyla ilişkili bazı faktörler de ikincil osteoporoza yatkınlık yaratabilir. Bunlar arasında tütün kullanımı (aktif veya pasif içicilik), düşük kalsiyum alımı, yetersiz fiziksel aktivite, aşırı tuz tüketimi, D vitamini eksikliği, alkol kullanımı ve aşırı zayıflık yer almaktadır (1).
Antiretroviral tedavi (ART) uygulanan bireylerde osteopeni/osteoporoz prevalansını kontrol gruplarıyla karşılaştıran bir meta-analizde, ART alan bireylerde osteopeni/osteoporoz sıklığının iki kat daha fazla olduğu bildirilmiştir. Ayrıca ART rejiminde yer alan etken maddelerin kemik sağlığını olumsuz etkilediği de doğrulanmıştır (7). Yapılan çalışmalar, kemik mineral yoğunluğu (KMY)’nun iki yıllık ART’den sonra %2–6 oranında azaldığını göstermektedir (8,9).
Osteopeni/osteoporoz, çift enerjili X-ışını absorpsiyometrisi (dual-energy X-ray absorptiometry, DEXA) ile saptanabilen, yönetilebilir bir komorbiditedir. HIV ile yaşayan bireylerde DEXA taramasına yönelik öneriler, kılavuzlara göre farklılık göstermektedir. Türk Endokrinoloji ve Metabolizma Derneği, HIV infeksiyonunu ikincil osteoporozun bir nedeni olarak kabul etmekte ve bu nedenle 50 yaşın altındaki bireylerin ikincil osteoporoz açısından taranmasını önermektedir (1). Buna karşılık, HIV pozitif bireylere yönelik öneriler sunan Avrupa AIDS Klinik Derneği (European AIDS Clinical Society, EACS), 50 yaş üstü erkeklerin ve menopoz sonrası kadınların taranmasını önermektedir (10). Öte yanda EACS, HIV pozitif 50 yaş altındaki kişilere tarama yapılmasını önermemekle birlikte yapılan çalışmalar HIV’in 50 yaş altındaki hastalarda dahi ikincil osteoporoza yol açarak genel popülasyona göre daha düşük kemik mineral yoğunluğuna neden olduğunu desteklemektedir (11,12,13,14). Literatürdeki birçok çalışma, HIV pozitif ve özellikle 50 yaş üstünde olan bireylerde kemik kaybının arttığını göstermiştir (15); 50 yaş altı bireylere ilişkin veriler sınırlıdır. Çift enerjili X-ışını absorpsiyometrisi ölçümlerinde düşük değerler HIV negatif bireylerde de görülebildiği gibi yaşam tarzı ve hormonal faktörler de bu bireylerin kemik sağlığını etkileyebilir (16).
Bu çalışma, 50 yaş altı bireylerin kemik sağlığıyla ilgili olarak literatüre katkı sağlamayı, HIV pozitif 50 yaş altı bireyleri benzer özelliklere sahip bir kontrol grubuyla karşılaştırmayı ve bu popülasyonda DEXA ölçümlerinin yorumlanmasına ilişkin kritik noktaları vurgulamayı amaçlamaktadır.
YÖNTEMLER
Çalışma Tasarımı ve Veri Toplama
Aralık 2021 – Mart 2022 tarihleri arasında Ümraniye Eğitim ve Araştırma Hastanesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği’nde yürütülen bu kesitsel olgu-kontrol çalışmasına, 18–49 yaş aralığında olan 72 HIV ile yaşayan birey ve 44 HIV negatif birey dahil edildi. Katılımcıların demografik verileri, alışkanlıkları, tıbbi öyküleri ve laboratuvar sonuçları hasta kayıtlarından elde edildi. HIV ile yaşayan bireylerin rutin takipleri sırasında yapılmış kemik dansitometri ölçümleri retrospektif olarak incelendi. Kontrol grubuna ait veriler ise hastane bilgi yönetim sisteminden retrospektif olarak elde edildi.
Bu çalışma için Ümraniye Eğitim ve Araştırma Hastanesi Etik Kurulu’ndan 10 Şubat 2022 tarih ve 38 karar numarasıyla onay alındı.
Dahil Etme ve Hariç Tutma Kriterleri
Bu çalışmada, polikliniğimizde takip edilen kemik dansitometri taraması yapılmış, HIV tanılı ve HIV infeksiyonu olmayan bireyler değerlendirildi.
Hipertiroidizm, hiperparatiroidizm, hipogonadizm tanısı olanlar, glukokortikoid kullananlar, 18 yaş altı ve 50 yaş üstündekiler, postmenopozal kadınlar ve HIV infeksiyonu tanısı öncesinde osteopeni veya osteoporozu bulunanlar çalışmaya dahil edilmedi.
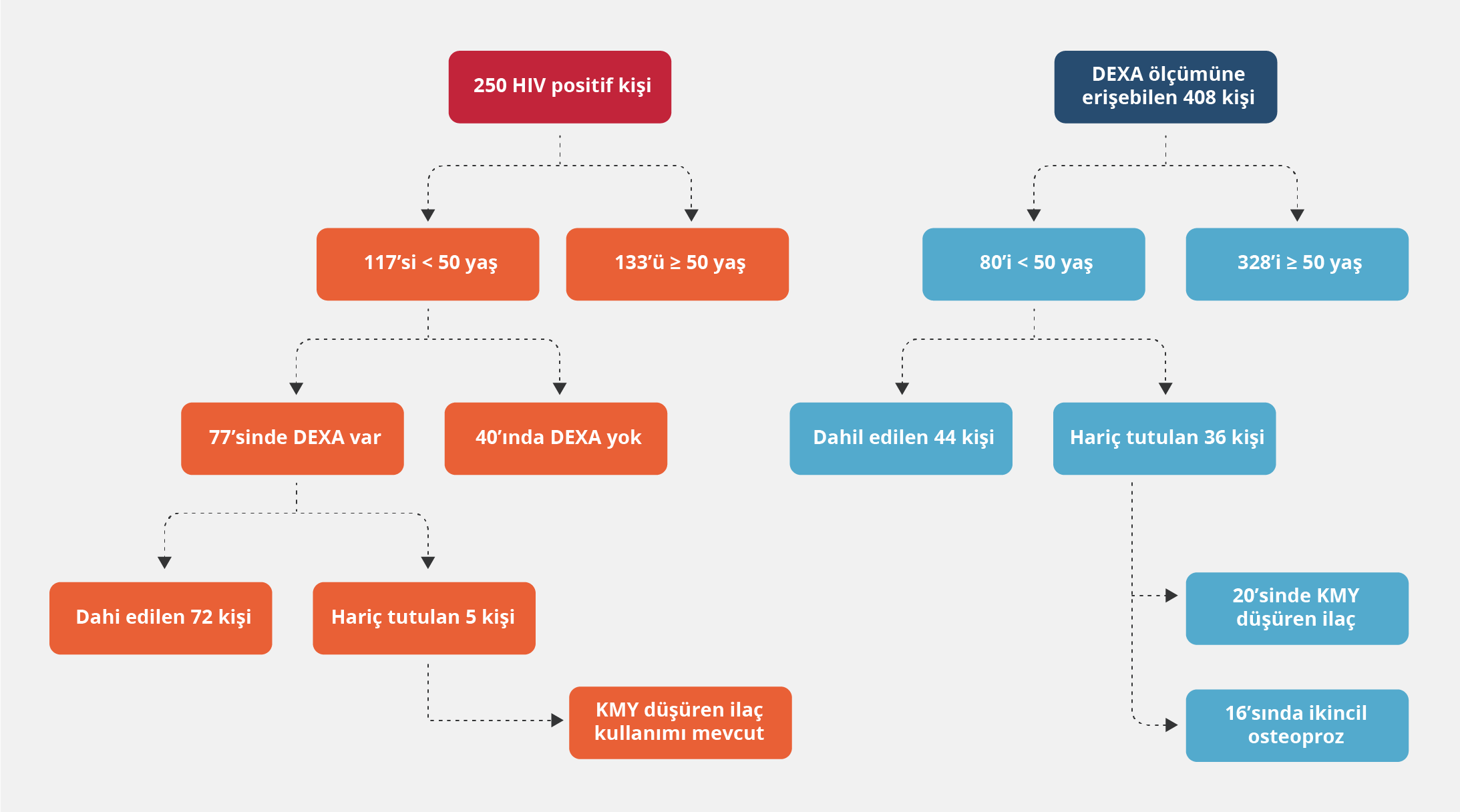
Kliniğimizde takip edilen 250 HIV pozitif birey değerlendirildi; 50 yaş üstü olanlar çalışmadan çıkarıldı ve 77 kişinin kemik dansitometri sonuçlarına ulaşıldı. Beş olgu KMY düşürücü ilaç kullandıkları için hariç tutuldu ve böylece çalışmada toplam 72 HIV pozitif birey analiz edildi.
Kontrol grubu olarak, çalışma döneminde hastanemizde kemik dansitometri ölçümü yapılan ve HIV infeksiyonu olmayan 408 birey değerlendirildi. Hariç tutma kriterleri dikkate alınarak geriye kalan 44 kişi çalışmaya dahil edildi. Retrospektif inceleme sonucunda, bu kişilerin kemik dansitometri ölçümlerini, kendi istekleriyle veya kemik mineral yoğunluğunu düşürebileceği bilinen ilaçlara başlamadan önce tarama amacıyla yaptırdıkları saptandı (Şekil 1).
İstatistiksel Analiz
Toplanan verilerin analizi için IBM SPSS, sürüm 23.0 (IBM Corp., Armonk, NY, ABD) yazılımı kullanıldı. Verilerin dağılımı Kolmogorov-Smirnov testi ile değerlendirildi. Kategorik değişkenler sayı (n) ve yüzde (%) olarak, sürekli değişkenler ise medyan (minimum–maksimum) değerleriyle sunuldu. Normal dağılım gösteren değişkenlerin grup karşılaştırmalarında bağımsız örneklem t testi, normal dağılım göstermeyen değişkenlerde ise Mann-Whitney U testi kullanıldı. Ki-kare testi kategorik değişkenlerin karşılaştırılmasında, Pearson korelasyon analizi ise sürekli değişkenler arasındaki ilişkilerin değerlendirilmesinde uygulandı. İstatistiksel anlamlılık düzeyi p<0.05 olarak kabul edildi.
BULGULAR
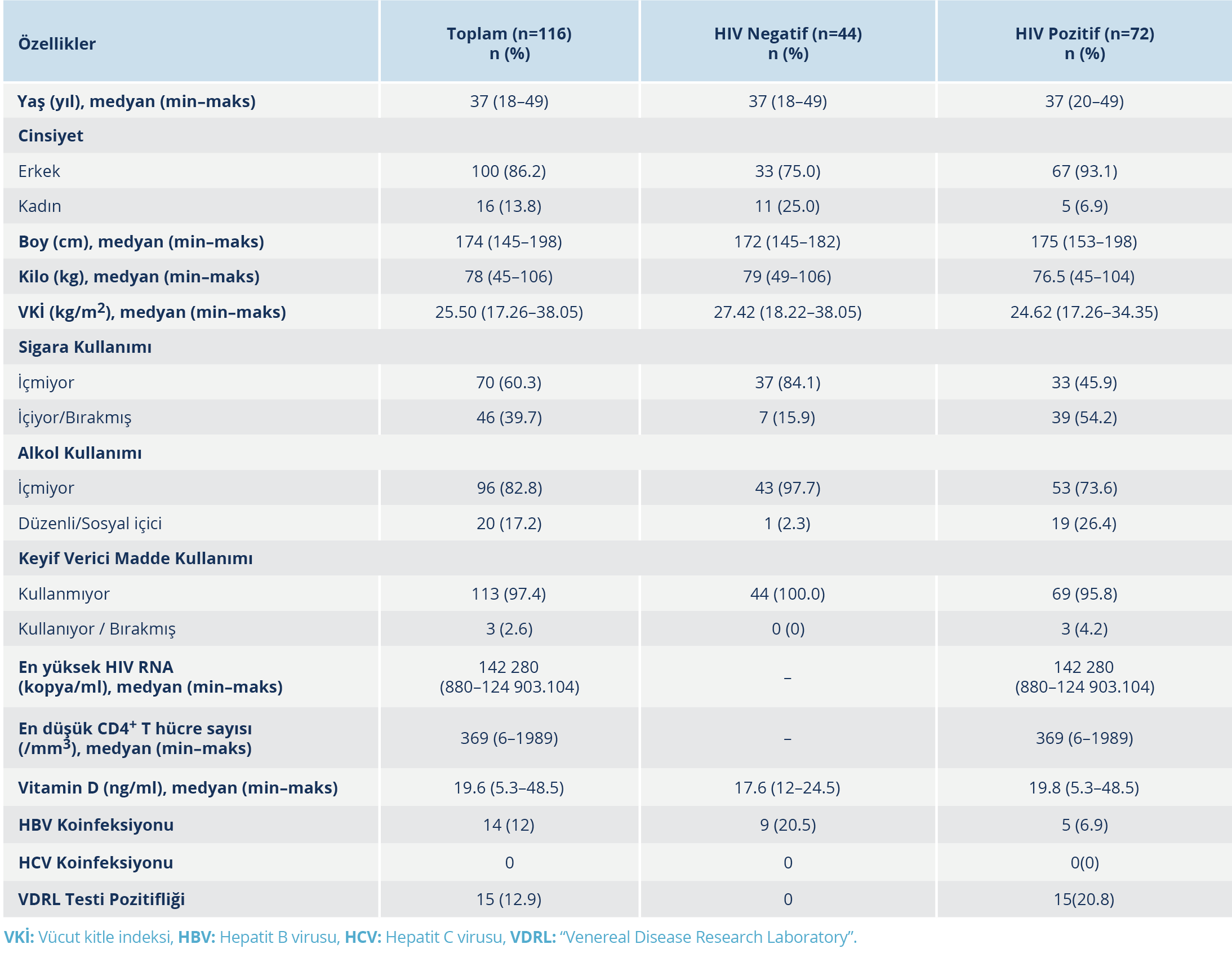
Yaşları 18–49 arasında değişen toplam 116 kişi (72 HIV ile yaşayan, 44 HIV negatif) çalışmaya dahil edildi. HIV ile yaşayan bireylerin medyan en yüksek HIV RNA düzeyleri, medyan CD4+ T hücre sayıları ve koinfeksiyon durumları Tablo 1’de sunuldu. Her iki grupta da D vitamini düzeyleri normalin altında idi (Tablo 1).
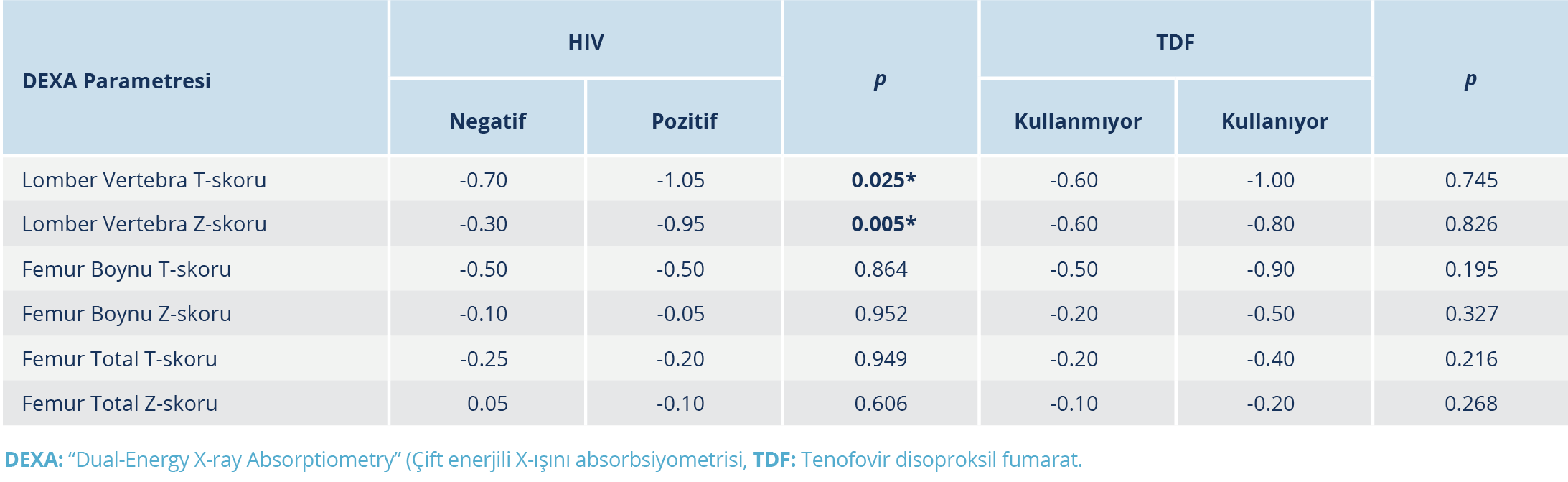
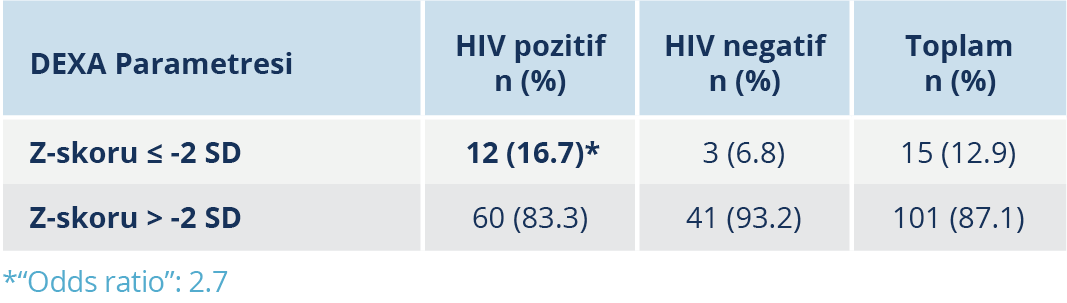
Yapılan DEXA ölçüm sonuçlarında T-skorlarına göre osteopeni/osteoporoz prevalansı HIV ile yaşayan bireylerde %45.5 ve HIV negatif bireylerde %54.2 olarak saptandı. Bu yaş grubunda değerlendirilmesi önerilen, yaşa göre ayarlanmış Z-skorlarına göre düşük KMY prevalansı HIV ile yaşayan bireylerde %16.7, HIV negatif bireylerde %6.8 idi. HIV negatif bireylerin ortalama lomber vertebra T- ve Z- skorları, HIV ile yaşayan bireylere göre anlamlı düzeyde daha yüksekti (p<0.05). Diğer ölçüm noktalarında DEXA sonuçları açısından anlamlı bir fark bulunmadı.
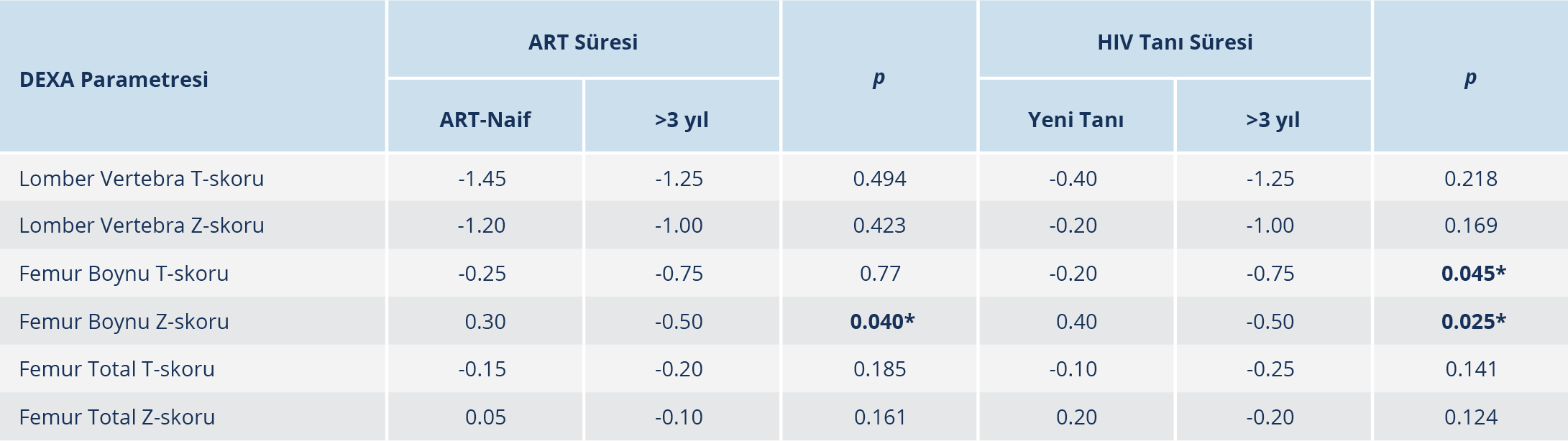
Tablo 3. HIV ile Yaşayan Bireylerin DEXA Sonuçlarının Antiretroviral Tedavi (ART) Süresi ve HIV Tanı Süresine Göre Değerlendirilmesi
Tenofovir disoproksil fumarat (TDF) tedavisi alan ve almayan HIV pozitif bireyler arasında DEXA sonuçları açısından istatistiksel olarak anlamlı bir fark yoktu; ancak TDF tedavisi almayan tüm HIV pozitif bireylerin DEXA sonuçları daha yüksek skorlara sahipti (Tablo 2). Üç yıldan uzun süre ART alan bireylerin femur boynu Z-skorları, ART-naif bireylere göre daha düşüktü (p<0.05). Benzer biçimde, 3 yıldan uzun süredir HIV tanısı almış olan bireylerin femur boynu T- ve Z-skorları da yeni tanı alan (0–3 ay) hastalara göre anlamlı düzeyde daha düşük bulundu (p<0.05) (Tablo 3).
Sigara içenlerin lomber vertebra Z-skorları sigara içmeyenlere veya bırakmış bireylere kıyasla belirgin olarak daha düşüktü (p<0.05). Düşük vücut kitle indeksi (VKİ), normal VKİ’ye sahip bireylere göre daha düşük lomber vertebra T- ve Z-skorları, femur boynu Z-skorları ve toplam femur T- ve Z-skorları ile ilişkiliydi (p<0.05).
HIV ile yaşayan bireylerde azalmış kemik yoğunluğuna sahip olma olasılığı (Z-skoru <-2), HIV negatif popülasyona kıyasla 2.73 kat daha yüksek bulundu (“odds ratio” [OR]: 2.73) (Tablo 4).
Hastaların en yüksek HIV RNA ve en düşük CD4+ T hücre düzeyleri ile KMY arasında anlamlı düzeyde bir ilişki saptanmadı. Ayrıca, D vitamini ve kalsiyum düzeyleri gibi laboratuvar parametrelerinin her iki grupta da düşük KMY ile ilişkili olmadığı görüldü.
İRDELEME
Bu çalışmada, düşük KMY için başka risk faktörü bulunmayan HIV ile yaşayan genç bireylerin KMY değerleri, HIV negatif kontrol grubuyla karşılaştırıldı. Bulgular, HIV ile yaşayan bireylerde düşük KMY prevalansının (%16.7) HIV negatif bireylere (%6.8) kıyasla 2.45 kat daha yüksek olduğunu gösterdi. Ayrıca, hem HIV infeksiyonu süresinin hem de ART süresinin KMY üzerinde etkili olduğu görüldü.
Türkiye’de ve dünya genelinde HIV ile yaşayan genç bireylerin kemik sağlığına ilişkin veriler oldukça sınırlıdır. HIV ile yaşayan ve HIV negatif bireyleri kemik sağlığı açısından karşılaştıran bir meta-analizde; bu konuda yapılan çalışmaların büyük bir kısmının kontrol grubu içermediği belirtilmiş ve bu nedenle analizde birçok çalışma hariç tutulmuştur (17). Bu araştırma, kontrol grubu içermesi bakımından meta-analizlerde vurgulanan metodolojik standartlara uygundur (7). Kemik mineral yoğunluğu, risk faktörleri olmayan bireylerde de düşük saptanabileceğinden, aynı çalışma içinde HIV pozitif ve HIV negatif grupların birlikte değerlendirilmesi önem taşımaktadır.
Türk Endokrinoloji ve Metabolizma Derneği kılavuzları, DEXA ölçümlerinin yorumlanmasında 50 yaş altı erkekler ve menopoz öncesi kadınlar için Z-skoru kullanılmasını önermektedir. Ancak Z-skoru, tek başına osteopeni veya osteoporoz için doğrudan bir gösterge değildir; destekleyici bir parametredir (1). Literatürdeki birçok çalışmada T-skoru kullanılmış ve ölçümleri yorumlanmıştır. Bir meta-analizde, T-skoru esas alınarak değerlendirilen 884 HIV ile yaşayan ve 654 HIV negatif birey karşılaştırılmış; HIV pozitif bireylerde düşük KMY (T-skoru < -1) riskinin 6.4 kat, osteoporoz (T-skoru < -2.5) riskinin ise 3.7 kat arttığı bildirilmiştir (17). Çalışmamızda, 50 yaş altı popülasyonda, HIV ile yaşayan bireylerin yaşa göre ayarlanmış düşük KMY’ye (Z-skoru <-2) sahip olma olasılığı 2.73 kat daha yüksek bulundu. Yukarıda anılan, meta-analizdeki OR değerlerinin çalışmamıza kıyasla daha yüksek olması, 18 yaş üstü tüm hastaların dahil edilmesinden ve DEXA ölçümlerinin T-skoru kullanılarak yorumlanmasından kaynaklanıyor olabilir.
Kemik metabolizmasını etkileyen hastalıklar, kemiğin farklı bölgelerinde baskın demineralizasyonla seyredebilir. HIV infeksiyonu özellikle kemiğin trabeküler kısmını etkiler (18). Trabeküler alanı temsil eden ölçüm lomber vertebra DEXA ölçümüdür. Çalışmamızda, HIV ile yaşayan bireylerde, HIV negatif bireylere kıyasla lomber vertebra T- ve Z- skorlarında istatistiksel olarak anlamlı düzeyde bir azalma saptandı (p<0.05).
Türkiye’de 22–70 yaş aralığındaki 126 HIV pozitif bireyle yapılan bir çalışmada, DEXA sonuçları değerlendirilmiş ve osteopeni oranı %53.9 ve osteoporoz oranı %23.8 olarak bildirilmiştir (11). Bu yüksek oran, örneklemde 50 yaş üzeri bireylerin bulunmasıyla açıklanabilir. Çin’deki bir kohortta da benzer şekilde olguların %53’ünde hem T- hem de Z-skorlarıyla tanımlanan azalmış KMY bildirilmiştir (19). Söz konusu çalışmada hem T- hem de Z-skorları için eşik değer -1 olarak belirlendiği için yüksek prevalans gözlenmiş olabilir. Buna karşılık, Romanya’da 22–49 yaş aralığındaki HIV pozitif bireyler üzerinde yapılan bir çalışmada, düşük KMY sıklığı Z-skoruna göre %21.7 olarak bildirilmiştir (12). Türkiye’de 18–50 yaş aralığında yapılan bir diğer çalışmada, HIV ile yaşayan bireylerin %19.4’ünün lomber vertebra Z-skoru temel alınarak düşük KMY’ye sahip olduğu bildirilmiştir (13). Çalışmamızda bulunan %16.7’lik prevalans bu verilerle uyumludur.
Antiretroviral tedavinin KMY üzerindeki etkisi yapılan çalışmalarda gösterilmiştir. Randomize kontrollü çalışmalarda, kemik kütlesi kaybının öncelikle ART başlangıcından sonraki ilk 6–12 ay içinde gerçekleştiği ve sonrasında ise sabitlendiği bildirilmiştir (20). Bazı çalışmalarda non-nükleozit ters transkriptaz inhibitörleri (NNRTI) ve proteaz inhibitörleri (PI) gibi bazı ART rejimlerinin 3 yıllık kullanım sonrası lomber vertebra T-skorlarını düşürdüğü bildirilmiştir (12). Bu nedenle çalışmamızda katılımcılar ART süresine göre 3 yıldan uzun süredir ART alanlar ve ART-naif bireyler olarak iki gruba ayrılmıştır. Bulgularımız, uzun süreli ART kullananlarda KMY’nin daha düşük olduğunu göstermektedir.
Cazanave ve arkadaşları (21) azalmış KMY’nin HIV tanı süresi ile ilişkili olduğunu bildirmiştir. Bizim çalışmamızda da 3 yıldan uzun süredir HIV tanısı alan bireylerin yeni tanı alanlara göre anlamlı derecede daha düşük femur boynu T- ve Z-skorlarına sahip olduğu belirlendi (p<0.05). Proteaz inhibitörleri ve TDF tedavilerinin, KMY azalmasıyla bağlantısı olmakla birlikte çalışmamızda PI tedavisi alan sadece birkaç hasta olması nedeniyle yalnızca TDF tedavisinin etkileri incelendi. Tenofovir disoproksil fumarat tedavisi ile KMY arasındaki ilişki istatistiksel olarak anlamlı düzeyde olmamakla birlikte T- ve Z-skorları TDF almayanlarda daha yüksekti. Yapılan bir diğer çalışmada da benzer şekilde TDF kullananlarda T- ve Z- skorları daha düşük olmakla birlikte KMY üzerindeki etkisi istatistiksel olarak anlamlı bulunmamıştır (22).
Düşük VKİ, sigara ve alkol tüketimi osteopeni/osteoporoz için bilinen risk faktörleridir (23,24). Çalışmamızda, düşük VKİ’nin düşük KMY ile ilişkili olduğu saptanmıştır. Tayvan’da yapılan bir çalışma da düşük VKİ’nin HIV ile yaşayan bireylerde azalmış KMY ile ilişkili olduğu bildirilmiştir (25).
Yapılan bazı çalışmalarda HIV infeksiyonu süresi, düşük CD4+ T hücre sayısı ve yüksek viral yük KMY azalmasıyla ilişkilendirilmiştir (4). Ancak, bu faktörlerin KMY ile ilişkili olmadığını savunan çalışmalar da mevcuttur. Kesitsel olarak gerçekleştirilen 107 hastalık prospektif bir kohort çalışma, düşük CD4+ T hücre sayısının ve yüksek HIV RNA düzeyinin KMY’yi azaltmada etkisiz olduğu bildirilmiştir (26,27). Çalışmamızda CD4+ T hücre sayısı <200 olan hastalar örneklem içinde küçük bir grubu (%15.2) oluşturduğundan ve hastaların çoğunda HIV RNA baskılanmış olduğundan, KMY ile CD4+ T hücre sayısı ve HIV RNA düzeyi arasında bir ilişki kurulamadı.
Azalan KMY’nin en önemli nedeni yaşlanmadır (28). Öte yandan DEXA ölçümlerinin yorumlanması 50 yaş altı ve üstü bireylerde farklılık gösterir (1). HIV ve KMY üzerine yapılan çalışmalarda, genellikle 50 yaş altı ve üstü hastaların DEXA ölçümleri bir arada yorumlanmıştır (25). Çalışmamızda, 50 yaş ve üstü bireyler hariç tutuldu. Bu nedenle, HIV infeksiyonunun KMY üzerindeki etkisi daha belirgindi ve bu durum çalışmamızın güçlü yönlerinden birini oluşturdu. Literatürdeki daha yüksek oranda düşük KMY bildiren çalışmalar metodolojik olarak T-skorlarına dayanmaktadır. Elli yaş altı HIV pozitif bireylerin Z-skorlarına göre analiz edildiği çalışmalarda, düşük KMY’nin çalışmamıza benzer şekilde yaklaşık %20 olduğu bildirilmiştir (12,13). Z-skoruna dayalı ve benzer yaş grubuna sahip ortak komorbiditelere sahip HIV negatif kontrol grubu içeren çalışmalar literatürde oldukça sınırlıdır; Türkiye’de bu tasarımla yapılmış başka bir çalışmaya rastlanmamıştır.
Çalışmamızın başlıca sınırlılıkları retrospektif tasarım nedeniyle bazı verilere erişim sağlanamaması ve özellikle HIV negatif kontrol grubunda DEXA ölçümlerine erişilen ve dahil etme kriterlerini karşılayan katılımcı sayısının düşük olmasıdır. Osteoporoz, yetişkinlerde düşük KMY’nin ana nedenidir. Ancak, düşük KMY’li hastaları tedavi ederken diğer nedenleri de göz önünde bulundurmak önemlidir. Hafif osteogenezis imperfekta, osteomalazi, kronik böbrek hastalığıyla ilişkili mineral ve kemik bozuklukları ve bazı nadir hastalıklar da düşük KMY’ye yol açabilir (29). Çalışmamızın retrospektif tasarımı nedeniyle olgularımızdaki düşük KMY’nin diğer olası nedenleri incelenemedi.
Kemik kaybının erken dönemlerinde genellikle klinik belirti görülmez; ancak, osteoporoz geliştiğinde düşük KMY kırıklara yol açabilir. Sırt ağrısı, omurga kırıkları veya çökmüş kemik nedeniyle oluşan boy kısalması gibi belirtiler zamanla ortaya çıkabilir. Düşük KMY’nin HIV ile yaşayan bireylerdeki klinik etkisi incelenebilir.
HIV ile yaşayan bireyler, HIV negatif bireylere kıyasla kardiyovasküler hastalık, tip 2 diyabet, kas güçsüzlüğü ve bilişsel bozukluk gibi yaşlanmayla ilişkili komorbiditelere daha erken yaşta maruz kalmaktadır (30). HIV infeksiyonunun ikincil osteoporozun nedenlerinden biri olduğu göz önüne alındığında, çeşitli çalışmalarda önerildiği gibi HIV ile yaşayan bireylerde DEXA taramasının yapılması makul görünmektedir (19,31).
Bu çalışmada, HIV ile yaşayan bireylerin HIV negatif popülasyona göre daha düşük KMY’ye sahip olma olasılığının 2.4 kat daha yüksek olduğu gösterildi. Bulgular, HIV infeksiyonunun yalnızca ileri yaşta değil, genç bireylerde de KMY azalmasına yol açabileceğini ortaya koymaktadır. Bu durum, 50 yaş altı ve KMY düşürücü risk faktörleri bulunan HIV pozitif bireylerde DEXA ile kemik mineral yoğunluğu taramasının dikkate alınması gerektiğini düşündürmektedir. Ancak çalışmamızda, DEXA verilerine erişilebilen 50 yaş altı katılımcı sayısının sınırlı olması, sonuçların daha geniş örneklemli ve çok merkezli çalışmalarla doğrulanması gerekliliğini ortaya koymaktadır.
Hasta Onamı
Veriler retrospektif olarak değerlendirildiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Çalışma için Ümraniye Eğitim ve Araştırma Hastanesi Etik Kurulu’ndan 10 Şubat 2022 tarih ve 38 karar numarasıyla onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – M.Ç.Ö., M.A.; Tasarım – M.Ç.Ö., M.A.; Denetleme – M.Ç.Ö., M.A.; Kaynak ve Fon Sağlama – M.Ç.Ö., M.A.; Malzemeler/Hastalar – M.Ç.Ö., M.A.; Veri Toplama ve/veya İşleme – M.Ç.Ö., S.B.Ö.; Analiz ve/veya Yorum – M.Ç.Ö., S.B.Ö., M.A.; Literatür Taraması – M.Ç.Ö., M.A.; Makale Yazımı – M.Ç.Ö., M.A., S.B.Ö.; Eleştirel İnceleme – M.Ç.Ö., M.A., S.B.Ö.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Bilimsel Etkinlik
Bu çalışma, 6–9 Mart 2024 tarihlerinde Antalya’da düzenlenen 23. Türk Klinik Mikrobiyoloji ve İnfeksiyon Hastalıkları Kongresi’nde (KLİMİK 2024) bildiri olarak sunulmuştur.
Referanslar
- Türkiye Endokrinoloji ve Metabolizma Derneği. Osteoporoz ve Metabolik Kemik Hastalıkları Tanı ve Tedavi Kılavuzu [Internet]. Ankara: Türkiye Endokrinoloji ve Metabolizma Derneği; 2022. [erişim 10 Kasım 2023]. https://file.temd.org.tr/Uploads/publications/guides/documents/OSTEOPOROZ_MKH2022.pdf?a=1
- Tuzun S, Eskiyurt N, Akarirmak U, et al; Turkish Osteoporosis Society. Incidence of hip fracture and prevalence of osteoporosis in Turkey: the FRACTURK study. Osteoporos Int. 2012;23(3):949-55. [CrossRef]
- Olali AZ, Carpenter KA, Myers M, et al. Bone quality in relation to HIV and antiretroviral drugs. Curr HIV/AIDS Rep. 2022;19(5):312-27. [CrossRef]
- Lv T, Cao W, Li T. HIV-related immune activation and inflammation: current understanding and strategies. J Immunol Res. 2021;2021:7316456. [CrossRef]
- Sobh MM, Abdalbary M, Elnagar S, et al. Secondary osteoporosis and metabolic bone diseases. J Clin Med. 2022;11(9):2382. [CrossRef]
- Soldado-Folgado J, Chillarón JJ, Cañas-Ruano E, et al. An abnormal inflammatory pattern associated with long-term non-progression of HIV infection impacts negatively on bone quality. J Clin Med. 2022;11(10):2927. [CrossRef]
- Goh SSL, Lai PSM, Tan ATB, Ponnampalavanar S. Reduced bone mineral density in human immunodeficiency virus-infected individuals: a meta-analysis of its prevalence and risk factors. Osteoporos Int. 2018;29(3):595-613. [CrossRef]
- Narra R, Varra SK, Jukuri NR. Bilateral symmetrical stress fractures of femoral neck in HIV patient: case report and brief review of literature. BJR Case Rep. 2022;8(4):20220003. [CrossRef]
- Wattanachanya L, Sunthornyothin S, Apornpong T, et al; HIV-NAT 207/006 study team. Bone mineral density among virologically suppressed Asians older than 50 years old living with and without HIV: A cross-sectional study. PLoS One. 2022;17(11):e0277231. [CrossRef]
- European AIDS Clinical Society. Guidelines. Version 12.0 [Internet]. Brussels: European AIDS Clinical Society; Nov 15, 2023. [erişim 15 Kasım 2023]. https://www.eacsociety.org/media/guidelines-12.0.pdf
- Aydın OA, Karaosmanoglu HK, Karahasanoglu R, Tahmaz M, Nazlıcan O. Prevalence and risk factors of osteopenia/osteoporosis in Turkish HIV/AIDS patients. Braz J Infect Dis. 2013;17(6):707-11. [CrossRef]
- Chiţu-Tișu CE, Barbu EC, Lazăr M, Ion DA, Bădărău IA. Low bone mineral density and associated risk factors in HIV-infected patients. Germs. 2016;6(2):50-9. [CrossRef]
- Çimen C, Aksu-Sayman Ö, Fincancı M. [Measurement of bone mineral density in HIV-infected individuals who are not considered as a specific risk group for bone mineral densitometry screening]. Klimik Derg. 2019;32(3):318-23. Turkish. [CrossRef]
- Bruera D, Luna N, David DO, Bergoglio LM, Zamudio J. Decreased bone mineral density in HIV-infected patients is independent of antiretroviral therapy. AIDS. 2003;17(13):1917-23. [CrossRef]
- Lara BMC, Pádua CM, Mendicino CCP, Rocha GM. Osteopenia and osteoporosis among treatment-experienced people living with HIV. Braz J Infect Dis. 2020;24(4):288-95. [CrossRef]
- Specker BL, Wey HE, Smith EP. Rates of bone loss in young adult males. Int J Clin Rheumtol. 2010;5(2):215-28. [CrossRef]
- Brown TT, Qaqish RB. Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review. AIDS. 2006;20(17):2165-74. [CrossRef]
- Stellbrink HJ, Orkin C, Arribas JR, et al; ASSERT Study Group. Comparison of changes in bone density and turnover with abacavir-lamivudine versus tenofovir-emtricitabine in HIV-infected adults: 48-week results from the ASSERT study. Clin Infect Dis. 2010;51(8):963-72. [CrossRef]
- Zeng YQ, Xiao J, Li CL, et al. Prevalence and risk factors for bone mineral density changes in antiretroviral therapy-naive human immunodeficiency virus-infected adults: a Chinese cohort study. Chin Med J (Engl). 2020;133(24):2940-6. [CrossRef]
- Rukuni R, Gregson C, Kahari C, et al. The IMpact of Vertical HIV infection on child and Adolescent SKeletal development in Harare, Zimbabwe (IMVASK Study): a protocol for a prospective cohort study. BMJ Open. 2020;10(2):e031792. [CrossRef]
- Cazanave C, Dupon M, Lavignolle-Aurillac V, et al; Groupe d’Epidémiologie Clinique du SIDA en Aquitaine. Reduced bone mineral density in HIV-infected patients: prevalence and associated factors. AIDS. 2008;22(3):395-402. [CrossRef]
- Calmy A, Fux CA, Norris R, et al. Low bone mineral density, renal dysfunction, and fracture risk in HIV infection: a cross-sectional study. J Infect Dis. 2009;200(11):1746-54. [CrossRef]
- Gutiérrez F, Masiá M. The role of HIV and antiretroviral therapy in bone disease. AIDS Rev. 2011;13(2):109-18.
- Cohn SE, Clark RA. Human immunodeficiency virus infection in women. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. 8th ed. Philadelphia: Elsevier Saunders; 2015. p. 1590-615.
- Tsai MS, Zhang JY, Sun HY, et al. Performance of fracture risk assessment tool in HIV-positive male individuals aged ≥45 years on suppressive antiretroviral therapy. J Int AIDS Soc. 2019;22(8):e25383. [CrossRef]
- Grant PM, Kitch D, McComsey GA, et al. Long-term bone mineral density changes in antiretroviral-treated HIV-infected individuals. J Infect Dis. 2016;214(4):607-11. [CrossRef]
- Cervero M, Torres R, Agud JL, et al. Prevalence of and risk factors for low bone mineral density in Spanish treated HIV-infected patients. PLoS One. 2018;13(4):e0196201. [CrossRef]
- Demontiero O, Vidal C, Duque G. Aging and bone loss: new insights for the clinician. Ther Adv Musculoskelet Dis. 2012;4(2):61-76. [CrossRef]
- Jha S, Chapman M, Roszko K. When Low Bone Mineral Density and Fractures Is Not Osteoporosis. Curr Osteoporos Rep. 2019;17(5):324-32. [CrossRef]
- Schrock JM. Accelerated aging in people living with HIV: The neuroimmune feedback model. Brain Behav Immun Health. 2024;36:100737. [CrossRef]
- Yenilmez E, Çetinkaya RA. Evaluation of initial results of naïve HIV-infected patients regarding bone health. J Surg Med. 2019;3(5):384-9. [CrossRef]