En Çok Okunanlar
Özet
Amaç: Acinetobacter baumannii özellikle yoğun bakım ünitelerinde (YBÜ’lerde) ve immün sistemi baskılanmış hastalarda ciddi hastane infeksiyonlarına neden olabilmektedir. Uzun süreli YBÜ yatışı, antibiyotik kullanımı, mekanik ventilatöre bağlı kalma, damar içi kateter, idrar sondası, endotrakeal tüp, trakeostomi varlığı ve birimde infekte veya kolonize hasta yoğunluğunun fazla olması başlıca risk faktörleridir. A. baumannii türleri, antibiyotiklere karşı yüksek oranda direnç geliştirme ve hastane ortamında uzun süre canlı kalabilme özellikleri nedeniyle klinik açıdan önemlidir. Bu çalışmada, laboratuvarımıza gönderilen kan kültürlerinde üreyen A. baumannii suşlarında effluks pompası ve hücreler arası iletişim (quorum sensing) genlerinin araştırılması amaçlandı.
Yöntemler: Hastanemizin Tıbbi Mikrobiyoloji Laboratuvarı’na gönderilen kan kültürlerinde üreyen ve çoklu ilaç direncine sahip 53 A. baumannii suşu çalışmaya dahil edildi. Tür tanımlaması ve minimum inhibitör konsantrasyon (MİK) değerleri VITEK 2 otomatize sistemi (bioMérieux, Fransa) ile belirlendi. Effluks pompası genleri (adeABC) ile hücreler arası iletişim genleri (luxI, luxR) polimeraz zincir reaksiyonu (PCR) ile araştırıldı. Ayrıca, PCR işleminden sonra tüm örnekler agaroz jel elektroforez ile yürütülerek spesifik DNA bantları değerlendirildi.
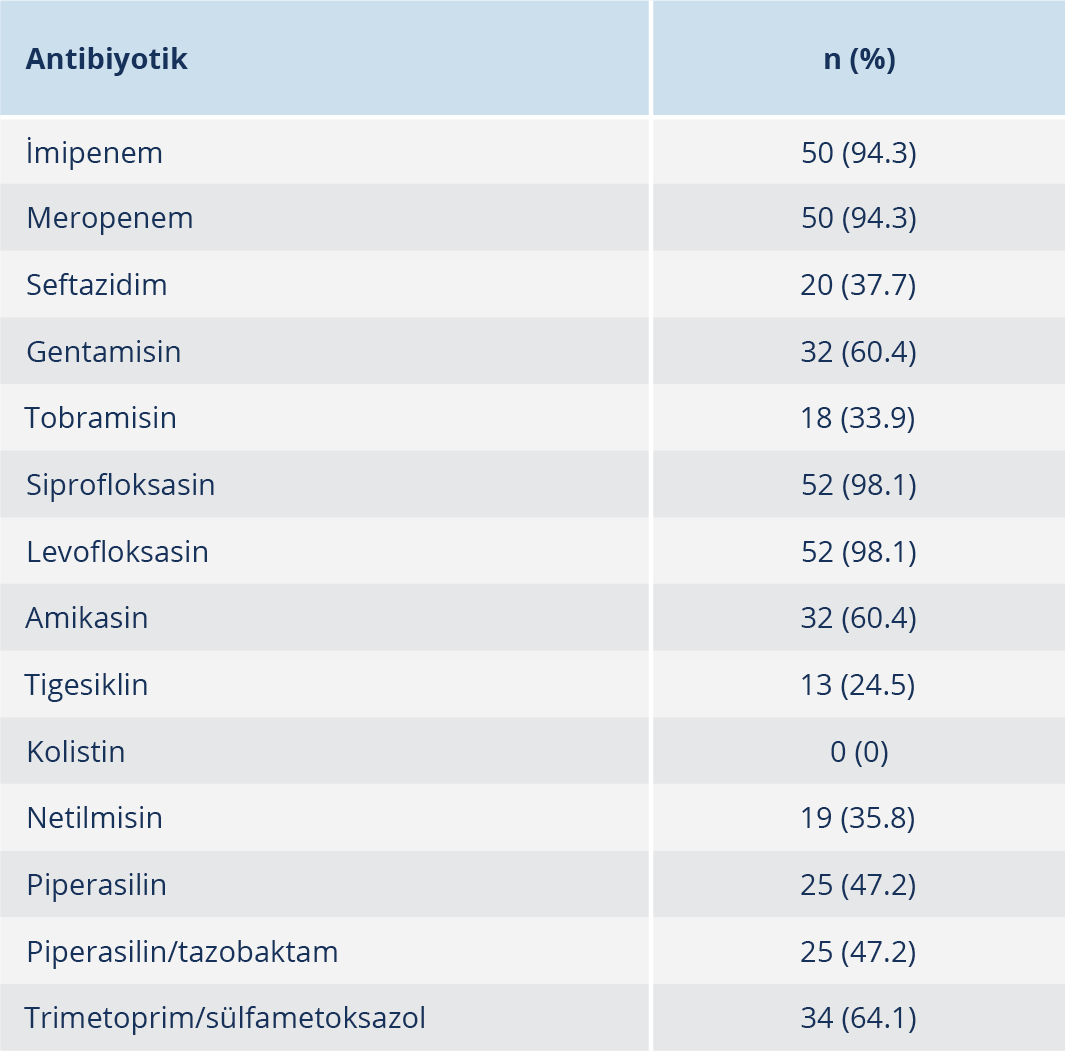
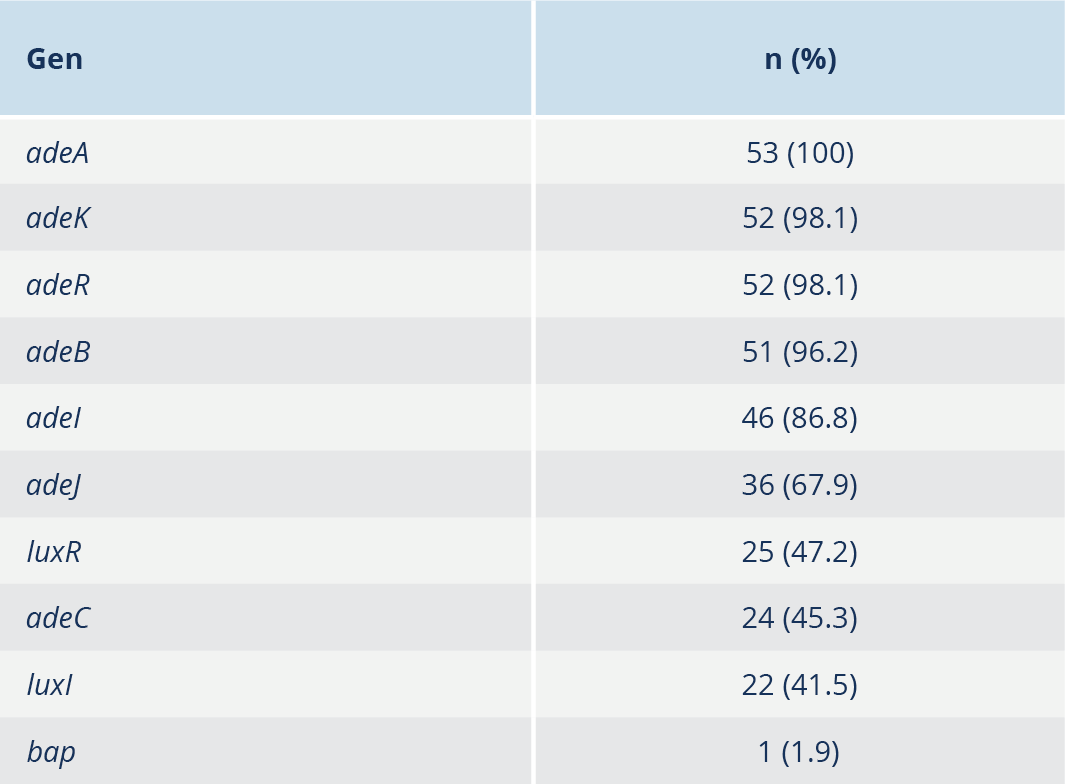
Bulgular: Çalışmamızda bap geni %1.9 oranı ile en düşük saptanan gen olurken, effluks pompa gen bölgelerinden olan adeA geni tüm izolatlarda (%100) tespit edildi. Diğer effluks pompa genleri olan adeB %96.2, adeC %45.3, adeI geni %86.8, adeJ %67.9, adeK %98.1 ve adeR %98.1 oranlarında saptandı. Hücreler arası iletişim genlerinden olan luxI %41.5 oranında, luxR geni ise %47.2 oranında tespit edildi. Karbapenemlere ve kinolon grubu antibiyotiklere karşı yüksek oranda direnç saptanırken, kolistine karşı direnç tespit edilmedi.
Sonuç: Bu çalışma, A. baumannii infeksiyonlarının epidemiyolojisi ve patogenezinin daha iyi anlaşılmasına katkıda bulunmaktadır. Benzer çalışmalar, dirençli A. baumannii suşlarında direnç gelişiminde rol oynayan genlerin daha iyi tanımlanmasına olanak sağlayarak yeni tedavi stratejilerinin ve politikaların geliştirilmesine katkı sağlayacaktır. Ayrıca, hastane içi çalışmalarla direnç faktörlerinin belirlenmesi, en etkili tedavi yöntemlerinin seçilmesine yardımcı olacak ve hem hasta sağlığına hem de ülke ekonomisine olumlu katkıda bulunacaktır.
GİRİŞ
Acinetobacter spp. infeksiyonlarında; hastanede kalış süresi, yoğun bakım ünitesi (YBÜ) yatışı, hastanın immün sisteminin zayıflığı, mekanik ventilasyon, antimikrobiyal ajanlarla etkileşim, cerrahi alet ve ekipmanların sterilizasyonu, kullanılan dezenfektanların oranları ve çeşitleri gibi birçok faktör rol oynamaktadır (1). Acinetobacter baumannii, çeşitli yüzeylerde biyofilm oluşturma, kuruluğa ve dezenfektanlara dirençli olma özellikleri nedeniyle özellikle YBÜ’lerde ventilatörle ilişkili pnömoniye (VİP’e) yol açan ve hastane salgınlarında sıklıkla izole edilen, mortalitesi yüksek bir nozokomiyal patojendir (2).
Acinetobacter baumannii suşları ile gelişen infeksiyonların en önemli yönü, tamamen bilinen antibiyotiklerin çoğuna karşı direnç göstermeleridir. Yüksek antibiyotik direnç oranı nedeniyle bu patojen hastane ortamında uzun süre canlı kalabilmekte ve yayılabilmektedir (3). Çoklu ilaç dirençli suşların artışı ve yüksek morbidite ve mortalite nedeniyle A. baumannii, Dünya Sağlık Örgütü (DSÖ)’nün antimikrobiyal direnç araştırmalarında öncelikli patojenler listesinde yer almaktadır (4). Çok ilaca dirençli (multidrug resistance, MDR), üç veya daha fazla antibiyotik sınıfında en az bir ajana direnç olarak tanımlanmaktadır (5).
Bu çalışmada, hastanemizde kan kültüründe üreyen hastane kaynaklı A. baumannii izolatlarında effluks pompası genleri (adeABC), bakterinin biyofilm oluşturmasında katkıda bulunduğu düşünülen bap geni ve hücreler arası iletişim (quorum sensing) genlerinin (luxI, luxR) varlığı araştırıldı.
YÖNTEMLER
2019–2021 yılları arasında hastanemizin farklı servislerinden gönderilen ve Tıbbi Mikrobiyoloji Laboratuvarı’nda rutin olarak işleme alınan kan kültürlerinden izole edilen 53 A. baumannii suşu çalışmaya dahil edildi. Mikroskobik inceleme ve Gram boyama sonucunda, 37°C’de koyun kanlı besiyerine tek koloni düşecek şekilde ekim yapıldı ve 24 saat inkübasyon için etüvde bekletildi. İnkübasyon sonrasında koyun kanlı agarda 0.5–2 mm çapında, parlak pembemsi renkte kabarık kolonilerden Gram boyama ve oksidaz testi yapıldı.
Bakteri tanımlanması konvansiyonel yöntemler (Gram boyama, oksidaz testi, fermentasyon özellikleri) ve VITEK 2 (bioMérieux, Marcy-l’Étoile, Fransa) otomatize sistemi kullanılarak yapıldı. Bakterilerin antibiyotik duyarlılık testleri Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (European Committee on Antimicrobial Susceptibility Testing, EUCAST) önerileri dikkate alınarak VITEK 2 (bioMérieux, Marcy-l’Étoile, Fransa) otomatize sistemi ve sıvı mikrodilüsyon yöntemi ile belirlendi. Acinetobacter baumannii olarak tanımlanan suşlar moleküler çalışmalar yapılana kadar -80°C’de boncuklu bakteri saklama tüplerinde dondurularak saklandı. Tüm çalışmalarda kontrol suşu olarak Pseudomonas aeruginosa ATCC 27853 kullanıldı.
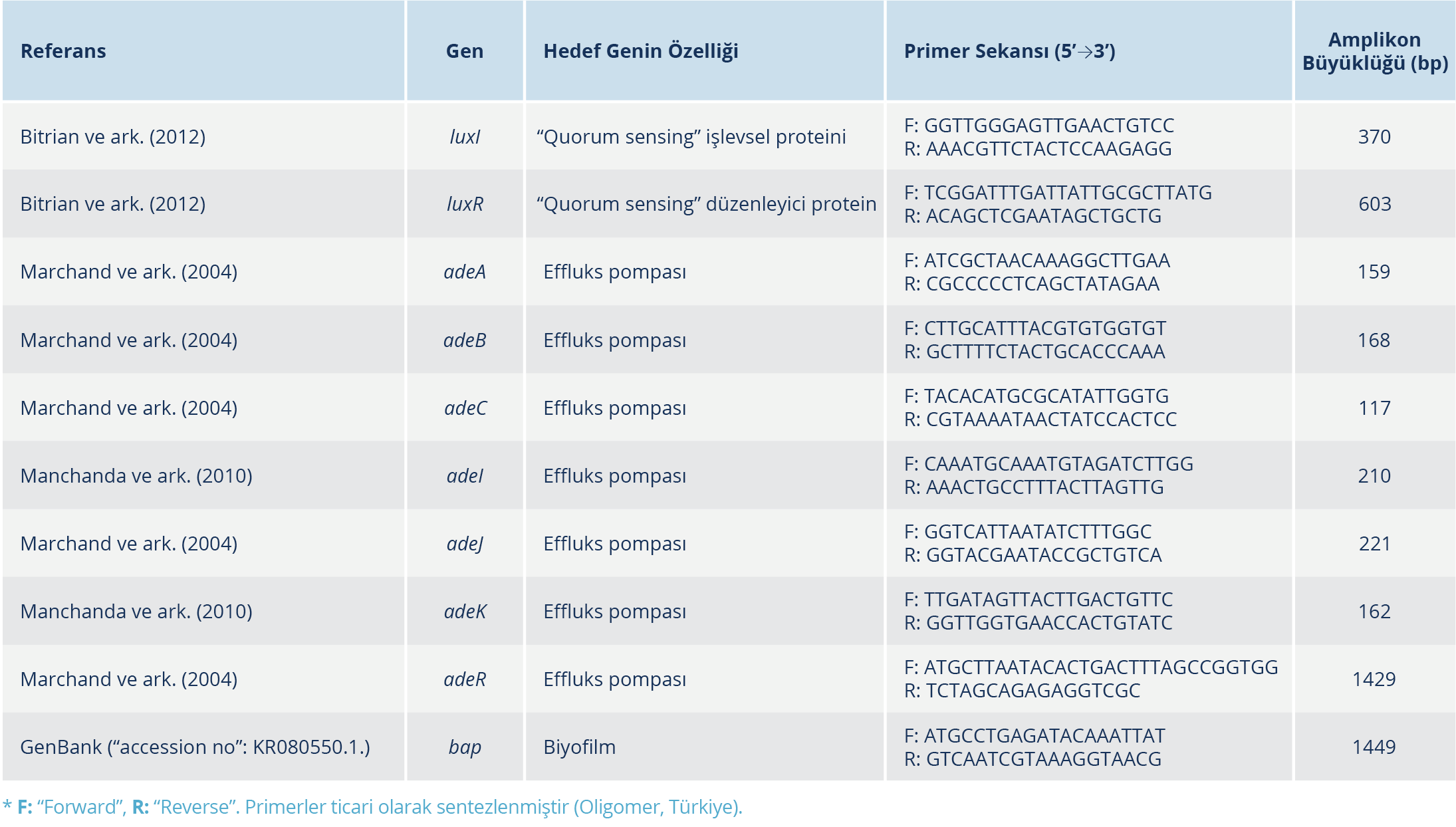
Tablo 1. Acinetobacter baumannii İzolatlarının Virülans Faktörlerinin Saptanması İçin Kullanılan Primerler* (6-9).
DNA izolasyonu, taze üretilmiş kolonilerden ticari QIAamp DNA mini kit (Qiagen, Hilden, Almanya) protokolüne uygun olarak yapıldı. Çalışmada kullanılan liyofilize haldeki primerlere, üretici firmanın önerdiği şekilde 90 μM su + 10 μM primer eklenerek 100 μM’lık stok çözeltiler hazırlandı. Çalışmamızda kullanılan primerler Tablo 1’de sunuldu.
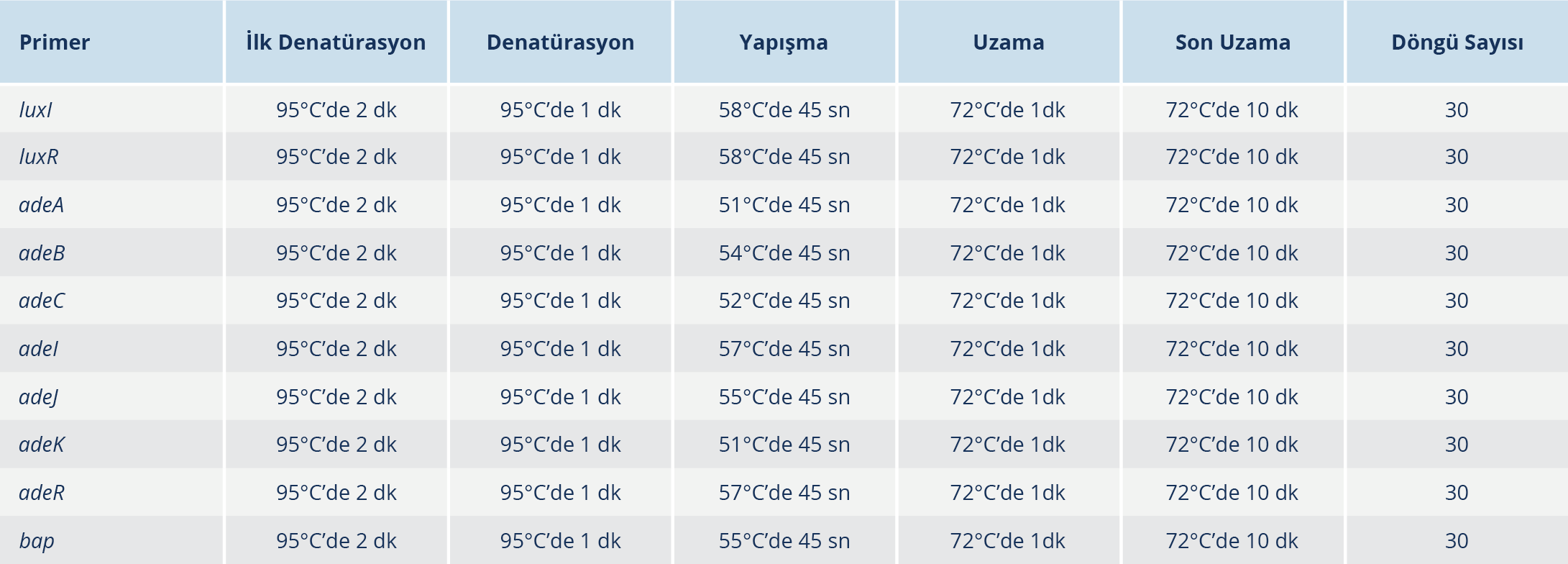
Tablo 2. Acinetobacter baumannii İzolatlarının Virülans Faktörlerinin Saptanması İçin PCR Isıl Döngü ve Süre Diyagramı
irülans genleri ve biyofilm ile ilişkili bap geni için polimeraz zincir reaksiyonu (PCR) miks içeriği 2 × Master mix (12 μl), primer F ve R (1.5 μl), DNA (3 μl), H2O (7 μl) ile toplam hacim 25 μl olacak şekilde hazırlandı. Çalışmada virülans genleri için optimize edilen PCR programı Tablo 2’de verildi. Polimeraz zincir reaksiyonu uygulamaları için Labcycler Gradient cihazı (SensoQuest GmbH, Göttingen, Almanya) kullanıldı. PCR ürünleri elektroforez işlemine kadar -20°C’de saklandı.
Elektroforezde tampon çözeltisi olarak tris-borik asit-EDTA (TBE) kullanılmış olup TBE çözeltisi 0.5 × konsantrasyonda hazırlandı. Bunun için 10.8 gr tris baz, 5.5 gr borik asit ve 0.744 gr EDTA karıştırıldı ve karışım distile su ile 2000 ml’ye tamamlandı. İki gr agaroz, 200 ml 0.5 × TBE tamponu ile mikrodalga fırında ısıtıldı. Toz halindeki agaroz, çözelti içinde şeffaf bir hale gelene kadar ısıtıldı ve ara ara karıştırıldı. Karışımın sıcaklığı 50°C’ye soğutulduktan sonra içerisine 8 μl etidyum bromür eklendi. Hazırlanan çözelti, kuyucukların oluşması amacıyla tarak yerleştirilerek jel tepsisine aktarıldı ve oda sıcaklığında katılaşıncaya kadar bekletildi. Soğutulan jel tepsiye döküldü ve oda sıcaklığında katılaşıncaya kadar bekletildi. Jel katılaştıktan sonra tarak dikkatlice çıkarıldı ve elektroforez tankına jel içinde kalacak şekilde 0.5 × TBE tamponu çözeltisi eklendi. Daha sonra jel tepsisi tanka yerleştirildi ve 2.5–3 saat DNA’ların yürümesi için bekletildi. Daha sonra 3 μl PCR ürünü, 3 μl DNA yükleme boyası (loading buffer) ile karıştırılarak elde edilen 6 μl’lik karışım kuyucuklara yüklendi. İşlem sonunda görüntülenecek olan bantların baz çiftlerini (bp) saptamak için ilk ve son kuyucuğa 100 bp aralıklarla bant veren DNA marker yüklendi ve elektroforezde 120 V’de 2–3 saat yürütüldü.
Bu çalışma, Selçuk Üniversitesi Tıp Fakültesi Girişimsel Olmayan Etik Kurulu’nun 22 Ocak 2020 tarihli ve 2020/02 sayılı kararı ile onaylanmış olup Helsinki Bildirgesi’nin etik ilkelerine uygun olarak yürütüldü.
BULGULAR
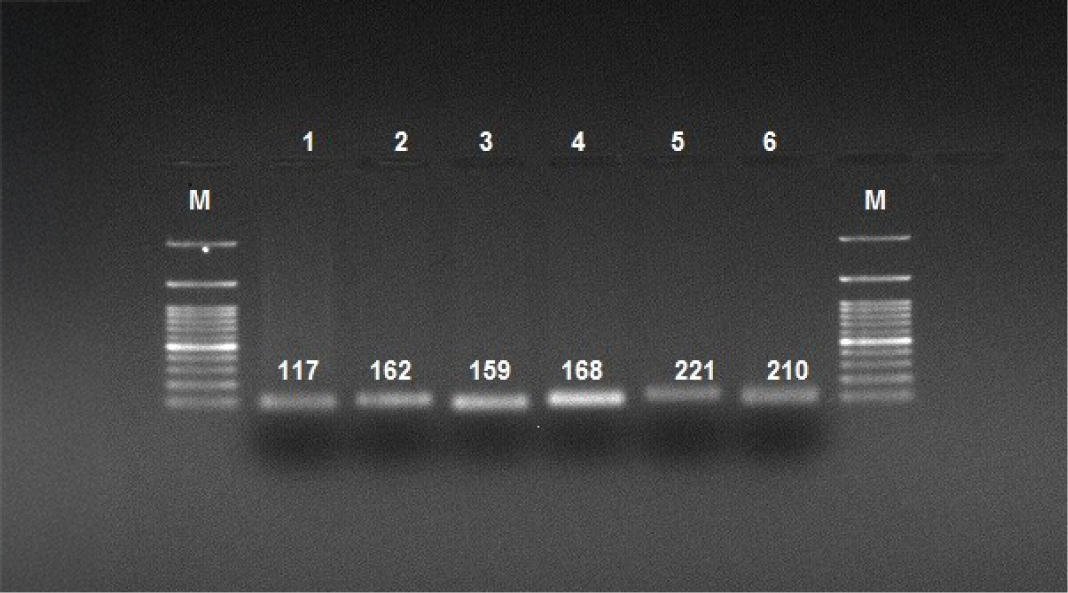
Şekil 1. Acinetobacter Baumannii İzolatlarında Effluks Pompası Genlerine Ait PCR Ürünleri. M: 100 bp DNA marker. Kuyucuklar: 1, adeC; 2, adeK; 3, adeA; 4, adeB; 5, adeJ; 6, adeI.
Hastanemiz laboratuvarında elde edilen 53 A. baumannii izolatının 33’ü (%62.2) erkek, 20’si (%37.7) kadın hastaya aitti. Bakteri en sık 60–75 (%35.9) yaş grubundaki hastalardan gönderilen kan kültürlerinden izole edildi. Örneklerin kliniklere göre dağılımı incelendiğinde, A. baumannii üremesi en çok Anestezi ve Reanimasyon Ünitesi’nde yatan hastalarda görüldü. Antibiyotik duyarlılık testlerinde, kolistin için MİK yöntemi, diğer antibiyotikler için ise VITEK 2 otomatize sistemi (bioMérieux, Fransa) kullanılmış olup sonuçlar EUCAST sınır değerlerine göre yorumlandı. Bulgulara göre, karbapenemler ve kinolonlara karşı yüksek direnç gözlenirken, kolistin tüm izolatlarda etkili bulundu (Tablo 3). Çalışmaya dahil edilen bakterilerin DNA izolasyonu yapıldı ve sonrasında jel elektroforez yöntemi ile elde edilen spesifik DNA bantları jel görüntüleme sisteminde görüntülendi (Şekil 1). Acinetobacter baumannii olarak tanımlanan 53 suş PCR yöntemi ile çalışıldı. Çalışmada bap geninin %1.9 oranı ile en düşük saptanan gen olduğu, effluks gen bölgelerinden adeA geninin ise tüm izolatlarda (%100) bulunduğu belirlendi. Çalışmamızda tespit edilen diğer genlerin dağılımı Tablo 4’te sunuldu.
İRDELEME
Son yıllarda, ESKAPE olarak tanımlanan (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, A. baumannii, P. aeruginosa, Enterobacter spp.) türler nozokomiyal infeksiyonlarda başlıca etkenler arasında yer almaktadır. Bu bakterilerin neden olduğu infeksiyonlarda çoklu antibiyotik direnci, hem korunma hem de tedavide önemli güçlükler yaratmaktadır (10,11). Özellikle A. baumannii’de çoklu ilaç direncinin hızla yayılması halk sağlığı açısından ciddi bir tehdit oluşturmaktadır (12)
Biyofilm oluşumu, mikroorganizmaların antibiyotiklere ve dezenfektanlara karşı direncini artıran en önemli mekanizmalardan biridir (13). Acinetobacter baumannii’de biyofilm ile ilişkili yüzey proteini olan bap geni, bu özelliğin genetik belirleyicilerinden biridir. Bu genin tüm organizmalardaki ortak özellikleri; büyük boyut, çoklu ardışık tekrarların varlığı, hücre yüzeyi konumu ve biyofilm oluşumundaki rolüdür (14). Tayvan’da bir eğitim hastanesinden toplanan izolatlarda yapılan bir çalışmada, A. baumannii’nin biyofilm oluşturma yeteneği ile antibiyotik direnci ve biyofilm ilişkili genleri arasındaki korelasyon araştırılmıştır. Söz konusu çalışmada 154 izolattan %15.6’sının zayıf, %32.5’inin orta ve %45.4’ünün güçlü biyofilm oluşturduğu; bap, blaPER-1, csuE ve ompA genlerini taşıyan suşlarda biyofilm oranlarının sırasıyla %79.2, %38.3, %91.6 ve %68.8 olduğu ve bu genleri taşıyan suşların taşımayanlara göre daha güçlü biyofilm oluşturduğu bildirilmiştir (11). Qi ve arkadaşlarının (12) antibiyotik direnci ve biyofilm oluşumu arasındaki ilişkiyi inceledikleri çalışmada, 272 klinik izolattan 249’unda biyofilm oluşumu gözlenmiş, duyarlı olan suşların, çok ilaca dirençli ve ekstrem ilaç dirençli suşlara oranla daha güçlü biyofilm oluşturdukları tespit edilmiştir. Sharma ve arkadaşlarının (15) 2019 yılında yaptıkları çalışmada ise 108 Acinetobacter izolatından 10 (%9.3)’unun biyofilm oluşturduğu bildirilmiştir. İran’da 2016 yılında yapılan bir çalışmada, Tahran’daki iki hastaneden elde edilen 79 A. baumannii izolatında adeABC genlerinin sıklığı ve eritromisin, trimetoprim, meropenem ve imipeneme karşı direnç araştırılmıştır. En yüksek direnç trimetoprime (%93), en düşük direnç eritromisine (%53) karşı bulunmuş; adeA, adeB ve adeC genlerinin sıklığı sırasıyla %96.2, %96.2 ve %91.1 olarak rapor edilmiştir. İmipenem direnci ile effluks pompası genlerinin varlığı arasında anlamlı bir ilişki gösterilmiştir (p<0.05) (16). Bizim çalışmamızda 53 hastanın yalnızca birinde (%1.9) biyofilm varlığı tespit edildi. Bap geninin düşük oranda saptanması, A. baumannii suşlarının genetik çeşitliliğini yansıtabileceği gibi, izolatların büyük çoğunluğunun kan örneklerinden elde edilmesi de biyofilm formasyonuna ilişkin gen ekspresyonunu etkilemiş olabilir.
Modarresi ve arkadaşları (13) tarafından 2015 yılında yapılan bir çalışmada, A. baumannii biyofilm oluşturan klinik izolatlarında N-asyl homoserin lakton (AHL), siderofor ve katekol üzerindeki demir-III sınırlamasının virülans faktörlerine etkisi araştırılmış; yüksek AHL aktivitesi için luxI ve luxR genlerinin varlığının gerekli olduğu, düşük demir konsantrasyonunda (20 μM) luxI/luxR ekspresyonunun dört kattan fazla arttığı gösterilmiştir. Bu bulgular, demirin hem effluks pompaları hem de hücreler arası iletişim üzerinde düzenleyici bir rol oynadığını ortaya koymaktadır.
Effluks pompası genleri arasında adeB, antibiyotik direnci ile en sık ilişkilendirilen gen olarak bildirilmektedir (17). Polimeraz zincir reaksiyonu (PCR) temelli çalışmalarda da adeB’nin klinik izolatlarda en yüksek oranda saptanan gen olduğu gösterilmiştir. Örneğin, Zarrilli ve arkadaşları (18) A. baumannii suşlarında adeB’yi %80, adeA’yı %42 ve adeC’yi %40 oranında tespit etmiştir. Diğer bazı çalışmalarda adeB tüm klinik izolatlarda bulunmuşken, benzer çalışmalarda bu oran %70–75 arasında değişmektedir (19). Bununla birlikte, adeA’nın en yüksek oranda rapor edildiği araştırmalar da mevcuttur. Literatürde genel yaklaşım, adeC’nin effluks genleri arasında en düşük oranda saptandığını göstermektedir (13). Ayrıca, adeC pozitif ve negatif suşların karşılaştırıldığı çalışmalarda, adeC pozitif suşların daha fazla antibiyotik direncine sahip olduğu bildirilmiştir (19). Bizim çalışmamızda ise effluks gen bölgelerinden adeA geni tüm izolatlarda (%100) tespit edildi. Diğer effluks genlerinin dağılımı adeB %96.2, adeC %45.3, adeI %86.8, adeJ %67.9, adeK %98.1 ve adeR %98.1 şeklinde iken hücreler arası iletişim genlerinden luxI %41.5, luxR ise %47.2 oranında saptandı.
Çalışmamız, A. baumannii’nin çok ilaca dirençli bir patojen olduğunu ve tedavisinde önemli güçlükler bulunduğunu ortaya koymaktadır. Karbapenem ve florokinolonlara karşı yüksek direnç oranları, bu tür antibiyotiklerin tedavi seçenekleri arasında etkinliğini sınırlamaktadır. Buna karşın kolistin gibi bazı antibiyotiklere karşı direnç oranı düşüktür; bu da bu antibiyotiğin dirençli suşlar üzerinde etkili olabileceğini düşündürmektedir. Effluks genleri ve hücreler arası iletişim gibi genetik özelliklerin yüksek prevalansı, bu bakterinin çevresel faktörlere uyum sağlama ve antibiyotiklere direnç geliştirme kapasitesini artırmaktadır. Bu nedenle, klinik tedavi stratejilerinde bu genetik mekanizmaların göz önünde bulundurulması gereklidir. Özellikle biyofilm üretimi ve hücreler arası iletişim mekanizmaları, tedavi başarısını olumsuz etkileyebilecek önemli faktörlerdir.
Çalışmamızın sınırlılıkları örneklem sayısının görece az olması ve yalnızca kan kültürlerinden elde edilen izolatların değerlendirilmiş olmasıdır. Bu nedenle gen prevalans oranlarının daha büyük popülasyonlarda ve farklı klinik örnekleri içeren çalışmalarla doğrulanması gereklidir. Böylece direnç mekanizmalarının daha kapsamlı biçimde anlaşılması mümkün olacaktır.
Sonuç olarak; A. baumannii infeksiyonlarında antibiyotik seçimi direnç profilleri ve genetik analizler doğrultusunda yapılmalıdır. Hastane infeksiyonlarının önlenmesi ve epidemiyolojik izlemin güçlendirilmesi, dirençli suşların yayılımının önlenmesi açısından kritik öneme sahiptir.
Hasta Onamı
Veriler retrospektif olarak değerlendirildiği için hasta onamı alınmamıştır.
Etik Kurul Kararı
Bu çalışma, Selçuk Üniversitesi Tıp Fakültesi Girişimsel Olmayan Etik Kurulu’nun 22 Ocak 2020 tarihli ve 2020/02 sayılı kararı ile onaylanmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – N.Ç., U.A.; Tasarım – N.Ç., U.A.; Denetleme – U.A.; Kaynak ve Fon Sağlama – U.A.; Malzemeler/Hastalar – U.A., N.Ç., M.S., E.K.; Veri Toplama ve/veya İşleme – E.K., M.S., N.Ç.; Analiz ve/veya Yorum – E.K., M.S., N.Ç.; Literatür Taraması – E.K., M.S., N.Ç.; Makale Yazımı – E.K., M.S., N.Ç., U.A.; Eleştirel İnceleme – E.K., M.S., N.Ç., U.A.
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Yazar finansal destek beyan etmemiştir.
Teşekkür
Bu araştırma Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından desteklenmiştir. Çalışmaya desteklerinden dolayı BAP koordinatörlüğüne teşekkür ederiz.
Referanslar
- Blanchard C, Barnett P, Perlmutter J, Dunman PM. Identification of Acinetobacter baumannii serum-associated antibiotic efflux pump inhibitors. Antimicrob Agents Chemother. 2014;58(11):6360-70. [CrossRef]
- Almasaudi SB. Acinetobacter spp. as nosocomial pathogens: Epidemiology and resistance features. Saudi J Biol Sci. 2018;25(3):586-96. [CrossRef]
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clin Microbiol Rev. 2008;21(3):538-82. [CrossRef]
- Blanco N, Harris AD, Rock C, et al; the CDC Epicenters Program. Risk factors and outcomes associated with multidrug-resistant Acinetobacter baumannii upon intensive care unit admission. Antimicrob Agents Chemother. 2017;62(1):e01631-17. [CrossRef]
- Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012;18(3):268-81. [CrossRef]
- Bitrian M, Solari CM, González RH, Nudel CB. Identification of virulence markers in clinically relevant strains of Acinetobacter genospecies. Int Microbiol. 2012;15(2):79-88.
- Marchand I, Damier-Piolle L, Courvalin P, Lambert T. Expression of the RND-type efflux pump AdeABC in Acinetobacter baumannii is regulated by the AdeRS two-component system. Antimicrob Agents Chemother. 2004;48(9):3298-304. [CrossRef]
- Manchanda V, Sanchaita S, Singh N. Multidrug resistant Acinetobacter. J Glob Infect Dis. 2010;2(3):291-304. [CrossRef]
- GenBank. Acinetobacter baumannii biofilm-associated protein (bap) gene, partial cds [Internet]. Bethesda (MD): National Center for Biotechnology Information, U.S. National Library of Medicine; 2015. [erişim 25 Haziran 2025]. https://www.ncbi.nlm.nih.gov/nuccore/KR080550.1
- Lee CR, Lee JH, Park M, et al. Biology of Acinetobacter baumannii: pathogenesis, antibiotic resistance mechanisms, and prospective treatment options. Front Cell Infect Microbiol. 2017;7:55. [CrossRef]
- Yang CH, Su PW, Moi SH, Chuang LY. Biofilm formation in Acinetobacter Baumannii: genotype-phenotype correlation. Molecules. 2019;24(10):1849. [CrossRef]
- Qi L, Li H, Zhang C, et al. Relationship between antibiotic resistance, biofilm formation, and biofilm-specific resistance in Acinetobacter baumannii. Front Microbiol. 2016;7:483. [CrossRef]
- Modarresi F, Azizi O, Shakibaie MR, Motamedifar M, Valibeigi B, Mansouri S. Effect of iron on expression of efflux pump (adeABC) and quorum sensing (luxI, luxR) genes in clinical isolates of Acinetobacter baumannii. APMIS. 2015;123(11):959-68. [CrossRef]
- Goh HM, Beatson SA, Totsika M, et al. Molecular analysis of the Acinetobacter baumannii biofilm-associated protein. Appl Environ Microbiol. 2013;79(21):6535-43. [CrossRef]
- Sharma M, Sapkota J, Jha B, Mishra B, Bhatt CP. Biofilm formation and extended-spectrum beta-lactamase producer among Acinetobacter species isolated in a tertiary care hospital: a descriptive cross-sectional study. JNMA J Nepal Med Assoc. 2019;57(220):424-8. [CrossRef]
- Ranjbar R, Zayeri S, Afshar D. High frequency of adeA, adeB and adeC genes among Acinetobacter baumannii isolates. Iran J Public Health. 2020;49(8):1539-45. [CrossRef]
- Yoon EJ, Balloy V, Fiette L, Chignard M, Courvalin P, Grillot-Courvalin C. Contribution of the ade resistance-nodulation-cell division-type efflux pumps to fitness and pathogenesis of Acinetobacter baumannii. mBio. 2016;7(3):e00697-16. [CrossRef]
- Zarrilli R, Pournaras S, Giannouli M, Tsakris A. Global evolution of multidrug-resistant Acinetobacter baumannii clonal lineages. Int J Antimicrob Agents. 2013;41(1):11-9. [CrossRef]
- Wieczorek P, Sacha P, Czaban S, et al. Distribution of adeABC efflux system genes in genotypically diverse strains of clinical Acinetobacter baumannii. Diagn Microbiol Infect Dis. 2013;77(2):106-9. [CrossRef]