En Çok Okunanlar
Özet
Bu uzlaşı raporu, pnömoni hastalarında BioFire® FilmArray® Pnömoni Plus (PNplus) hızlı moleküler testinin klinik kullanımıyla ilgili güncel görüşleri sunmaktadır. Rapor çalışmaları kapsamında, pnömoni ile klinik deneyimi olan sekiz uzmandan oluşan hekim grubu alt solunum yolu infeksiyonlarında PNplus testinin kullanımı hakkında klinik pratikte sıkça karşılaşılan soruları belirledi ve bu sorulara yönelik ortak yanıtlar geliştirdi. Bu süreçte, en sık karşılaşılan bakterileri, virusları ve direnç genlerini saptayabilen PNplus hızlı moleküler sendromik testinin kullanımına ilişkin bir öneriler listesi oluşturuldu ve bu liste kurgusal klinik senaryolarla oluşturulmuş olgu örnekleri ile desteklenerek pnömoni tanısında kullanılabilecek bir algoritma önerisi sunuldu.
GİRİŞ
Pnömoni, yüksek mortalite oranı ve olumsuz hasta sonuçlarıyla seyredebilen ciddi bir infeksiyon hastalığıdır. Özellikle sağlık hizmeti ilişkili pnömonilerde mortalite oranının %60’lara kadar yükseldiği bilinmektedir (1,2). Pnömoni yönetiminde pratik yaklaşım; hastalığın türüne (örneğin toplumda edinilen, hastane ilişkili, ventilatör ilişkili olması vb.) ve çeşitli risk faktörlerine göre rehberlerde önerilen ampirik antimikrobiyal tedavinin başlanmasını ve alt solunum yolu örneklerinden elde edilen mikrobiyolojik tanı sonuçlarına göre tedavinin gerektiğinde yeniden düzenlenmesini içerir. Etkenin erken tanımlanması ve saptanan etkene yönelik tedaviye hızlı başlanması, pnömonide mortalitenin azalması ile ilişkili bulunmuştur (3-5).
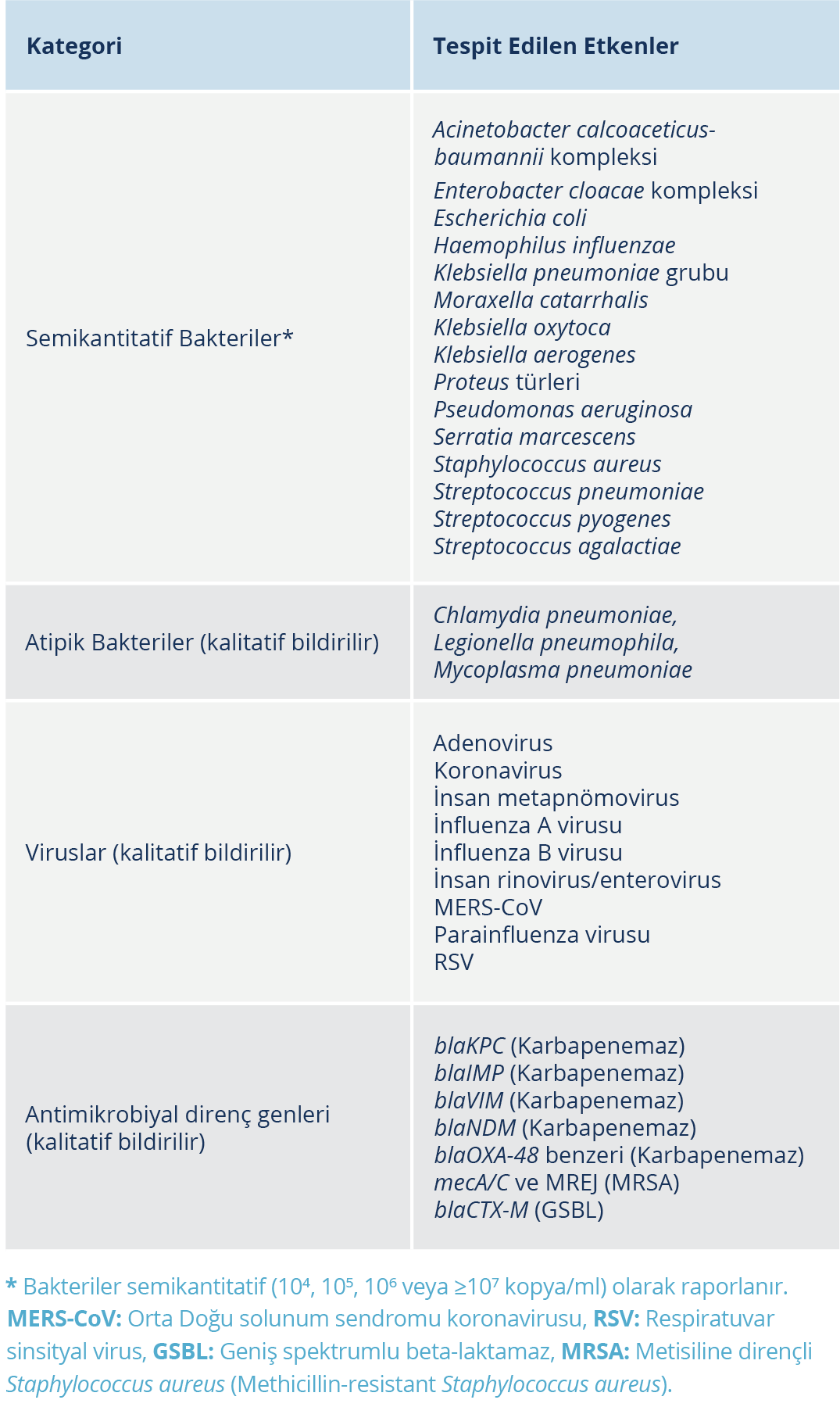
Tablo 1. BioFire® FilmArray® Pnömoni Plus Paneli Kapsamında Yer Alan Patojenler ve Direnç Genleri (5,6)
Son yıllarda, alt solunum yolu örneklerinden mikroorganizmaları hızlı bir şekilde tanımlamak için kullanılabilen multipleks polimeraz zincir reaksiyonu (PCR) tabanlı teknolojilerin geliştirilmesi sayesinde pnömoni tedavisinin hızlı ve hedefe yönelik yaklaşımla yönetimi mümkün olmuştur. Sendromik multipleks PCR panelleri arasında en yaygın olarak kullanılanlardan biri olan BioFire® FilmArray® Pnömoni Plus Paneli (PNplus) (bioMérieux, Marcy l’Etoile, Fransa) bu raporun odak noktasını oluşturdu ve panel içeriği Tablo 1’de sunuldu (6,7).
Gerek toplum kökenli gerekse hastane/ventilatör ilişkili pnömonilerde, bir saat gibi kısa bir süre içinde sonuç verebilen bu testler hastalığın erken tedavisinde optimizasyon sağlayabilirler (8-11). Literatürde, sendromik multipleks testler ile tanımlanan etkenin ampirik tedavi kapsamında yer almaması durumunda tedavinin daha geniş spektrumlu bir antimikrobiyale eskalasyonunun (8,9,12), ya da saptanan etkenin ampirik tedavinin daraltılmasına izin verdiği durumlarda de-eskalasyonunun (9,13) güvenle yapılabileceği gösterilmiştir.
Ayrıca, PNplus test sonuçları, temas izolasyonu kararlarının daha erken ve daha yüksek doğrulukla verilmesini sağlar (14). Özellikle çapraz infeksiyon riski ve direnç oranlarının yüksek seyrettiği merkezlerde temas izolasyonunun erken saptanması infeksiyon kontrolü için önemli bir avantaj sağlayabilir. Koronavirus hastalığı 2019 (COVID-19) pandemisi sürecinde PNplus kullanımının COVID-19 hastalarında gelişen bakteriyel süperinfeksiyonların yönetimine de katkı sağladığı bildirilmiştir (12,15,16). Henüz, maliyeti yüksek olan bu teknolojinin pnömoni için kapsamlı maliyet etkinlik çalışmaları yapılmamış olmakla birlikte, hastane yatış süresini kısaltması ve mikrobiyolojik tanının daha erken konulabilmesiyle gereksiz tetkik ve ilaç harcamalarından tasarruf sağlamasının mümkün olduğu raporlanmıştır (17,18).
YÖNTEMLER
Bu uzlaşı raporu, yetişkin ve çocuk infeksiyon hastalıkları ve klinik mikrobiyoloji, tıbbi mikrobiyoloji, göğüs hastalıkları ve anesteziyoloji ve reanimasyon/yoğun bakım uzmanlık alanlarından olan sekiz hekimin katılımıyla hazırlandı. Uzlaşı raporu fikri, bioMérieux Türkiye tarafından düzenlenen bir Danışma Kurulu Toplantısı’nda ortaya çıkmış olup çalışmalar toplantının hemen sonrasında başlatıldı. Çalışma sürecinde, alt solunum yolu infeksiyonlarında PNplus testinin kullanımıyla ilgili olarak klinik pratik kapsamında sorular belirledi ve bu sorulara verilen yanıtlar arasında fikir birliği sağlananlar rapora alındı. Her ne kadar panel sonuçlarının nihai yorumu olgu bazında değişebilecek olsa da PNplus testinin klinik değeri, uygun hasta seçimi ve testin klinik ortamlarda doğru şekilde kullanımı konusunda fikir birliğine varıldı. Üzerinde tamamen hemfikir olunan maddeler, testin uygulanma sürecine göre pre-analitik faz, analitik faz ve post-analitik faz başlıkları altında özetlendi ve bu maddeler kurgusal klinik senaryolarla oluşturulmuş olgu örnekleri ile desteklenerek pnömoni tanısında kullanılabilecek bir algoritma önerisi sunuldu.
Bu çalışma herhangi bir hasta verisi içermemekte olup Helsinki Bildirgesi ilkeleri ile uyumludur; dolayısıyla etik kurul onayı gerektirmemektedir.
PRE-ANALİTİK FAZ
PNplus testi hangi örneklerle çalışılır?
- Balgam,
- İndüklenmiş balgam,
- Endotrakeal aspirat (ETA),
- Bronkoalveolar lavaj (BAL).
PNplus testi hangi hastalarda kullanılmalıdır?
- Nozokomiyal pnömoni (hastane ilişkili pnömoni ve/veya ventilatör ilişkili pnömoni) şüphesi olan yoğun bakım ünitesi (YBÜ) hastaları,
- Çoklu ilaca dirençli (Multiple Drug Resistance, MDR) mikroorganizmalarla gelişen infeksiyon riski taşıyan hastalar veya hastanede yatan şiddetli toplumda gelişen pnömoni (TGP) olguları (19),
- Etkenin tanımlanmadığı ve standart ampirik tedaviye yanıt alınmayan TGP hastaları (11),
- Başka yöntemlerle etken saptanmış ancak hedefe yönelik antimikrobiyal tedaviye rağmen klinik yanıt alınamayan veya durumu kötüleşen TGP olguları,
- Pnömoni dışı nedenlere bağlı gelişen akut solunum sıkıntısı sendromu (Acute Respiratory Distress Syndrome, ARDS) ile pnömoni ayırıcı tanısı yapılmak istenen hastalar,
- Pnömoni şüphesi olan özel hasta grupları (immünsüprese hastalar, organ transplantasyonu geçirmiş hastalar, ciddi komorbiditeleri olan hastalar, vb.)
Hangi hasta gruplarında PNplus’tan yarar beklentisi diğer etken tanımlama yöntemlerinden daha yüksektir?
Literatürdeki çalışmalar göz önüne alındığında, PNplus testi aşağıda verilen durumlarda diğer etken saptama yöntemlerine göre daha yüksek bir klinik yarar beklentisi taşıyabilir:
- Viral ya da atipik bakteriyel etkenlerin saptanmasının önemli olduğu olgular (20),
- Konvansiyonel yöntemlerle saptanması zor ya da zaman alıcı olan etkenlerin araştırıldığı durumlar (13),
- Antibiyotik kullanım öyküsü olan olgular,
- Hızlı etken ya da direnç geni saptaması gereken kritik olgular (21),
- Temas izolasyonu kararının verilmesi gereken etkenlerin hızlı ve güvenilir bir şekilde saptanmasının gerektiği durumlar (14),
- Yüksek negatif prediktif değeri sayesinde tanıyı dışlama veya ayırıcı tanı yapma ihtiyacının ön planda olduğu olgular (22, 23)
- Yerel antimikrobiyal direnç paternlerine uygun olarak, panelde yer alan direnç genlerinin erken tanımlanması gereken olgular (Örneğin Türkiye’de Gram-negatif bakterilerde sık görülen yüksek karbapenemaz direnci),
- Viral ve bakteriyel koinfeksiyondan şüphelenilen ya da polimikrobiyal infeksiyon şüphesi olan olgular (12,15,16,24),
- Çoklu ilaca dirençli organizmalar ile infeksiyon şüphesi olan olgular (21),
- Başka yöntemlerle saptanan etkene yönelik antimikrobiyal tedaviye rağmen kötüleşen ve ek tanı testi ihtiyacı olan olgular.
PNplus sonuçlarının dikkatle yorumlanması gereken hasta grupları nelerdir?
Yapısal akciğer hastalığı, kistik fibrozis, bronşiektazi, interstisiyel akciğer hastalığı ve kronik obstrüktif akciğer hastalığı (KOAH) gibi sık alevlenme gösteren ve yoğun mikrobiyal kolonizasyona yatkın hasta gruplarında PNplus testinin klinik kullanımı dikkatli değerlendirilmelidir. Bu hastalarda testin klinik yararı olmakla birlikte panel sonuçlarının infeksiyon etkenini kolonizasyondan ayırt edebilme açısından dikkatli ele alınması gerekmektedir.
PNplus testini hangi hekimler isteyebilmelidir?
- Erişkin ve çocuk yoğun bakım uzmanları,
- Erişkin ve çocuk göğüs hastalıkları uzmanları,
- Erişkin ve çocuk infeksiyon hastalıkları uzmanları.
Ancak, kurumların kendi organizasyon yapılarına göre farklı branş uzmanlarının bu kapsamda tanımlanmış iş tanımları ve özel çalışma koşulları olabileceğinden kurumsal esneklik gözetilmelidir.
Bu panellerin kullanımı esnasında tanısal yönetişim stratejilerinin benimsenmesi, klinik ve laboratuvar disiplinlerinin birlikte çalışması ve test sonuçlarının birlikte değerlendirilmesi teşvik edilmelidir.
Örnek alımı ve gönderiminde dikkat edilmesi gereken hususlar nelerdir?
Kabul edilen örnek türleri aşağıda verilmiş olup bu örneklerin alınma yöntemleri Tablo 2’de sunuldu (25):
- Balgam,
- İndüklenmiş balgam,
- Endotrakeal aspirat (ETA) örnekleri,
- Bronkoalveolar lavaj (BAL) örnekleri,
- Mini-BAL örnekleri.
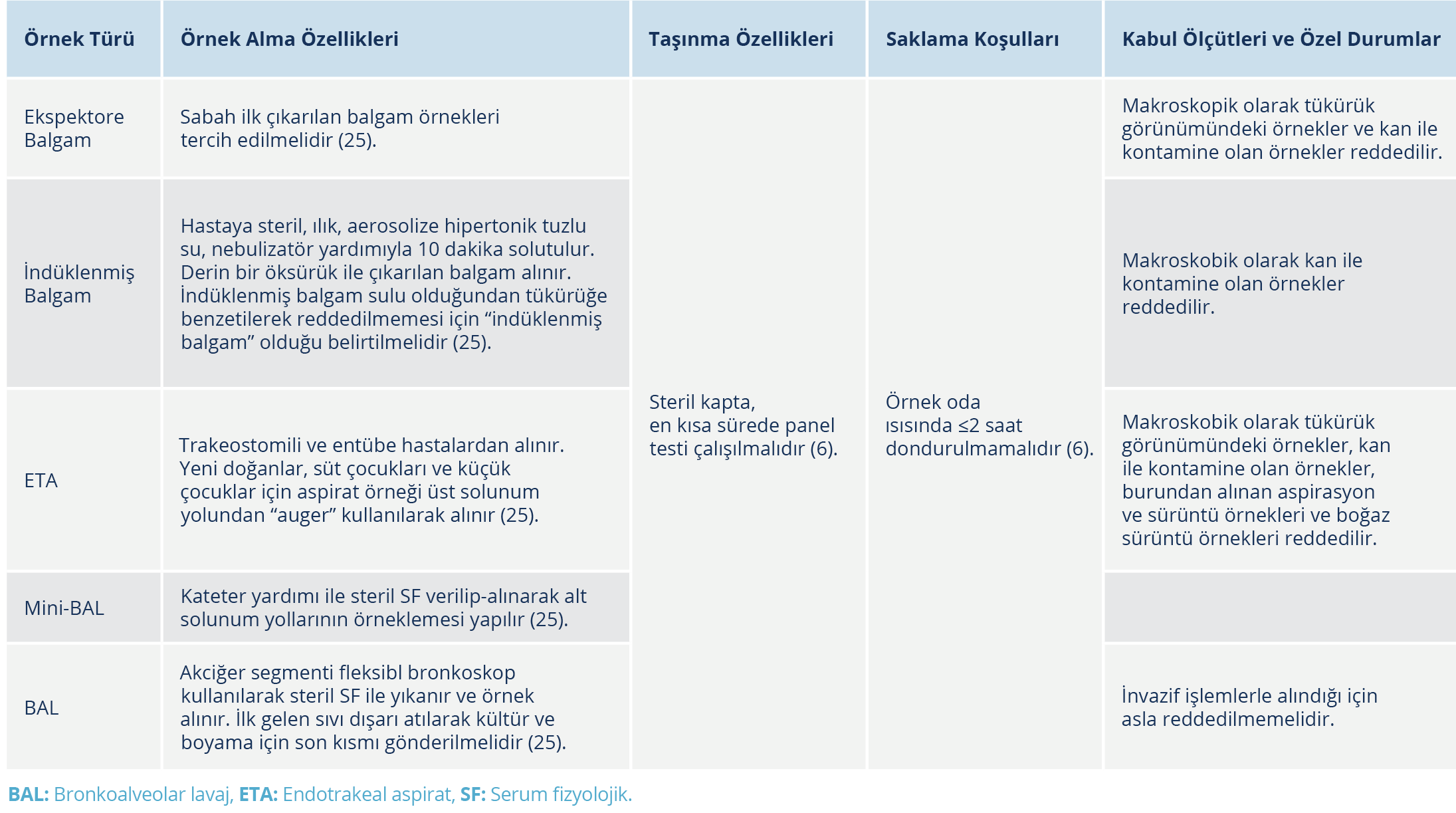
Tablo 2. Alt Solunum Yolu Örneklerinin Alınması, Taşınması, Saklanması ve Laboratuvar Kabul/Red Ölçütleri
Diğer havayolu örneklerinde olduğu gibi, alınan örnek en kısa sürede laboratuvara ulaştırılmalı ve mümkünse elden teslim edilmelidir. Ulaşım esnasında zaman kaybı olmaması için mümkünse kurum içi bir takip sistemi oluşturulması önerilir. Laboratuvara iletilen örneklerle birlikte hastalara ait yeterli klinik bilgiler de mutlaka verilmelidir.
Aşağıda verilen örnekler ise kabul edilmeyen örnek türleridir:
- Burun ve nazofarengeal sürüntüler,
- Nazofarengeal aspirat ve yıkama sıvıları,
- Viral nükleik asit ekstraksiyon tamponu içinde gönderilen sürüntü örnekleri.
ANALİTİK FAZ
Laboratuvara kabul edilen örneklerin, Tablo 1’de sunulan kabul kriterlerine uygunluğu mutlaka kontrol edilmeli ve uygun olmayan örnekler reddedilmelidir. Örneklere eş zamanlı olarak Gram boyama ve kültür de yapılmalıdır. Gram boyama hem örnek kalitesinin değerlendirilmesi için hem de Gram pozitif/negatif mikroorganizma varlığı ve baskın türlerin değerlendirilmesi açısından önemlidir. Bu değerlendirmede, Bartlett skorlama sistemi temel alınır ve buna göre 100x büyütmede her mikroskop sahasında:
- Ortalama <10 epitel hücresi,
- >25 polimorfonükleer lökosit (PNL) içeren örnekler uygun/kaliteli örnek olarak kabul edilir (25).
Eğer Gram boyamada örnek mikrobiyolojik olarak kabul edilebilir özellikte değilse reddedilmeli ve panel testi yapılmadan önce kliniğe bilgi verilerek yeni/kaliteli bir örnek gönderilmesi istenmelidir. Ayrıca, tüm laboratuvar incelemeleri için balgam örneklerinin en pürülan kısmı seçilmelidir.
POST-ANALİTİK FAZ
PNplus testi pnömoni tanısında tek başına kullanılabilir mi? Bir test grubunun parçası olarak mı kullanılmalıdır?
PNplus testi, alt solunum yolu infeksiyonlarında en sık karşılaşılan bakterileri, virusları ve bakterilere ait direnç genlerini hızla tespit eden ve klinik değerlendirmenin bir parçası olarak kullanıldığında bakım standardını yükselten bir tanı testidir.
Ancak, PNplus test sonuçları, Gram boyama, kültür (alt solunum yolu örnekleri ve kan kültürleri), klinik biyobelirteç (C-reaktif protein, prokalsitonin, tam kan sayımı, vb.) ve diğer laboratuvar ve görüntüleme tetkiklerinin (Akciğer grafisi ve bilgisayarlı tomografi, vb.) sonuçları ile birlikte değerlendirilmelidir.
PNplus testi istendiğinde, muhakkak altın standart olarak kabul edilen Gram boyama ve kültür incelemeleri de eşzamanlı olarak istenmelidir.
Pnömonilerde PNplus test sonuçları nasıl yorumlanmalıdır?
PNplus testi; geniş hedef içeriği, hızlı sonuçlanma süresi ve yüksek negatif prediktif değeri nedeniyle özellikle seçilmiş hasta gruplarında daha uygun ve bilinçli bir antimikrobiyal tedavi kararı verilmesine olanak tanır. PNplus test sonucu, tedavi kararını doğru bir şekilde yorumlamak için hastanın klinik durumu, biyobelirteç sonuçları (beyaz küre, C-reaktif protein, prokalsitonin, vb), radyolojik görüntüleme sonuçları ve yerel antibiyogram verileri ile birlikte değerlendirilmelidir; test sonucunun alınmış olması, hastanın diğer tetkik sonuçlarının değerlendirilmesini engellememeli/ geciktirmemelidir.
Kültür temelli yöntemlerden elde edilen kantitatif sonuçlar (örneğin koloni oluşturan birim, KOB) ile nükleik asit amplifikasyon testlerinden (NAAT’lardan) elde edilen kantitatif sonuçlar [örneğin genom kopyası/ml) doğrudan birbirleriyle karşılaştırılabilir değildir. Literatürde, kültür temelli yöntemlerin sonuçlarıyla karşılaştırıldığında, PCR sonuçlarında daha yüksek semikantitatif değerlere doğru bir eğilim olduğu gösterilmiştir (18,26).
PNplus sonuçları ile kolonizan – etken ayrımı nasıl yapılır?
PNplus testi sonucunda bakteriyel hedef saptanan, direnç geni saptanmayan durumlar
Balgam ve ETA örneklerinde PNplus testi ile etken tespit edildiği halde etkenle ilgili direnç geni saptanmamışsa, tespit edilen etkenin klinik açıdan anlamlı kabul edilebilmesi için genom kopya sayısının en az 105 kopya/ml olması önerilir. Bazı hastaneler direnç geni tespit edilmeyen balgam ve ETA örneklerinde 105 genom kopya/ml’nin altındaki etkenleri raporlamazken, bazı hastaneler klinisyenlere açıklayıcı notlar ekleyerek bu sonucu raporlamaktadır. Bu nedenle mikrobiyoloji laboratuvarları ve klinik birimler arasında ortak karar süreçlerinin oluşturulması gereklidir. Her durumda, kültür ve antimikrobiyal duyarlılık testi sonuçlarının takibi önemlidir.
Kolonizasyon-etken ayrımının yapılmasında zorlanılan durumlar
Hem kültürün hem de moleküler yöntemlerin kolonizer-etken ayrımını net bir şekilde yapamadığını akılda tutmak önemlidir (27). Kolonizan ve etken ayrımı, panel test sonuçları ile birlikte olgunun klinik durumu da göz önünde bulundurularak yapılmalıdır.
PNplus sonucunda viral hedef saptanan durumlar
İmmünkompetan olgularda, saptanan viral hedef aktif etken olarak değerlendirilmelidir. Bununla birlikte, özellikle immünsüpresyon varlığında saptanan viral hedef, uzamış viral saçılıma da bağlı olabilir ve aktif infeksiyonu göstermeyebilir. İmmünsüprese hastalarda PCR ile saptanan ancak diğer yöntemlerle saptanamayan uzamış viral saçılım olduğu gösterilmiştir (28). Bu ve benzeri nedenlerle her olgunun laboratuvar sonucunun, hastanın klinik durumu ile birlikte değerlendirilmesi önerilir.
PNplus testinde hedef saptanan, ama kültür sonuçlarında aynı mikroorganizmanın üremediği durumlar
Moleküler testler, kültüre göre daha duyarlıdır ve düşük miktarlardaki veya antibiyotik kullanımı nedeniyle canlı olmayan organizmaların genetik materyalini tespit edebilir (13). PNplus paneli her zaman kültür ve fenotipik antibiyotik duyarlılık testleri ile birlikte kullanılmalıdır. Pozitif tespit edilen bir PNplus testi sonucuna negatif bir kültür sonucunun eşlik etmesi, klinik değerlendirme gerektirir. PNplus testinde saptanıp kültürde saptanmayan etken, Staphylococcus aureus, Haemophilus influenzae veya Pseudomonas aeruginosa gibi solunum yolunu sık kolonize ettiği bilinen bir mikroorganizmaysa ve genom kopya sayısı 105 kopya/ml eşiğinin altında ise bu sonucun kolonizasyona bağlı olma olasılığı klinik korelasyon ile değerlendirilmelidir (29). Klinik korelasyon olmaması durumunda negatif kültür sonucuna bağlı olarak antibiyotik de-eskalasyonu rehber önerileri doğrultusunda değerlendirilebilir (3).
PNplus testi, pnömonilerde sekonder bakteriyel infeksiyona tanı koyabilir mi veya tanıyı ekarte edebilir mi?
- İnfeksiyon ve solunum yolu kolonizasyonu arasındaki klinik ayrım güvenilir bir şekilde yapıldığı sürece, panelde tespit edilen yeni bir hedef, ek patojenlerin varlığına işaret eder (12).
- Panel testinde tespit edilen yeni bir bakteriyel patojen hedefi, hastanın klinik durumu ve diğer sonuçları ile uyumluysa ikincil bakteriyel infeksiyonun varlığını doğrular (15,16,24).
- Negatif bir panel test sonucu, klinik durumla birlikte yorumlanmalı ve panel dışı mikroorganizmalarla infeksiyon veya infeksiyon dışı olasılıklar göz önünde bulundurulmalıdır.
PNplus testi sonuçlarına göre antimikrobiyal tedavi düzenlenmeli midir? Nasıl?
- PNplus’tan elde edilen sonuç ile hastanın kliniği uyumlu ise, antimikrobiyal tedavi, panel test sonuçlarına göre düzenlenmelidir.
- PNplus testi sonuçlarına göre, başlanmış olan ampirik tedaviden daha geniş spektrumlu bir antibiyotik kullanılmasını gerektiren bir etken tespit edildiğinde, antimikrobiyal tedavinin eskalasyonu önerilir (8,9,14,23,30-33). Antimikrobiyal tedavi hakkındaki karar, yerel kılavuzlar, merkeze ait direnç profili ve kliniğin antibiyogram sonuçları dikkate alınarak verilmelidir.
- Direnç genleri tespit edildiğinde, etkenin dirençli olacağı öngörülen antibiyotiğin kesilmesi veya o antibiyotiği içermeyen başka bir rejime geçilmesi önerilir (8-10,13,23,30-33).
- PNplus test sonuçlarında, karbapenemaz veya geniş spektrumlu beta-laktamaz (GSBL) direnç genleri tespit edildiğinde, ilgili antibiyotiklerin çıkarılmasıyla antimikrobiyal tedavinin erken dönemde düzenlenmesi önerilir. Direnç sonucunun erken alınması, özellikle Gram-negatif patojenlerde önemli bir klinik avantajdır (23,30,32-35).
- PNplus test sonuçlarına göre antibiyotik de-eskalasyonu, hastanın klinik durumu, komorbiditeleri ve lokal antibiyogram göz önünde bulundurularak değerlendirilebilir.
-
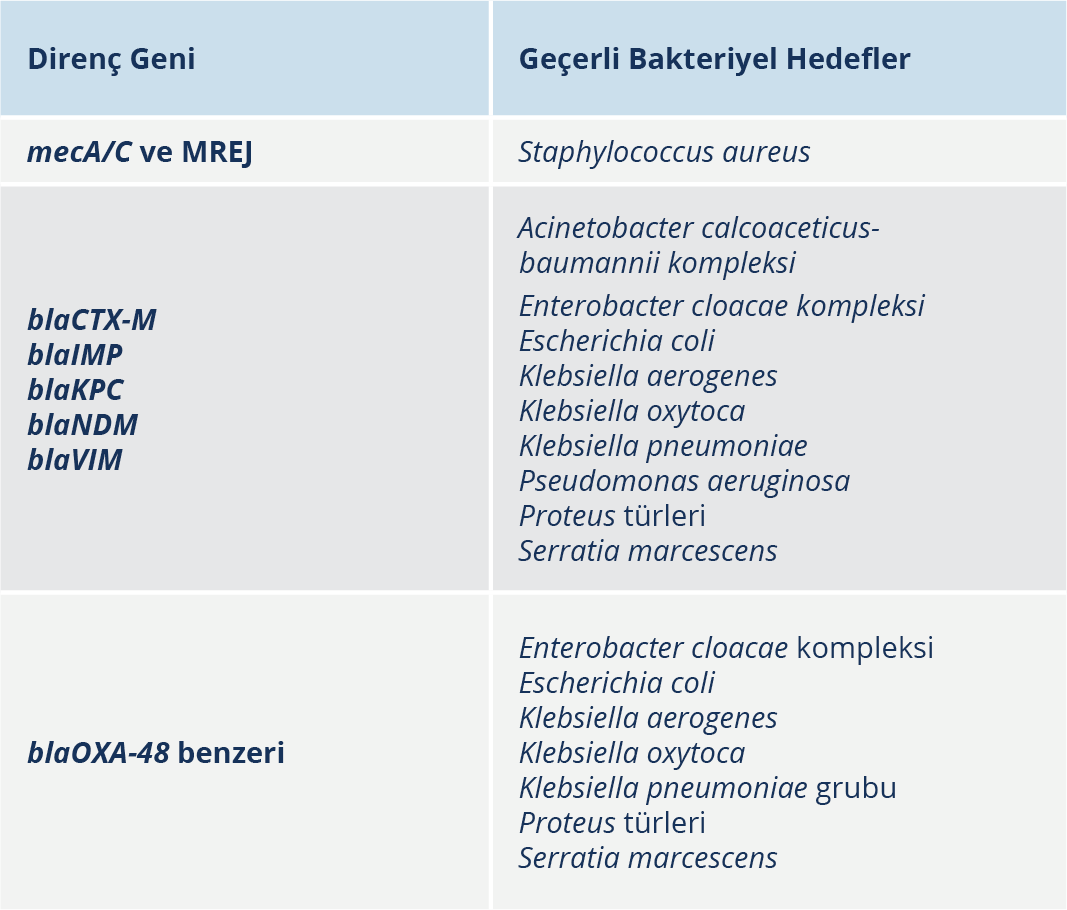
Tablo 3. BioFire® FilmArray® Pnömoni Plus Paneli Yer alan Antimikrobiyal Direnç Genleri ve Bu Genlerle İlişkili Saptanabilir Bakteri Türleri (6)
PNplus testinin, metisiline dirençli Staphylococcus aureus (Methicillin-resistant Staphylococcus aureus, MRSA) için negatif öngörü değeri çok yüksektir. Panelde, “mecA/C ve MREJ” direnç geni ve S. aureus’un birlikte tespiti, MRSA belirtecidir; MRSA tespit edilmemesi, vankomisin tedavisinin gerekli olmadığına dair güçlü bir yönlendirici sonuçtur (7,31,36).
- PNplus’ta saptanan antimikrobiyal direnç genleri, onlarla ilişkili bakteriler ile ilişkilendirilmiştir (Tablo 3). Her bir antimikrobiyal direnç geni sonucu üç farklı şekilde raporlanabilir:
Detected (Tespit Edildi) – Geçerli bakteri saptandığında VE antimikrobiyal direnç geni pozitifse.
Not Detected (Tespit Edilmedi) – Geçerli bakteri saptandığında VE antimikrobiyal direnç geni negatifse.
N/A (Yok) – Antimikrobiyal direnç geni sonucundan bağımsız olarak geçerli bakteriler saptanmadığında (7).
Bir direnç geni saptandığında, çoğunlukla bu direnç genini taşıyabilecek bakteriyel etken de saptanmaktadır. Ancak, nadir de olsa direnç geni pozitif saptanıp bu direnç geniyle ilgili bakteriler saptanmadığı zaman, direnç geninin sonucu “N/A” şeklinde raporlanmaktadır. Bu durumda, panel dışı bir bakterinin etken olabileceği göz önünde bulundurulmalı ve kültür sonuçları takip edilmelidir.
- CTX-M, KPC, IMP, NDM, VIM ve OXA-48 benzeri direnç genleri, Enterobacteriaceae türleri ve P. aeruginosa’da bulunan beta-laktamaz ve karbapenemaz genleridir. Bunların saptanması durumunda, antibiyoterapide karbapenem dışındaki seçenekleri içeren eskalasyon önerilir. Bu genlerin saptanmaması durumunda ise özellikle P. aeruginosa için diğer direnç mekanizmalarının varlığının dışlanamayacağı unutulmamalı, antimikrobiyal duyarlılık test sonuçları takip edilmelidir (27,29).
- Halihazırda geniş spektrumlu bir antibiyotik almakta olan hastalarda, PNplus panel sonuçları, direnç genlerini tespit etmek, hızlı antimikrobiyal yönetim ve gerekirse hızlı temas izolasyonu için de kullanılmalıdır.
- Etkeni belirlenmiş ve buna yönelik tedavi başlanmış olan hastanın tedavi yanıtı değerlendirmesinde PNplus testinin tekrarlanması doğru bir yaklaşım değildir. Test sadece hızlı tanı için kullanılmalı, klinik prognoz, tedaviye yanıtın değerlendirilmesi veya iyileşmenin takibi için bir kontrol aracı olarak kullanılmamalıdır.
İLERİ ARAŞTIRMALAR İÇİN UYGUN ALANLAR
Zhang ve arkadaşları (37), yoğun bakım ünitesinde izlenen, ağır pnömoni ve akut solunum yetmezliği bulunan hastalarda alt solunum yolu örneklerinden yapılan PNplus testinin kullanımının mortalite oranını düşürmede etkili olmadığını, ancak yüksek APACHE-II skoru ve kanser öyküsü gibi faktörlerin mortalite için bağımsız risk faktörleri olduğunu bildirmişlerdir (37). Bu çalışmada, pnömoni tanısında PNplus kullanımının mortalite oranını düşürmede etkili olmamasının nedenleri arasında, hastaların %28.9’unda malignite geçmişi olmasının yanı sıra ortalama APACHE-II ve SOFA skorlarının yüksek olması yer almaktadır. PNplus kullanımının klinik sonuçlar ve mortalite üzerindeki etkisini daha derinlikli değerlendirmek için farklı hasta gruplarında yapılan klinik çalışmalara ihtiyaç vardır.
Virk ve arkadaşları (38), hastanede yatan ve pnömoni şüphesi olan hastalarda PNplus panelinin kullanımının klinik sonuçlarını rutin tetkiklerin klinik sonuçlarıyla karşılaştırdıkları tek merkezli, açık etiketli, pragmatik, randomize kontrollü çalışmalarında, panel kullanımının antibiyotik de-eskalasyonu oranı ve de-eskalasyona kadar geçen zamanda anlamlı fark yaratmadığını gözlemlemişlerdir (38). Bu bulgunun, çalışmanın kısıtlılıkları arasında belirtildiği gibi, hastaların yarıdan fazlasında pnömoni dışında ek infeksiyonların bulunmasından kaynaklanabileceği düşünülmektedir. Öte yanda, özellikle Gram-negatif bakteri etkenli pnömonilerde ampirik antibiyoterapinin de-eskalasyonunun her zaman mikrobiyolojik saptama ile paralel gerçekleşmediği gösterilmiştir (39). Hatta bir çalışmada, üç yıl boyunca hastanede yatan hastane ilişkili pnömoni (HİP) hastalarının sadece %28.3’ünde antibiyotik de-eskalasyonu yapıldığı bildirilmiştir (40). Bu bulgular, güvenli antibiyotik de-eskalasyonunun mikrobiyolojik saptamalarla ve diğer klinik faktörlerle ilişkisini inceleyen ek çalışmalara ihtiyaç duyulduğunu göstermektedir.
OLGU ÖRNEKLERİ VE YORUMLARI
Olgu 1
32 yaşında kadın hasta, ateş ve öksürük şikâyetiyle başvurdu. Son dozu iki hafta önce uygulanmış olan over karsinomu nedeniyle kemoterapi almaktaydı. Genel durum bozukluğu, solunum yetmezliği ve bilateral infiltratlar nedeniyle entübe edildi. Ampirik sefepim, vankomisin ve oseltamivir başlandı. Alınan BAL örneğinin Gram boyamasında çok sayıda polimorfonükleer lökosit ve Gram-negatif kokobasiller görüldü. Aynı örnekten çalışılan PNplus testi “Haemophilus influenza pozitif, 104 genom kopya/ml” şeklinde sonuçlandı ve BAL kültürleri negatif kaldı.
Yorum: Olgu 1, immünsüprese olmasıyla ve MRSA ayrımın önemli olduğu bir klinik durumla, PNplus testinden yararlanma olasılığı yüksek olan bir hastayı temsil etmektedir. PNplus sonucunun MRSA’yı dışlaması sayesinde bu olguda glikopeptidlerin başlanmaması veya erken kesilmesi söz konusu olabilir. İmmünsüpresyon riski altında olan bu hastada muhtemelen H. influenza sonucu gerçek patojen olarak değerlendirilecektir; ancak immünkompetan bir olguda PNplus sonucunun yorumlaması farklı olabilirdi.
Olgu 2
57 yaşında erkek hasta, ateş, dispne, göğüs ağrısı ve miyalji şikâyetleriyle başvurdu. Özgeçmişinde diabetes mellitus, iki ay önce geçirilmiş femur fraktürüne bağlı operasyon ve hastane yatışı öyküsü vardı. Hızlı SARS-COV-2 antijen testi pozitifti ve görüntülemede bilateral buzlu cam tarzı infiltratları saptandı. Hasta SARS-COV-2 pnömonisi tanısıyla yatırıldı. Yatışının 3. gününde klinik durumu hızla kötüleşti ve entübe edildi. Transfer edildiği yoğun bakım ünitesinde alınan endotrakeal aspirat örneğinin Gram boyamasında x100 büyütmede >25 polimorfonükleer lökosit, <10 epitel hücresi ve x1000 büyütmede Gram-negatif çomaklar görüldü. Aynı örnekten çalışılan PNplus testi “P. aeruginosa pozitif, 107 genom kopya sayısı/ml ve NDM direnç geni pozitif” şeklinde sonuçlandı. Endotrakeal aspirat kültüründe 24 saat inkübasyon sonunda >105 KOB/ml P. aeruginosa üremesi izlendi.
Yorum: Olgu 2, MDR etkenlerle infeksiyon gelişme riski olan bir hastayı temsil etmekte olup PNplus’tan yararlanma olasılığı yüksektir. PNplus sonucunun, NDM direnç geninin işaret ettiği karbapenem direncinin varlığını göstermesi sayesinde, MDR ya da zor tedavi edilebilir direnç (Difficult-to-Treat Resistance, DTR) P. aeruginosa izolatlarında kullanılabilecek antimikrobiyal ajanlar arasında hızlı seçim yapılmasına olanak sağlayabilir.
Olgu 3
24 yaşında erkek hasta, ani gelişen solunum yetmezliği ile başvurdu. Özgeçmişinde obezite dışında özellik yoktu. Sağ akciğer bazalinde ince raller, bilateral ronkus ve görüntülemede bilateral masif alveolar infiltrasyon saptandı. Hasta, ARDS tanısı ile entübe edildi ve ampirik sefotaksim, teikoplanin, klaritromisin ve oseltamivir tedavisi başlandı. Alınan BAL örneğinin Gram boyamasında çok sayıda polimorfonükleer lökosit ve Gram-pozitif koklar görüldü. Aynı örnekten çalışılan PNplus testi, “İnsan metapnömovirus (Human metapneumovirus, HMPV) pozitif” olarak sonuçlandı. Hastanın antimikrobiyal tedavisi değiştirildi. Yapılan BAL kültüründe <103 KOB/ml alfa-hemolitik streptokok üremesi izlendi.
Yorum: Olgu 3, genç-erişkin ve altta yatan risk faktörü olmayan bir hastada, olası S. aureus infeksiyonunun dışlanması ve viral etkenin hızlı bir şekilde tanımlaması açısından PNplus testinden yüksek düzeyde yarar sağlanabilecek bir hastayı temsil etmektedir. Bu hastaya benzer etiyolojideki viral pnömoni olgularında görüntüleme bulgularının her zaman klinisyene yeterli veri sağlamadığı söylenebilir (36). Sonuç olarak, bu olgu PNplus testi sayesinde etken hedefli tedavinin hızla başlanmasına ve olası çok sayıda ampirik antibiyotik tedavisinden kaçınılmasına örnek oluşturabilecek bir hasta örneğidir.
Olgu 4
42 yaşında erkek hasta, 10 gün önce başlayan üst solunum yolu infeksiyonu belirtileri, halsizlik bulantı, kusma, 39–40°C üzerinde ateş, halsizlik, öksürük ve giderek artan kas zafiyeti ile acile başvurdu. Anamnezinde akciğer infeksiyonu düşünülerek amoksisilin klavulanik asit ile antibiyoterapiye başlandı; ancak kliniği kötüleşmeye devam etti. Hastada ciddi pnömoni ve pnömoninin tetiklediği akut myastenik sendrom düşünüldü ve plazmaferez planı yapılarak nöroloji servisine alındı. Bilateral yaygın infiltrasyon saptanan hastaya uygulanan moleküler testlerde (SARS-CoV-2, influenza A, influenza B, RSV A/B, adenovirus PCR) etken saptanmadı. Takibinde aynı gün akut solunum yetmezliği gelişti ve entübe edilerek yoğun bakıma alınan hastaya mekanik ventilatör desteği başlatıldı. Sefaperazon-sulbaktam tedavisi başlandı ve plazmaferez planlandı. Entübasyon sonrası, derin trakeal aspirat örneğinden Gram boyama, kültür ve antibiyogram ile eş zamanlı olarak PNplus testi yapıldı. Test sonucunda etken olarak, Legionella pneumophilla saptandığı yoğun bakım uzmanına bildirildi. Bu bağlamda, beta-laktam grubu antibiyotik tedavisi kesilerek moksifloksasin tedavisine başlandı. Takipte alınan derin trakeal aspirat kültür sonucunda, boyalı mikroskobik incelemede x100 büyütmede >25 polimorfonükleer lökosit, 10–20 epitel hücresi izlendi, ancak kültürde herhangi bir üreme saptanmadı.
Yorum: Şiddetli klinik tablo ile seyreden atipik pnömoni hastalarında, geleneksel yöntemlerle tanımlanması daha uzun ve zor olan etkenlerin erken saptanması hayati öneme sahiptir. Olgu 4, PNplus testinin hızlı sonuç vermesi sayesinde, uygun tedavinin gecikmeden başlanmasına ve hedefe yönelik antibiyotik seçiminin yapılmasına olanak sağlayan ve bu sayede uygun olmayan tedavinin önlendiği, maliyet ve morbiditenin azaltılabildiği bir klinik duruma örnektir.
ALGORİTMA ÖNERİSİ
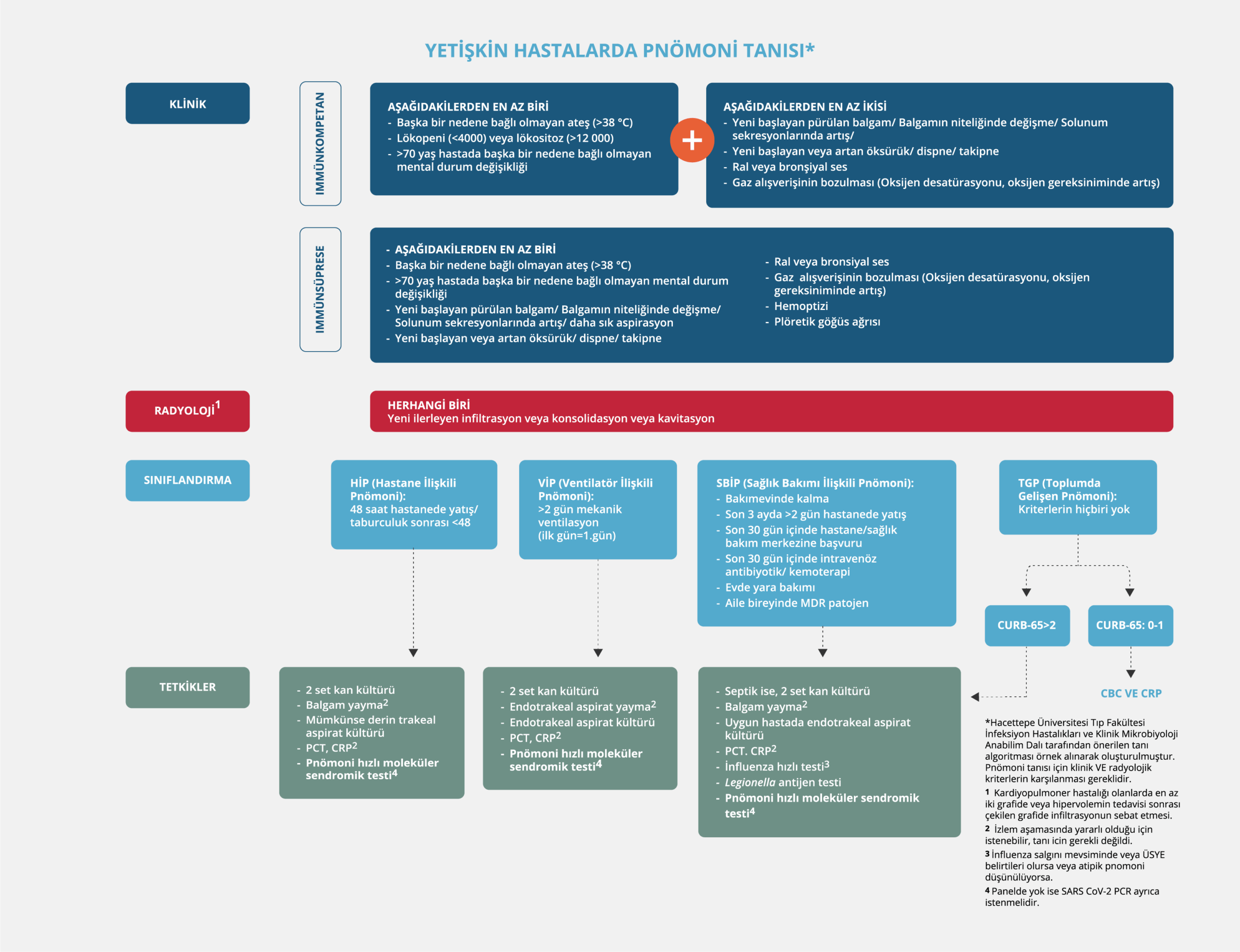
Bu raporunun yazarları, erişkin hastalarda pnömoni tanısına yönelik Hacettepe Üniversitesi Tıp Fakültesi İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı tarafından önerilen tanı algoritmasından ilham alarak, pnömonilerde etken saptama yöntemi olarak aşağıda önerilen algoritmayı geliştirdi (Şekil 1) (41).
SONUÇ
Hızlı sendromik moleküler testler, pnömonilerin yönetiminde devrim yaratmış ve önemli bir avantaj haline gelmiştir. Bu testler, konvansiyonel etken saptama yöntemlerine kıyasla sonuçlanma süresini önemli ölçüde kısaltmakta, kritik durumlarda erken ve hedefe yönelik tedavi başlanmasını sağlamakta ve gelişmiş infeksiyon yönetimini mümkün kılmaktadır. Bu testlerden beklenen potansiyel yararların artırılabilmesi için standart tanı ve tedavi algoritmalarının geliştirilmesine ve daha fazla sayıda maliyet etkinlik çalışmalarına ihtiyaç vardır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Hasta Onamı
Rapor kurgusal klinik senaryolarla oluşturulmuş olgu örnekleri ile hazırlandığı için onam alınmamıştır.
Etik Kurul Kararı
Bu çalışma herhangi bir hasta verisi içermediği için etik kurul onayı
alınmamıştır.
Yazar Katkıları
Fikir/Kavram – E.D.Ç., Ö.E., İ.D.; Tasarım – E.D.Ç., C.Ç., Z.C.K., M.A.; Denetleme – E.D.Ç.; Veri Toplama ve/veya İşleme – E.D.Ç.; Analiz ve/veya Yorum – Z.C.K., C.Ç., M.A., T.U., Ö.E., N.Ş., İ.D., B.E.; Literatür Taraması – E.D.Ç., B.E.; Makale Yazımı – E.D.Ç., C.Ç., Z.C.K., M.A., N.Ş., T.U.; Eleştirel İnceleme – Z.C.K., C.Ç., M.A., T.U., Ö.E., N.Ş., İ.D., B.E.
Çıkar Çatışması
Rapor, bioMérieux Türkiye tarafından desteklenen bir danışma kurulu toplantısı sonrasında bağımsız uzman görüşleri doğrultusunda oluşturulmuş olup yazarlar herhangi bir mali çıkar çatışması olmadığını beyan etmiştir.
Finansal Destek
Yazarlar finansal destek beyan etmemiştir.
Referanslar
- Aydın M, Azak E, Bilgin H, et al. Changes in antimicrobial resistance and outcomes of health care-associated infections. Eur J Clin Microbiol Infect Dis. 2021;40(8):1737-42. [CrossRef]
- GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015;385(9963):117-71. [CrossRef]
- Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61-e111. Erratum in: Clin Infect Dis. 2017;64(9):1298. Erratum in: Clin Infect Dis. 2017;65(8):1435. Erratum in: Clin Infect Dis. 2017;65(12):2161. [CrossRef]
- Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165(7):867-903. [CrossRef]
- Garau J, Baquero F, Pérez-Trallero E, et al; NACER Group. Factors impacting on length of stay and mortality of community-acquired pneumonia. Clin Microbiol Infect. 2008;14(4):322-9. [CrossRef]
- BIOFIRE® FILMARRAY® Pneumonia (PN) Panel product information [Internet]. Marcy-l’Étoile: bioMérieux. [erişim 13 Ağustos 2024]. https://www.biomerieux.com/us/en/our-offer/clinical-products/biofire-pneumonia-panel.html
- BIOFIRE® FILMARRAY® Pneumonia (PN) Panel Türkçe kullanım kılavuzu [Internet]. Marcy-l’Étoile: bioMérieux. [erişim 13 Ağustos 2024]. https://www.biomerieux.com/corp/en/our-offer/clinical-products/biofire-filmarray-pneumonia-panels.html
- Yoo IY, Huh K, Shim HJ, et al. Evaluation of the BioFire FilmArray Pneumonia Panel for rapid detection of respiratory bacterial pathogens and antibiotic resistance genes in sputum and endotracheal aspirate specimens. Int J Infect Dis. 2020;95:326-31. [CrossRef]
- Monard C, Pehlivan J, Auger G, et al; ADAPT study group. Multicenter evaluation of a syndromic rapid multiplex PCR test for early adaptation of antimicrobial therapy in adult patients with pneumonia. Crit Care. 2020;24(1):434. [CrossRef]
- Faron ML, Buchan BW, Ledeboer NA. Clinical evaluation and potential impact of a semi-quantitative multiplex molecular assay for the identification of pathogenic bacteria and viruses in lower respiratory specimens [poster presentation]. Presented at: American Thoracic Society Conference; 2018 May 20; San Diego, CA. https://www.biofiredx.com/wp-content/uploads/2018/08/Faron-M-et-al.-CVS.-2017..pdf
- Markussen DL, Serigstad S, Ritz C, et al. Diagnostic stewardship in community-acquired pneumonia with syndromic molecular testing: A randomized clinical trial. JAMA Netw Open. 2024;7(3):e240830. Erratum in: JAMA Netw Open. 2025;8(4):e258665. [CrossRef]
- Verroken A, Scohy A, Gérard L, Wittebole X, Collienne C, Laterre PF. Co-infections in COVID-19 critically ill and antibiotic management: a prospective cohort analysis. Crit Care. 2020;24(1):410. [CrossRef]
- Zacharioudakis IM, Zervou FN, Dubrovskaya Y, Inglima K, See B, Aguero-Rosenfeld M. Evaluation of a multiplex PCR Panel for the microbiological diagnosis of pneumonia in hospitalized patients: Experience from an Academic Medical Center. Int J Infect Dis. 2021;104:354-60. [CrossRef]
- Edin A, Eilers H, Allard A. Evaluation of the Biofire Filmarray Pneumonia panel plus for lower respiratory tract infections. Infect Dis (Lond). 2020;52(7):479-88. [CrossRef]
- Dhesi Z, Enne VI, Brealey D. Organisms causing secondary pneumonias in COVID-19 patients at 5 UK ICUs as detected with the FilmArray® test [preprint]. medRxiv. 2020 Jun 23 [erişim 13 Ağustos 2024]. [CrossRef]
- Maataoui N, Chemali L, Patrier J, et al. Impact of rapid multiplex PCR on management of antibiotic therapy in COVID-19-positive patients hospitalized in intensive care unit. Eur J Clin Microbiol Infect Dis. 2021;40(10):2227-34. [CrossRef]
- Gilbert DN, Leggett JE, Wang L, et al. Enhanced Detection of Community-Acquired Pneumonia Pathogens With the BioFire® Pneumonia FilmArray® Panel. Diagn Microbiol Infect Dis. 2021;99(3):115246. [CrossRef]
- Buchan BW, Windham S, Balada-Llasat JM, et al. Practical comparison of the BioFire FilmArray Pneumonia Panel to routine diagnostic methods and potential ımpact on antimicrobial stewardship in adult hospitalized patients with lower respiratory tract infections. J Clin Microbiol. 2020;58(7):e00135-20. [CrossRef]
- Siegel JD, Rhinehart E, Jackson M, Chiarello L; Healthcare Infection Control Practices Advisory Committee. Management of multidrug-resistant organisms in healthcare settings [Internet]. Atlanta: Centers for Disease Control and Prevention (CDC); 2006. [güncelleme Ekim 2022; erişim 13 Ağustos 2024]. https://www.cdc.gov/infection-control/hcp/mdro-management/index.html
- Murphy CN, Fowler R, Balada-Llasat JM, et al. Multicenter evaluation of the BioFire FilmArray Pneumonia/Pneumonia Plus Panel for detection and quantification of agents of lower respiratory tract infection. J Clin Microbiol. 2020;58(7):e00128-20. [CrossRef]
- Webber DM, Wallace MA, Burnham CA, Anderson NW. Evaluation of the BioFire FilmArray Pneumonia Panel for detection of viral and bacterial pathogens in lower respiratory tract specimens in the setting of a tertiary care academic medical center. J Clin Microbiol. 2020;58(7):e00343-20. [CrossRef]
- Ginocchio CC, Garcia-Mondragon C, Mauerhofer B, Rindlisbacher C; and the EME Evaluation Program Collaborative. Multinational evaluation of the BioFire® FilmArray® Pneumonia plus Panel as compared to standard of care testing. Eur J Clin Microbiol Infect Dis. 2021;40(8):1609-22. [CrossRef]
- Verroken A, Favresse J, Anantharajah A, Rodriguez-Villalobos H, Wittebole X, Laterre PF. Optimized antibiotic management of critically ill patients with severe pneumonia following multiplex polymerase chain reaction testing: A prospective clinical exploratory trial. Antibiotics (Basel). 2024;13(1):67. [CrossRef]
- Winter R, Parvati I, Sugianli AK. Identification of community- and hospital-acquired pulmonary bacterial infection using culture and PCR panel in COVID-19. Indones J Clin Pathol Med Lab. 2024;30(2):153-8.
- Arıkan S; Klinik Mikrobiyoloji Uzmanlık Derneği (KLIMUD). Solunum sistemi örneklerinin laboratuvar incelemesi rehberi. 2nd ed. Ankara: KLIMUD; 2022. 72 p.
- Szymankiewicz MT, Szczepanska A, Stefaniuk E. Evaluation of the BioFire® FilmArray® Pneumonia plus Panel for detecting bacterial etiological agents of lower respiratory tract infections in an oncologic hospital. Comparison with conventional culture method. Pol J Microbiol. 2023;72(4):391-8. [CrossRef]
- Hanson KE, Azar MM, Banerjee R, et al. Molecular testing for acute respiratory tract infections: Clinical and diagnostic recommendations from the IDSA’s Diagnostics Committee. Clin Infect Dis. 2020;71(10):2744-51. [CrossRef]
- Richardson L, Brite J, Del Castillo M, et al. Comparison of respiratory virus shedding by conventional and molecular testing methods in patients with haematological malignancy. Clin Microbiol Infect. 2016;22(4):380.e1-e7. [CrossRef]
- University of Nebraska Medical Center. Guidance on use of the pneumonia panel for respiratory infections [Internet]. Omaha: University of Nebraska Medical Center. [erişim 25 Şubat 2025]. https://www.unmc.edu/intmed/_documents/id/asp/clinicpath-pneumonia-panel-guideline.pdf
- Chen CL, Tseng HY, Chen WC, et al. Application of a multiplex molecular pneumonia panel and real-world impact on antimicrobial stewardship among patients with hospital-acquired and ventilator-associated pneumonia in intensive care units. J Microbiol Immunol Infect. 2024;57(3):480-9. [CrossRef]
- Plattner AS, Lockowitz CR, Dumm R, Banerjee R, Newland JG, Same RG. Practice versus potential: The impact of the BioFire FilmArray Pneumonia Panel on antibiotic use in children. J Pediatric Infect Dis Soc. 2024;13(3):196-202. [CrossRef]
- Chambe E, Bortolotti P, Diesnis R, et al. Performance and impact on antibiotic prescriptions of a multiplex PCR in a real-life cohort of critically ill patients with suspected ventilated pneumonia: A retrospective monocentric observational study. Antibiotics (Basel). 2023;12(12):1646. [CrossRef]
- Bozan G, Kara Y, Kiral E, et al. Supporting clinical decisions with rapid molecular diagnostic pneumonia panel in pediatric intensive care unit: Single center experience in Turkiye. Microorganisms. 2023;11(10):2391. [CrossRef]
- Dalfino L, Stufano M, Bavaro DF, et al. Effectiveness of first-line therapy with old and novel antibiotics in ventilator-associated pneumonia caused by carbapenem-resistant Acinetobacter baumannii: A real life, prospective, observational, single-center study. Antibiotics (Basel). 2023;12(6):1048. [CrossRef]
- Gong J, Yang J, Liu L, et al. Evaluation and clinical practice of pathogens and antimicrobial resistance genes of BioFire FilmArray Pneumonia panel in lower respiratory tract infections. Infection. 2024;52(2):545-55. Erratum in: Infection. 2024;52(2):705. [CrossRef]
- Keske Ş, Gümüş T, Köymen T, Sandıkçı S, Tabak L, Ergönül Ö. Human metapneumovirus infection: Diagnostic impact of radiologic imaging. J Med Virol. 2019;91(6):958-62. [CrossRef]
- Zhang JH, Chou SF, Wang PH, et al. Optimizing patient outcomes in severe pneumonia: the role of multiplex PCR in the treatment of critically ill patients. Front Med (Lausanne). 2024;11:1391641. [CrossRef]
- Virk A, Strasburg AP, Kies KD, et al. Rapid multiplex PCR panel for pneumonia in hospitalised patients with suspected pneumonia in the USA: a single-centre, open-label, pragmatic, randomised controlled trial. Lancet Microbe. 2024;5(12):100928. [CrossRef]
- Bittmann MC, Micek ST, Kollef MH. Lack of pathogen identification influencing antibiotic de-escalation in hospital-acquired pneumonia. Antimicrob Steward Healthc Epidemiol. 2022;2(1):e181. [CrossRef]
- Madaras-Kelly K, Jones M, Remington R, et al. Antimicrobial de-escalation of treatment for healthcare-associated pneumonia within the Veterans Healthcare Administration. J Antimicrob Chemother. 2016;71(2):539-46. [CrossRef]
- Hacettepe Üniversitesi Tıp Fakültesi, Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı. Erişkinde pnömoni tanısı [Internet]. Ankara: Hacettepe Üniversitesi. [erişim 13 Ağustos 2024]. https://enfeksiyon.hacettepe.edu.tr/tr/menu/2pnomoni_-81