En Çok Okunanlar
Özet
Amaç: Bu çalışmada, ventilatör ilişkili pnömoni (VİP) etkeni olarak izole edilen Klebsiella pneumoniae ve Acinetobacter baumanii suşlarında biyofilm üretiminin ve bu suşların meropenem ve amikasine duyarlılıklarının farklı test yöntemleriyle değerlendirilmesi amaçlandı. Ayrıca biyofilm üretiminin agar bazlı antibiyotik duyarlılık testleri üzerindeki potansiyel etkisi de araştırıldı.
Yöntemler: Ekim 2019 – Haziran 2021 tarihleri arasında yoğun bakım ünitesinde takip edilmekteyken VİP tanısı alan hastalardan alınan trakeal aspirasyon örneklerinden izole edilen A. baumannii ve K. pneumoniae suşları, doku kültür plak metodu ile biyofilm üretimi açısından test edildi. Meropenem ve amikasine duyarlılıkları mikrodilüsyon, e-test ve disk difüzyon yöntemleriyle belirlendi; test sonuçları arasındaki uyum Kappa testi ile değerlendirildi.
Bulgular: Çalışmaya dahil edilen, 98 suşun 67’si A. baumanii, 31’i ise K. pneumoniae olarak tanımlandı. K. pneumoniae suşlarının tamamında, 67 A. baumanii suşlarının ise %83.6’sında biyofilm üretimi saptandı. K. pneumoniae olarak tanımlanan suşlarda biyofilm üretimi anlamlı düzeyde daha yüksek saptandı (p=0.015). Mikrodilüsyon yöntemiyle belirlenen direnç oranları A. baumannii suşlarında K. pneumoniae suşlarına göre meropenem (p=0.003) ve amikasin (p=0.042) için istatistiksel olarak anlamlı derecede daha yüksek bulundu. Biyofilm üretimi yapan 31 K. pneumoniae suşunda, e-test ve disk difüzyon yöntemleri ile mikrodilüsyon yöntemi karşılaştırıldığında, direnç oranları açısından meropenem için amikasine kıyasla daha yüksek bir uyum saptandı (meropenem kappa=0.71, amikasin kappa=0.32).
Sonuç: Çalışmamızda test edilen örnek sayısı sınırlı olmakla birlikte, biyofilm üreten K. pneumoniae suşlarında disk difüzyon, E-test ve mikrodilüsyon yöntemleri arasında meropenem için uyum saptandı. Ancak aynı uyum amikasin için gözlenmedi. Mikroorganizmaların agar yüzeyinde biyofilm benzeri yapılar oluşturması ve amikasinin hidrofilik yapısı nedeniyle bu yapıya yeterince penetre olamaması, test sonuçlarını etkileyen başlıca etkenlerden biri olarak değerlendirildi.
![]() Bu makaleye ilişkin bir düzeltme 24 Ekim 2025’de yayınlandı.
Bu makaleye ilişkin bir düzeltme 24 Ekim 2025’de yayınlandı.
GİRİŞ
Mikroorganizmalar serbest formdan farklılaşarak çok hücreli organizmaları taklit eden karmaşık biyofilm yapılarını oluşturmaktadır (1). Biyofilm tabakasının %85’ini matriks yapısı oluşturur. Bu matriks, mikroorganizmalar tarafından üretilen hücre dışı polimerik maddeler (Extracellular Polymeric Substances, EPSs) ve hücre dışı DNA partikülleri ile konağa ait immünglobulin ve pıhtılaşma faktörlerini içerir (1-3). Farklı çalışmalarda; yaş, cinsiyet, altta yatan komorbiditeler, kateterizasyon süresi, hastanede yatış süresi, mikroorganizmanın cinsi gibi faktörlerin biyofilm oluşumu ile ilişkisi değerlendirilmiştir (4,5). Entübasyon süresi ve mikroorganizma cinsinin biyofilm oluşumuna etkisi olduğu düşünülmekle birlikte risk faktörleri henüz net olarak tanımlanmamıştır (6-8).
Biyofilm yapısı, çeşitli mekanizmalarla antibiyotik direncine neden olmaktadır (1). Bu mekanizmalardan ilki biyofilm yapısının antibiyotik molekülüne karşı bir difüzyon bariyeri oluşturarak antibiyotiklerin mikroorganizmalara ulaşmasını engellemesidir (1). Çeşitli antimikrobiyallerin sentetik ve doğal aljinat tabakasından difüzyonunu inceleyen bir çalışmada, betalaktam grubu antibiyotiklerin aminoglikozidlere kıyasla aljinat tabakasını çok daha hızlı geçtiği saptanmıştır (9). Ayrıca biyofilm yapısı, mikroorganizmaların direnç genlerini aktarabilmesi için uygun ortam oluşturur. Biyofilm içinde mikroorganizmaların farklı büyüme paternleri nedeniyle bazı antibiyotiklere karşı minimum inhibitör konsantrasyon (MİK) değerinin 100–1000 kat arttığı gösterilmiştir (10,11). Biyofilm içerisindeki mikroorganizmaların tedavisinde kullanılabilecek standart MİK değeri henüz belirlenmemiştir (12).
Yoğun bakımda yatan hastalarda hem invazif girişimlerin sık uygulanması hem de hasta ilişkili risk faktörlerinin diğer hastalara kıyasla daha yüksek olması sağlık bakımı ilişkili infeksiyon riskini de artırmaktadır (13,14). Ventilatör ilişkili pnömoni (VİP), sağlık bakımı ilişkili olarak en sık karşılaşılan dört infeksiyon türünden biridir (15). Avrupa’da yapılan bir çalışmada, yoğun bakımlarda VİP prevalansı %20.6 olarak bildirilmiştir (16). Son yıllarda yabancı cisim ilişkili infeksiyonlar ve biyofilm yapısı üzerine yapılan araştırmalar sonucu, VİP gelişiminde endotrakeal tüp yüzeyinde biyofilm varlığı en önemli faktör olarak değerlendirilmektedir (10).
Mikroorganizmaların oluşturduğu biyofilm yapısı ilk olarak 1985 yılında gösterilmiştir. Yapılan çalışmada, medikal ekipman ilişkili infeksiyona sebep olan koagülaz negatif stafilokok suşları kültür plağında çoğaltılarak optik dansite ölçümü yapılmış; ölçülen optik dansite değerlerinin ekipman yüzeyindeki bakteriyel biyofilm ağırlığı ile korelasyon gösterdiği saptanmıştır (17). Christensen ve arkadaşları (17) tarafından geliştirilen doku kültür plak metodu, biyofilm varlığını kantitatif olarak değerlendirebilmesi nedeniyle farklı suşlarla modifiye edilerek birçok çalışmada referans test olarak kullanılmaktadır (18-20).
Bu çalışmada, VİP tanısı almış hastalardan izole edilen Acinetobacter baumannii ve Klebsiella pneumoniae suşlarının biyofilm üretimi ve farklı yöntemlerle meropenem ve amikasine duyarlılıklarının değerlendirilmesi amaçlandı. Ayrıca biyofilm üretimi ile ilişkili olabilecek risk faktörleri, farklı antibiyotik duyarlılık test sonuçları ve biyofilm üretim test sonuçları birlikte değerlendirilerek, biyofilm üretiminin agar bazlı antibiyotik duyarlılık test sonuçlarına etkisinin ortaya konulması hedeflendi.
YÖNTEMLER
Prospektif gözlemsel olarak planlanan çalışmaya, Ekim 2019–Haziran 2021 tarihleri arasında hastanemizin yoğun bakım ünitesinde (YBÜ’de) yatmakta iken infeksiyon hastalıkları hekiminin rutin vizitlerinde VİP tanısı alan ve tedavisi düzenlenen 18 yaş ve üzerindeki hastalar alındı; ventilatör ilişkili olay (VİO) saptanan hastalar çalışma dışında bırakıldı.
Çalışmaya alınan hastalar, trakeal aspirasyon kültürlerinde 105 cfu/ml ve üzerinde A. baumanii ve K. pneumoniae üremesi olanlardı. Trakeal aspirasyon dışında solunum yolu örneği alınan, trakeostomi ile ventile edilen ve değerlendirme sırasında akciğer dışı infeksiyon odağı bulunan hastalar ise çalışmaya dahil edilmedi.
Çalışma için Dokuz Eylül Üniversitesi Klinik Araştırmalar Etik Kurulu’ndan 12 Haziran 2019 tarih ve 2019/14-41 karar numarasıyla onay alındı.
Ventilatör İlişkili Pnömoni Tanısı
Ventilatör ilişkili pnömoni, endotrakeal entübasyondan 48 saat ve sonrasında gelişen pnömoni olarak tanımlanmış olup etkenin tespit edilmesi için trakeal aspirasyon kültürü yapılması önerilmektedir (21). Çalışmamız kapsamında, endotrakeal entübasyon sırasında pnömoni kliniği görülmeyen hastalarda, entübasyondan 48 saat ve sonrasında gelişen akciğer radyolojik bulguları ile birlikte aşağıdaki kriterlerden en az ikisinin olması durumu VİP olarak tanımlandı:
- Ateş yüksekliği veya hipotermi,
- Lökositoz veya lökopeni,
- Solunum sekresyonlarında artış,
- Solunum yolu örneği kültüründe klinik olarak anlamlı üreme.
İzolatların ve Hasta Verilerinin Toplanması
Ventilatör ilişkili pnömoni etkeni olarak belirlenen A. baumanii ve K. pneumoniae suşları pasajlanarak çalışma başlangıcına kadar -20°C’de boncuklu stok besiyeri (Orbak, Türkiye) içerisinde saklandı. Hastaların yedi günlük VİP epizodu ve 30 günlük izlemi kaydedildi. Hastaların demografik verileri ve risk faktörleri ise hastane kayıt sisteminden elde edildi. Toplanan veriler aşağıda sunuldu:
- Demografik veriler (yaş ve cinsiyet),
- Risk faktörleri [hastanede yatış süresi, invazif medikal ekipman kullanımı, cerrahi öyküsü, travma öyküsü, reentübasyon varlığı, VİP epizodu sırasında septik şok gelişimi, VİP epizodu sırasında akut solunum stres sendromu (Acute Respiratory Distress Syndrome, ARDS) gelişimi, VİP epizodu sırasında hemodiyaliz ihtiyacı, son 90 gün içinde antibiyoterapi öyküsü, altta yatan hastalıklar ve entübasyondan örnek alımına kadar geçen süre],
- Ventilatör ilişkili pnömoni epizodu ve 30 günlük hasta izlemi sonlanım bilgileri [mortalite, iyileşme, YBÜ yatış süresi (gün), hastanede yatış süresi (gün), ekstübasyona kadar geçen süre (gün)].
İzolatların Tanımlanması
-20°C’ de saklanan boncuklu stok besiyerlerinden tek boncuk alınarak kanlı agar (Becton Dickinson, Almanya) yüzeyine ekildi ve 35°C’de 24 saat inkübe edildi. Agar yüzeyinde elde edilen tek koloniler “matrix-assisted laser desorption ionization-time of flight mass spectrometry” (MALDI-TOF MS) (Biomerieux, Fransa) otomatize sistemiyle tanımlandı. Antimikrobiyal duyarlılık testleri için kontrol suşu olarak Escherichia coli ATCC25922 (12,20) ve biyofilm kontrol suşu olarak K. pneumoniae ATCC700603 (19,20) kullanıldı.
Doku Kültür Plak Metodu ile Biyofilm Üretiminin Belirlenmesi
Biyofilm üretimi, Christensen ve arkadaşları (17) tarafından 1985 yılında geliştirilen ve modifiye edilen yöntemle değerlendirildi. Kanlı agar yüzeyinde gelişen koloniden alınan örnek %1 glukoz içeren 5 ml “tryptic soy broth” besiyerine ekilerek 35°C’de 24 saat inkübe edildi. Ardından taze besiyeri ile 1/100 oranında dilüe edildi. Bu solüsyondan otomatik pipet yardımı ile mikroplaka kuyucuklarına 0.2 ml eklenerek 35°C’de 24 saat inkübasyona bırakıldı ve biyofilm oluşumu indüklendi. Mikroplaka kuyucuklarındaki sıvı nazikçe boşaltılarak fosfat tamponlu salin (pH 7.3) ile üç kez yıkandı. Metanol ile yapılan fiksasyonun ardından kuyucuklara oda ısısında 0.2 ml %0.1 kristal viyole çözeltisi eklenerek 15 dk boyandı. Kuyucuklardaki sıvı boşaltılarak glacial asetik asit ile fikse edildi.
ELISA cihazında (Thermo Fisher Scientific, ABD) 570 nm dalga boyunda absorbans ölçüldü ve her suş için üç kez ölçüm tekrarlanarak optik dansite (OD) değerlerinin ortalaması kaydedildi. Stepanović ve arkadaşlarının (22) önerdiği formüle uygun olarak, bakteri inokülasyonu yapılmayan negatif kontrol kuyucuklarının OD ölçüm değerlerinin ortalama değerine standart sapma değerinin üç katı eklenerek OD “cut-off” (ODc) değeri belirlendi. Her suşun OD ölçüm sonucu ODc ile karşılaştırılarak suşun biyofilm üretim kapasitesi tespit edildi; OD ortalaması ODc değerinden büyük olan suşlar biyofilm üreticisi olarak tanımlanırken, ODc değerinden küçük ve ODc değerine eşit ölçümler biyofilm negatif olarak sınıflandırıldı. Kullanılan formül aşağıda sunuldu:
ODc = Üç negatif kontrol kuyucuğunun OD ortalaması + (3 × standart sapma)
Antibiyotik Duyarlılıklarının Belirlenmesi
Disk Difüzyon Yöntemi
Mueller-Hinton agar (Becton Dickinson, Almanya) yüzeyine 0.5 McFarland yoğunluğundaki bakteri süspansiyonları yayılarak 6 mm çaplı kâğıt amikasin ve meropenem diskleri (Becton Dickinson, Almanya) yerleştirildi. İnhibisyon zonları Avrupa Antimikrobiyal Duyarlılık Testi Komitesi (European Committee on Antimicrobial Susceptibility Testing, EUCAST) standartlarına uygun olarak değerlendirildi (12,23).
E-test Yöntemi
Hazırlanan 0.5 McFarland yoğunluktaki bakteri süspansiyonları Mueller-Hinton agar (Becton Dickinson, Almanya) yüzeyine steril bir eküvyon yardımıyla tüm yüzeyi kaplayacak şekilde yayıldı. Agar yüzeyine meropenem ve amikasin antibiyotiklerinin belli konsantrasyonlarını içeren e-test şeritleri (Biomérieux, Fransa) yerleştirilerek 35°C’de 24 saat inkübe edildi. Şerit etrafında oluşan inhibisyon elipsinin şerit üzerindeki ölçekle kesiştiği nokta kaydedilerek belirlenen MİK değerleri EUCAST standartlarına uygun olarak değerlendirildi (12,23).
Mikrodilüsyon Yöntemi
Sıvı mikrodilüsyon yöntemiyle el ile 96 kuyucuklu U tabanlı mikroplaka kullanılarak çalışıldı. Üreticinin önerileri doğrultusunda meropenem (Biosynth Carbosynth, İngiltere) ve amikasin (Sigma Aldrich, ABD) etken maddeleri 100 mg tartılarak steril su ile çözüldü.
Aşağıda verilen formüle uygun olarak test edilecek konsantrasyonun 10 katı yoğunlukta stok çözeltisi hazırlandı ve hazırlanan stok solüsyonlar 0.1 ml hacminde ayrılarak steril Eppendorf tüpü içerisinde -80°C’de saklandı.
Sulandırıcı hacmi (V) = Antibiyotik ağırlığı (w) x Antibiyotik potensi / İstenilen konsantrasyon (P/c)
Stok solüsyon kullanılarak mikrodilüsyon plaklarındaki Mueller-Hinton buyyonunda seri dilüsyonlar hazırlandı (Meropenem için 1–1024 μg/ml, amikasin için 0.5–512 ug/ml). İlk kolon, üreme kontrol kuyucuğu olarak ayrıldı ve bu kolona antibiyotik solüsyonu eklenmedi. Tüm suşlardan 5×105 cfu/ml konsantrasyonda bakteri süspansiyonu hazırlandı. Hazırlanan bakteri süspansiyonu ilk kolondan başlanarak inoküle edildi. Sterilite kontrol kuyucuğu olan 12 numaralı kolona inokülasyon yapılmadı. Mikroplaka 35°C’de 16 saat inkübe edildi. Her satırda üremenin gözle görülebilir şekilde inhibe edildiği en düşük konsantrasyon MİK değeri olarak belirlendi ve EUCAST standartlarına uygun olarak değerlendirildi (12,23).
İstatistiksel Analizler
İstatistiksel analizler, SPSS (“Statistical Package for the Social Sciences”) versiyon 26.0 programı (IBM Corp., Armonk, NY, ABD) ile gerçekleştirildi. Çalışma verileri değerlendirilirken tanımlayıcı istatistiksel yöntemler (ortalama, standart sapma, medyan, frekans, oran, minimum, maksimum) kullanıldı. Nicel verilerin normal dağılıma uygunlukları Kolmogorov-Smirnov testi, Shapiro-Wilk testi ve grafiksel yöntemlerle değerlendirildi. Normal dağılım gösteren nicel verilerin iki grup karşılaştırmalarında bağımsız örneklem T testi, normal dağılım göstermeyen verilerin iki grup karşılaştırmalarında ise Mann-Whitney U testi uygulandı. Nitel verilerin karşılaştırılmasında ise Pearson χ² testi, Fisher Freeman Halton kesin testi ve Fisher kesin test kullanıldı. Tüm suşların disk difüzyon, e-test ve mikrodilüsyon yöntemleri ile meropenem ve amikasine direnç sonuçları arasındaki uyum McNemar testi, McNemar-Bowker testi ve Kappa uyum testi ile değerlendirildi. Anlamlılık düzeyi p<0.05 olarak kabul edildi.
BULGULAR
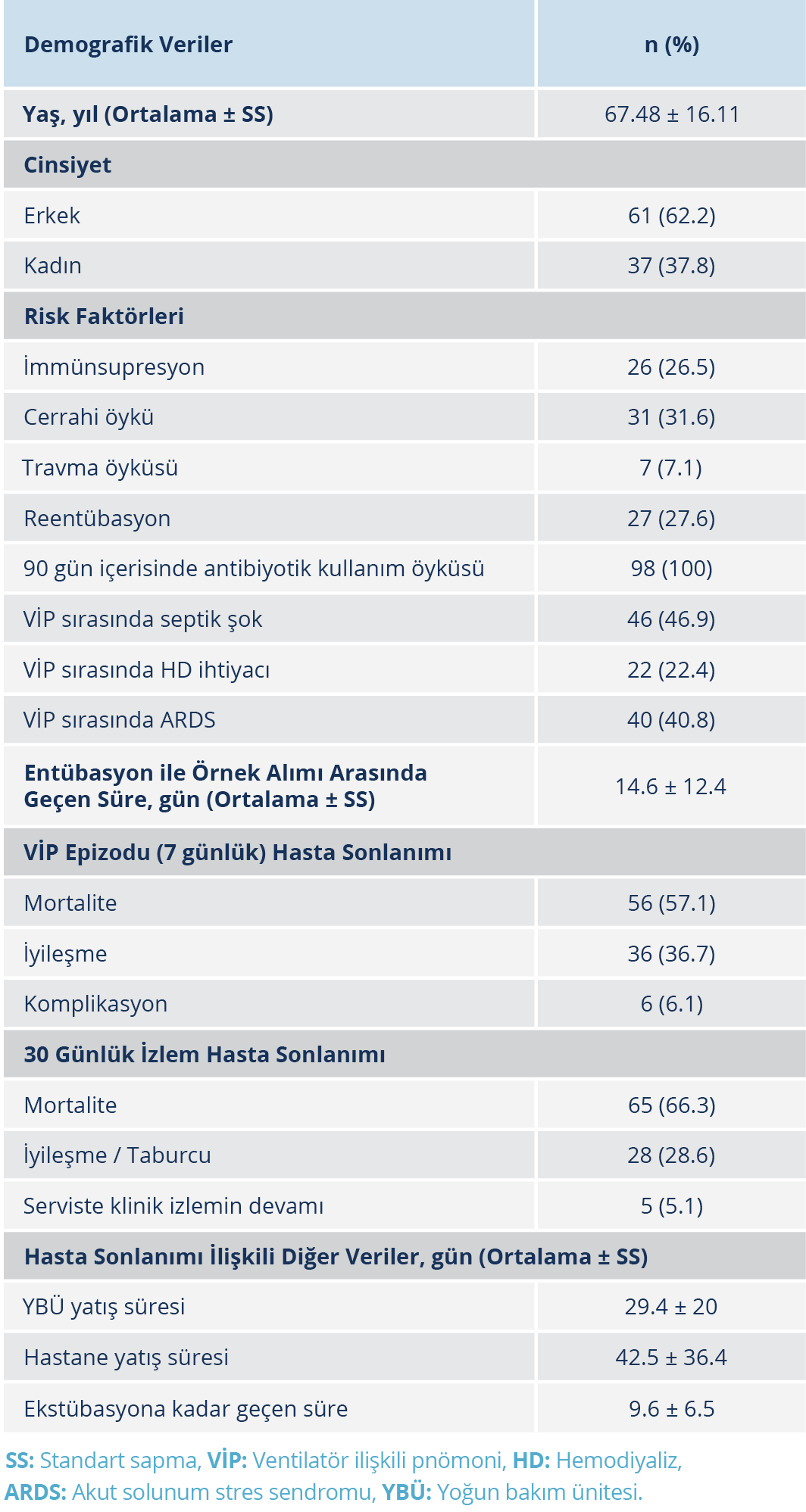
Çalışmaya alınan 98 hastanın 61(%62.2)’i erkek, 37 (%37.8)’si kadındı. Tüm hastaların yaş ortalaması 67.5 yıl olarak bulundu. Ventilatör ilişkili pnömoni epizodu öncesinde hastaların tamamında 90 gün içerisinde antibiyotik kullanım öyküsü mevcuttu. Otuz bir hastada cerrahi girişim öyküsü, 27 hastada reentübasyon, 26 hastada immünsupresyon, yedi hastada travma öyküsü vardı. Yedi günlük VİP epizodu sırasında hastaların 56’sı kaybedildi ve 36 hasta iyileşti; üç hastada bakteriyemi, iki hastada plevral efüzyon, bir hastada pnömotoraks olmak üzere altı hastada ise komplikasyon gelişti. Otuz günlük hasta izleminin sonunda hastaların 65’i kaybedilirken 28 hasta taburcu edildi. Otuz günlük sürenin sonunda beş hastanın klinik izlemi serviste devam etmekteydi. Hastaların demografik verileri, risk faktörleri ve sonlanım bilgileri Tablo 1’de sunuldu.
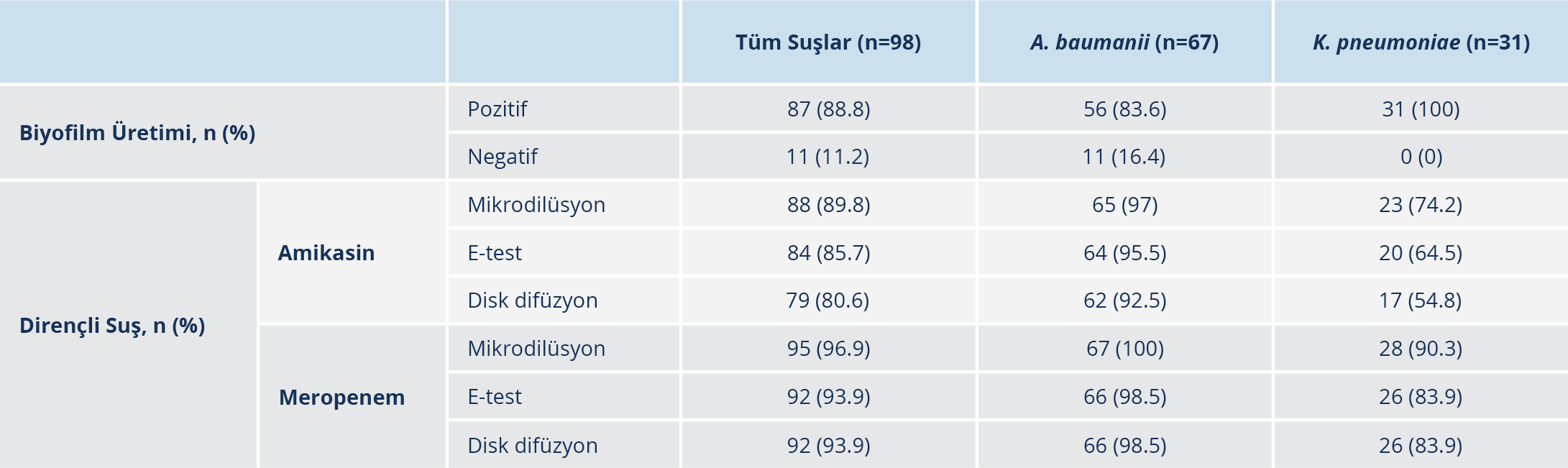
Çalışmaya dahil edilen 98 izolatın MALDI-TOF yöntemiyle 67’si A. baumanii, 31’i K. pneumoniae olarak tanımlandı. Tüm suşların 87 (%88.8)’sinde biyofilm üretimi saptandı. K. pneumoniae olarak tiplendirilen 31 suşun tamamı, A. baumanii olarak tiplendirilen 67 suşun ise 56’sı biyofilm üreticisi olarak tespit edildi. A. baumanii olarak tiplendirilen 11 suşta biyofilm üretimi saptanmadı. K. pneumoniae suşlarında biyofilm üretimi anlamlı olarak daha sık görüldü (p=0.015). Mikrodilüsyon yöntemiyle tüm bakterilerin 95 (%96.9)’inde meropeneme, 88 (%89.8)’inde ise amikasine direnç saptandı. Suşların biyofilm üretimi ve antibiyotik duyarlılık test sonuçlarını içeren laboratuvar verileri Tablo 2’de sunuldu.
Antibiyotik Duyarlılık Test Yöntemlerinin Karşılaştırılması
Çalışmaya dahil edilen tüm suşların amikasine ve meropeneme direnci mikrodilüsyon, e- test ve disk difüzyon yöntemleriyle test edildi. Biyofilm üretmeyen 11 A. baumanii, biyofilm üreten 56 A. baumanii ve biyofilm üreten 31 K. pneumoniae suşunun antibiyotik duyarlılık test sonuçları mikrodilüsyon yöntemi ile karşılaştırılarak değerlendirildi. Yöntemler arasında istatistiksel olarak anlamlı düzeyde fark saptanmadı (p>0.05). Test sonuçları arasındaki uyumu değerlendirebilmek için kappa değerleri hesaplandı.
Biyofilm üreticisi olmayan 11 A. baumanii suşunun tamamı, mikrodilüsyon ve e-test yöntemleriyle meropeneme ve amikasine dirençli saptandı. Mikrodilüsyon yöntemiyle amikasine dirençli saptanan bir suş disk difüzyon yöntemiyle amikasine duyarlı tespit edildi. Mikrodilüsyon yöntemiyle duyarlı suş sayısı yetersiz olduğundan bu grupta kappa değeri hesaplanamadı.
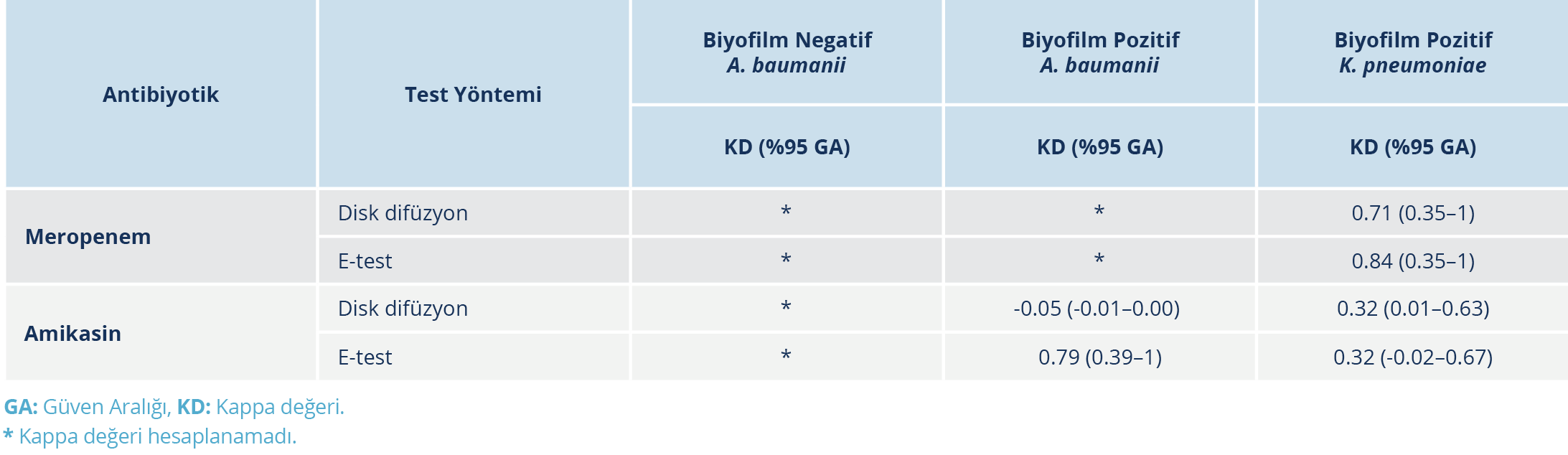
Biyofilm üretmeyen 56 A. baumanii suşlarının tamamı mikrodilüsyon yöntemiyle meropeneme dirençli saptanırken, e-test ve disk difüzyon yöntemleriyle 55 suş dirençli bulundu. Meropeneme duyarlı suş sayısı yetersiz olduğu için bu grupta meropenem için kappa değeri hesaplanamadı. Aynı grupta mikrodilüsyon yöntemiyle 54 suş, disk difüzyon yöntemiyle 52 suş, e-test yöntemiyle 53 suş amikasine dirençli saptandı. Mikrodilüsyon yöntemi ile disk difüzyon ve e-test yöntemleri arasında amikasin için anlamlı uyum olduğu belirlendi (p=0.687; p=1.000). Biyofilm üreticisi A. baumanii suşlarında amikasin için kappa değerleri e-test yöntemi için 0.79 (p=0.001), disk difüzyon yöntemi için -0.05 (p=0.690) olarak hesaplandı.
Biyofilm üreticisi olan 31 K. pneumoniae suşunun mikrodilüsyon yöntemiyle 28’i meropeneme dirençli bulundu. Meropeneme dirençli olarak belirlenen 28 suşun 26’sı disk difüzyon yöntemiyle, 27’si ise e-test yöntemiyle dirençli olarak saptandı. Tüm test yöntemlerinde üç suş meropeneme duyarlı bulundu. Bu grupta mikrodilüsyon yöntemi ile disk difüzyon ve e-test yöntemleri arasında meropenem için anlamlı uyum olduğu belirlendi (p=0.500; p=1.000). Mikrodilüsyon yöntemi ile disk difüzyon yöntemi arasındaki uyum düzeyi 0.716 (p=0.001), mikrodilüsyon ile e-test yöntemi arasındaki uyum düzeyi ise 0.839 (p=0.001) olarak saptandı.
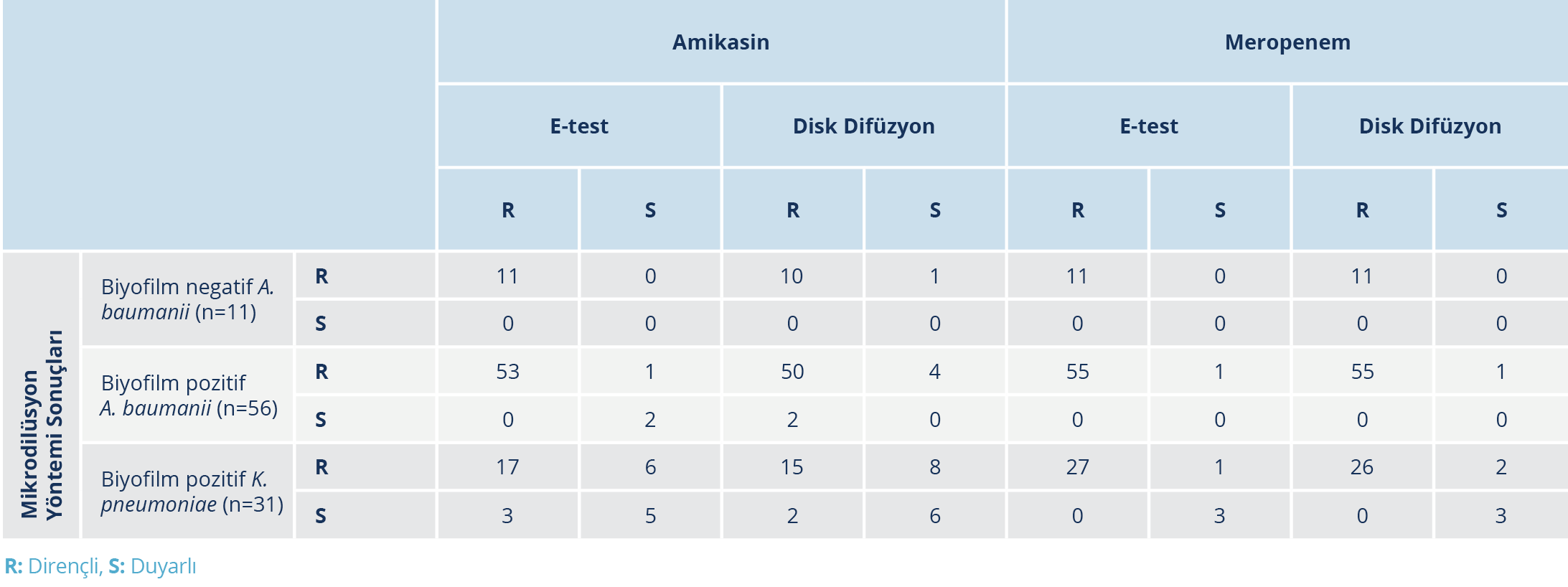
Tablo 3. Suşların Amikasin ve Meropeneme Duyarlılık Test Sonuçlarının Mikrodilüsyon Yöntemiyle Karşılaştırılması
Biyofilm üreticisi olan 31 K. pneumoniae suşunda mikrodilüsyon yöntemiyle amikasine dirençli saptanan 23 suşun 17’si e-test, 15’i disk difüzyon yöntemiyle dirençli; altısı e-test, sekizi disk difüzyon yöntemiyle duyarlı olarak belirlendi. Mikrodilüsyon yöntemi ile amikasine duyarlı olarak saptanan sekiz suşun üçü e-test, ikisi disk difüzyon yöntemiyle amikasine dirençli bulundu. Mikrodilüsyon yöntemi ile disk difüzyon ve e-test yöntemleri arasında amikasin için anlamlı uyum mevcuttu (p=0.109, p=0.508). Bu grupta amikasin için mikrodilüsyon ve disk difüzyon yöntemleri arasındaki uyum düzeyi 0.323 (p=0.049); e-test arasındaki uyum düzeyi ise 0.324 (p=0.048) olarak belirlendi. Test yöntemlerinden elde edilen sonuçlar ve yöntemler arasındaki uyum Tablo 3 ve Tablo 4’te sunuldu.
Biyofilm üretimi ile demografik veriler, çeşitli risk faktörleri, hasta sonlanımları ve mikrodilüsyon yöntemiyle saptanan meropenem ve amikasin direnç verilerinin karşılaştırılması için iki farklı gruplama yapıldı:
A. baumanii olarak tanımlanan 67 suş: 56 biyofilm pozitif suş ve 11 biyofilm negatif suş,
Biyofilm üreticisi olarak belirlenen 87 suş: 56 A. baumanii suşu ve 31 K. pneumoniae suşu.
Analiz I.
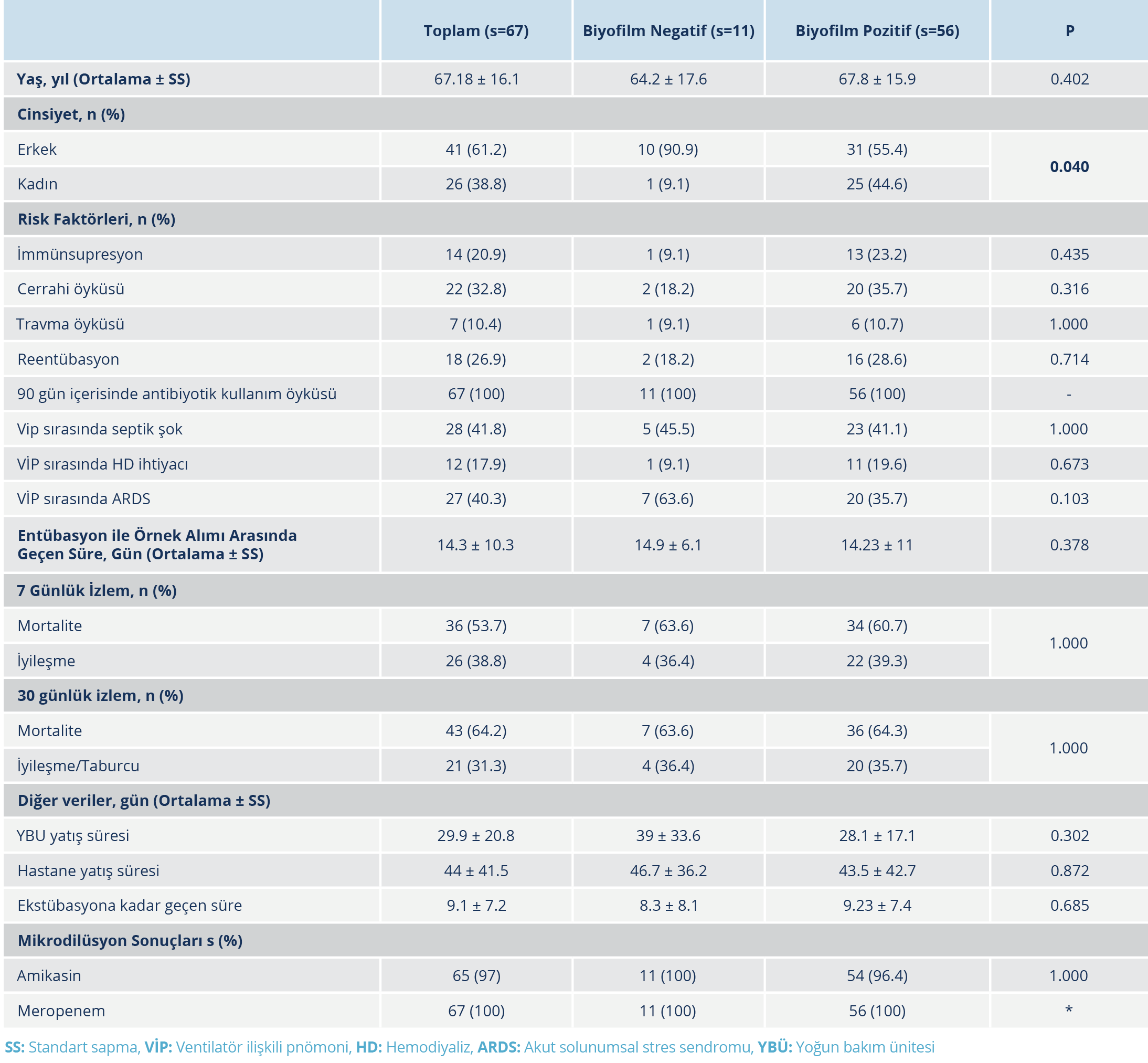
Tablo 5. Biyofilm Üreticisi Olan ve Biyofilm Üreticisi Olmayan A. Baumanii Suşlarının Karşılaştırılması
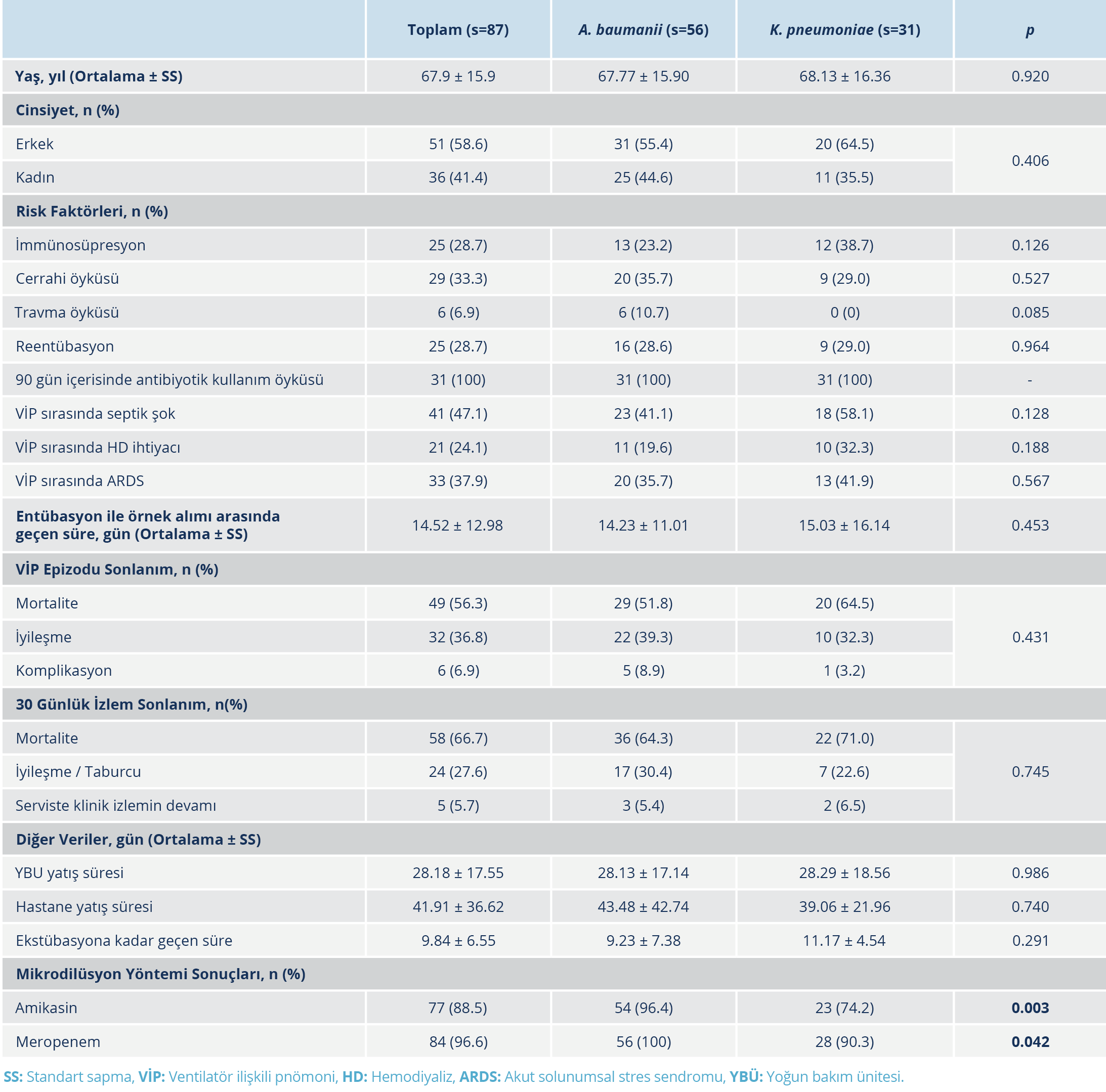
A. baumannii suşları yukarıda verilen sayılarda biyofilm pozitif ve biyofilm negatif olmak üzere iki gruba ayrıldı. Gruplar arasında yaş açısından anlamlı fark bulunmadı. Toplam 26 kadın hastadan alınan örneklerin 25 (%96.1)’inde ve toplam 41 erkek hastadan alınan örneklerin ise 31 (%75.6)’inde biyofilm üretimi saptandı. Kadın hastalardan alınan örneklerde biyofilm üretim oranı daha yüksekti (p=0.040; p<0.05). İncelenen risk faktörleri ve hasta sonlanımları açısından biyofilm üreten ve biyofilm üretimi yapmayan A. baumanii suşları arasında anlamlı farklılık saptanmadı (p>0.05). Tüm suşlarda meropeneme direnç saptandığı için gruplar arasında istatistiksel analiz yapılmadı. Mikrodilüsyon yöntemi ile amikasine direnç açısından da anlamlı fark bulunmadı (p=1.000; p>0.05) (Tablo 5).
Analiz II.
Biyofilm üreticisi olarak belirlenen 56 A. baumanii suşu ve 31 K. pneumoniae suşu arasında yaş, cinsiyet ve risk faktörleri açısından anlamlı düzeyde farklılık saptanmadı (p>0.05). Hastaların VİP epizodlarındaki ve 30 günlük izlem süreçlerindeki mortalite ve iyileşme oranları, hastanede ve yoğun bakımda yatış süreleri ve ekstübasyona kadar geçen süreler benzerdi (p>0.05). Mikrodilüsyon yöntemi ile saptanan meropenem ve amikasin direnç oranları A. baumannii grubunda K. pneumoniae grubuna kıyasla anlamlı derecede daha yüksek bulundu (p1=0.003; p2=0.042) (Tablo 6).
İRDELEME
Çalışmamızda yoğun bakım yatışı sırasında VİP tanısı konulan 96 hasta ve hastaların trakeal aspirasyon örneklerinden izole edilen 67 A. baumanii suşu ve 31 K. pneumoniae suşu değerlendirildi. Hastaların %62.2’si erkek, %37.8’i kadındı ve yaş ortalamaları 67.5 yıldı. Wang ve arkadaşlarının (24) Çin’de nozokomial infeksiyon gelişen 3223 hastayı değerlendirdikleri çalışmada, nozokomial infeksiyonların erkeklerde ve ileri yaş grubunda (>60 yaş) daha sık saptanması çalışmamızla benzerlik göstermektedir. Türkiye’den sağlık bakımı ilişkili infeksiyonların değerlendirildiği bir çalışmada, pnömoni en sık görülen üç nozokomial infeksiyon arasında yer almakta olup yoğun bakımda yatan hastalarda sıklığının arttığı saptanmıştır (25).
Suşların biyofilm üretim kapasitesini etkileyen risk faktörlerini değerlendiren çalışmalar olmakla birlikte, bu risk faktörleri henüz net olarak tanımlanmamıştır (4,5,7). Çalışmamızda K. pneumoniae suşlarının tamamında, A. baumanii suşlarının ise %83.6’sında biyofilm üretimi saptandı. Ülkemizde yapılan bir çalışmada A. baumanii suşlarında biyofilm üretiminin %99’a ulaşabildiği bildirilmiş olsa da çalışmamızda bu oran daha düşük bulundu (26). Gunardi ve arkadaşlarının (4) biyofilm üretimine etki eden risk faktörlerini incelediği çalışmasında biyofilm yapısı içerisinde K. pneumoniae suşlarının A. baumanii suşlarından daha sık yer aldığı gösterilmiştir. Bu veri çalışmamızdaki bulguları desteklemektedir. K. pneumoniae suşlarının kapsül, membran proteinleri gibi virülans faktörleri sayesinde biyofilm üreterek konak immün yanıtından korunduğu bilinmektedir (27). Çalışmamızda biyofilm üretiminin K. pneumoniae suşlarında anlamlı olarak daha sık saptanmasının kapsül yapısının biyofilm üretimini kolaylaştırmasından kaynaklandığı düşünülmektedir.
Mikrodilüsyon yöntemiyle tüm örneklerin %96.9’sında meropeneme, %89.8’inde ise amikasine direnç saptandı. Çalışmamızda suşların direnç oranları benzer hasta gruplarında yapılan diğer çalışmalardan daha yüksek saptandı (28,29). Çalışmaya dahil edilen hastaların tamamında son 90 gün içerisinde antibiyotik kullanım öyküsünün olmasının çalışmamızda direnç oranlarının yüksek olmasına sebep olduğu düşünülmektedir. Raman ve arkadaşlarının (30) antibiyotik direncine neden olan risk faktörlerini belirlemek için yaptıkları meta-analizde antibiyotik direnç gelişimine etki eden en önemli faktör hastanın antibiyotik kullanım öyküsü olarak bildirilmiştir. Liu ve arkadaşlarının (31) yaptığı çalışmada, karbapenem direncine sebep olduğu belirtilen 16 risk faktöründen biri hastanın antibiyotik kullanım öyküsü olarak bildirilmiştir.
Biyofilm üreticisi 56 A. baumannii suşu ile biyofilm üretmeyen 11 A. baumannii suşu ve bu suşların izole edildiği hastalar incelendiğinde, hastaların yaşları arasında anlamlı bir fark saptanmadı. Ancak kadın hastalardan alınan örneklerde biyofilm üretim oranı, erkek hastalardan alınan örneklere kıyasla anlamlı düzeyde daha yüksek bulundu. Gunardi ve arkadaşlarının (4) biyofilm üretimini etkileyen risk faktörlerini incelediği çalışmada, çalışmamızla benzer şekilde kadın cinsiyette biyofilm oluşumu erkek cinsiyetten daha sık görülmüştür. Aynı çalışmada, kateterizasyon süresi beş gün ve üzeri olan hastalarda biyofilm oluşumu ile anlamlı bir ilişki saptanmışken, bizim çalışmamızda kateterizasyon süresi ile biyofilm oluşumu arasında benzer bir ilişki gösterilemedi.
Çalışmamızda, biyofilm üreticisi olmayan suş sayısının yetersiz olması nedeniyle, biyofilm üretimi ile meropeneme ve amikasine direnç arasındaki ilişki değerlendirilemedi. Biyofilm yapısının çeşitli mekanizmalar aracılığıyla antibiyotik direncine sebep olduğu ve biyofilm ilişkili infeksiyonların, hastanede ve yoğun bakımda yatış süresini uzatarak mortalite oranını artırdığı gösterilmiştir (6,32). Ülkemizde yapılan çalışmalarda, biyofilm üreten suşlarda antibiyotik direnç oranlarının yüksek olduğu görülmektedir (33,34).
Biyofilm oluşumunun entübasyondan kısa süre sonra başladığı ve medikal ekipman kullanımı sürdükçe biyofilm matürasyonunun devam ettiği gösterilmiştir (10). Çalışmamızda biyofilm üretimi ile entübasyon süresi arasında anlamlı ilişki saptanmadı; benzer şekilde entübasyon süresi ile biyofilm oluşumu arasında ilişki gösterilemeyen çalışmalar da bulunmaktadır (5,7). Bununla birlikte yabancı cisim varlığı biyofilm oluşumunu kolaylaştırır. Ayrıca biyofilm ilişkili infeksiyonların tedavisinin diğer infeksiyonlara kıyasla daha zor olması nedeniyle infeksiyon kliniği bulunmasa bile tüm hastalar için medikal ekipman kullanımı düzenli olarak değerlendirilmelidir. Klinik endikasyonu olmayan ekipmanların uygun zamanda çıkarılması gereklidir.
Çalışmamızda biyofilm üreten A. baumanii ve K. pneumoniae suşlarının izole edildiği hastalar arasında risk faktörleri ve hasta sonlanımları açısından anlamlı fark saptanmadı. Bununla birlikte, amikasine ve meropeneme direnç oranları A. baumanii grubunda istatistiksel olarak anlamlı düzeyde K. pneumoniae grubundan daha yüksekti. Bu suşlar arasında direnç paterni farklılığının, biyofilm dışı antimikrobiyal direnç mekanizmalarından kaynaklandığı düşünülmektedir.
Çalışmaya dahil edilen tüm suşların meropeneme ve amikasine direnci üç farklı yöntemle test edildi. Biyofilm oluşturan K. pneumoniae suşlarında test sonuçları arasındaki uyumun, meropenem için amikasine göre daha yüksek olduğu belirlendi. Bu durumun, amikasinin hidrofilik yapısından kaynaklandığı düşünülmektedir. Biyofilm tabakası içerisindeki EPS yapısının, difüzyon bariyeri oluşturarak antibiyotiklerin mikroorganizmalara ulaşmasını engellediği bilinmektedir (3,11). P. aeruginosa suşlarında yapılan bir çalışmada, aminoglikozitlerin difüzyon bariyerinden karbapenemlere kıyasla daha zor geçtiği, ortama alginat liyaz eklenerek biyofilm yapısının bozulması sonrası geçişin hızlandığı gösterilmiştir (35). Mueller-Hinton agar yüzeyinde üreyen bakteri kolonileri arasında da benzer difüzyon bariyerinin geliştiği ve bu nedenle amikasin için disk difüzyon ve e-test yöntemleriyle saptanan MİK değerinin mikrodilüsyon yöntemine kıyasla daha yüksek ölçüldüğü düşünülmektedir. Ülkemizde yapılan bir çalışmada, farklı antibiyotik duyarlılık test yöntemleri karşılaştırılmış ve sonuçlar arasında değişkenlik olduğu gösterilmiştir (36). Bu nedenle, biyofilm üreten suşlarda, klinik uyumlu ideal antibiyotik duyarlılık testinin seçimi için daha fazla çalışmaya ihtiyaç vardır.
Biyofilm ilişkili infeksiyon düşünülen hastaların klinik ve laboratuvar verilerinin birlikte değerlendirilmesi açısından önemli olan çalışmamızda, hastaların altta yatan çeşitli risk faktörleri, VİP epizodları ve 30 günlük izlem sonlanımları, biyofilm üretimi ve farklı yöntemlerin antibiyotik duyarlılık test sonuçları ile birlikte değerlendirildi.
Bu çalışma bir tez projesi olarak planlandı ve örnek alımı COVID-19 pandemisi döneminde gerçekleştirildi. Pandemi süreci nedeniyle yeterli sayıda hasta dahil edilememesi çalışmanın en önemli kısıtlılığıdır. Ayrıca, biyofilm üretimi yapmayan suş sayısının yetersiz olması, istatistiksel olarak anlamlı karşılaştırmaların yapılmasını engelledi.
Çalışmada yer alan hastaların çoğunun yoğun bakım ünitesinde takip edilmesi ve önceki antibiyotik kullanım öykülerinin bulunması, antibiyotik direnç oranlarının yüksek saptanmasında etkili oldu. Bununla birlikte, biyofilm üretimi yapmayan ve antibiyotik duyarlı suş sayılarının da yetersiz olması nedeniyle gruplar arasında anlamlı analizler yapılamadı. Gruplar arasında istatistiksel olarak anlamlı farkların ortaya konulabilmesi için hasta ve örnek sayısının artırılması gerektiğini düşünüyoruz. Sonuç olarak; biyofilm yapısının antibiyoterapiye direnç gelişimine ve tedavi başarısızlığına neden olduğu bilinmektedir. Bu nedenle biyofilm üreten suşlarda antibiyotik duyarlılık testlerinin standardizasyonu konusunda daha fazla çalışma yapılmasına ihtiyaç vardır.
Hasta Onamı
Çalışmada hastalardan klinik gereklilik nedeniyle toplanan trakeal aspirasyon örnekleri değerlendirilmiş ve klinik veriler hastane bilgi sisteminden anonimleştirilerek elde edilmiştir.
Etik Kurul Kararı
Çalışma için, Dokuz Eylül Üniversitesi Klinik Araştırmalar Etik Kurulu’ndan 12 Haziran 2019 tarihli ve 2019/14-41 sayılı karar ile onay alınmıştır.
Danışman Değerlendirmesi
Bağımsız dış danışman
Yazar Katkıları
Fikir/Kavram – N.Y., İ.N.C.; Tasarım – N.Y., İ.N.C.; Denetleme – N.Y., S.A., İ.N.C.; Malzemeler/Hastalar – N.Y., İ.N.C.; Veri Toplama ve/veya İşleme – İ.N.C.; Analiz ve/veya Yorum – N.Y., İ.N.C., S.A.; Literatür Taraması – N.Y., İ.N.C., S.A.; Makale Yazımı – N.Y., İ.N.C., S.A.; Eleştirel İnceleme – N.Y., S.A., İ.N.C.;
Çıkar Çatışması
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Finansal Destek
Dokuz Eylül Üniversitesi Bilimsel Araştırma Projeleri Koordinasyon Birimi tarafından tıpta uzmanlık tezi olarak 2020.KB.SAG.010 kodlu proje ile desteklenmiştir.
Bilimsel Etkinlik
Araştırma sonuçları, 22-26 Mart 2023 tarihleri arasında Antalya’da düzenlenen Türkiye Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Uzmanlık Derneği (EKMUD) Kongresi’nde sözlü sunum olarak paylaşılmıştır.
Teşekkür
Tez konusunun belirlenmesi sürecindeki katkılarından dolayı Doç. Dr. Oya Özlem Eren-Kutsoylu’ya teşekkür ederiz.
Tez
Can İN. Hastane kökenli pnömoni etkeni Klebsiella ve Acinetobacter kökenlerinde biyofilm yapımı ve antibakteriyel duyarlılığın araştırılması [Tez]. İzmir: Dokuz Eylül Üniversitesi Tıp Fakültesi, İnfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı; 2021. Danışmanlar: Sema Alp Çavuş, Nur Yapar.
Değişiklik Geçmişi
23 Ekim 2025
Bu makaleye ilişkin bir düzeltme yayınlandı:
https://doi.org/10.36519/kd.2025.5422
Referanslar
- Lindsay D, von Holy A. Bacterial biofilms within the clinical setting: what healthcare professionals should know. J Hosp Infect. 2006;64(4):313-25. [CrossRef]
- Høiby N, Ciofu O, Johansen HK, et al. The clinical impact of bacterial biofilms. Int J Oral Sci. 2011;3(2):55-65. [CrossRef]
- Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev. 2002;15(2):167-93. [CrossRef]
- Gunardi WD, Karuniawati A, Umbas R, et al. Biofilm-producing bacteria and risk factors (gender and duration of catheterization) characterized as catheter-associated biofilm formation. Int J Microbiol. 2021;2021:8869275. [CrossRef]
- Wilson A, Gray D, Karakiozis J, Thomas J. Advanced endotracheal tube biofilm stage, not duration of intubation, is related to pneumonia. J Trauma Acute Care Surg. 2012;72(4):916-23. [CrossRef]
- Del Pozo JL. Biofilm-related disease. Expert Rev Anti Infect Ther. 2018;16(1):51-65. [CrossRef]
- Danin PE, Girou E, Legrand P, et al. Description and microbiology of endotracheal tube biofilm in mechanically ventilated subjects. Respir Care. 2015;60(1):21-9. [CrossRef]
- Inglis TJ, Millar MR, Jones JG, Robinson DA. Tracheal tube biofilm as a source of bacterial colonization of the lung. J Clin Microbiol. 1989;27(9):2014-8. [CrossRef]
- Gordon CA, Hodges NA, Marriott C. Antibiotic interaction and diffusion through alginate and exopolysaccharide of cystic fibrosis-derived Pseudomonas aeruginosa. J Antimicrob Chemother. 1988;22(5):667-74. [CrossRef]
- Diaconu O, Siriopol I, Poloșanu LI, Grigoraș I. Endotracheal tube biofilm and its impact on the pathogenesis of ventilator-associated pneumonia. J Crit Care Med (Targu Mures). 2018;4(2):50-5. [CrossRef]
- Marcinkiewicz J, Strus M, Pasich E. Antibiotic resistance: a “dark side” of biofilm associated chronic infections. Pol Arch Med Wewn. 2013;123(6):309-13.
- The European Committee on Antimicrobial Susceptibility Testing (EUCAST). Disk diffusion method for antimicrobial susceptibility testing. Version from March 2014 [Internet]. Växjö: EUCAST; 2014 [erişim 20 Ekim 2024]. https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/General_documents/Publications/Disk_diffusion_paper_printed_version_March_2014.pdf
- Metersky ML, Kalil AC. New guidelines for nosocomial pneumonia. Curr Opin Pulm Med. 2017;23(3):211-7. [CrossRef]
- Stiller A, Schröder C, Gropmann A, et al. ICU ward design and nosocomial infection rates: a cross-sectional study in Germany. J Hosp Infect. 2017;95(1):71-5. [CrossRef]
- Healthcare-associated infections (HAIs) [Internet]. Atlanta: The Centers for Disease Control and Prevention (CDC). [erişim 25 Nisan 2021]. https://www.cdc.gov/hai/
- Vincent JL. Nosocomial infections in adult intensive-care units. Lancet. 2003;361(9374):2068-77. [CrossRef]
- Christensen GD, Simpson WA, Younger JJ, et al. Adherence of coagulase-negative staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices. J Clin Microbiol. 1985;22(6):996-1006. [CrossRef]
- Vuotto C, Longo F, Pascolini C, et al. Biofilm formation and antibiotic resistance in Klebsiella pneumoniae urinary strains. J Appl Microbiol. 2017;123(4):1003-18. [CrossRef]
- Harika K, Shenoy VP, Narasimhaswamy N, Chawla K. Detection of biofilm production and its impact on antibiotic resistance profile of bacterial isolates from chronic wound infections. J Glob Infect Dis. 2020;12(3):129-34. [CrossRef]
- Alamri AM, Alsultan AA, Ansari MA, Alnimr AM. Biofilm-formation in clonally unrelated multidrug-resistant Acinetobacter baumannii isolates. Pathogens. 2020;9(8):630. [CrossRef]
- Kalil AC, Metersky ML, Klompas M, et al. Management of Adults with Hospital-Acquired and Ventilator-Associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61-e111. Erratum in: Clin Infect Dis. 2017;64(9):1298. Erratum in: Clin Infect Dis. 2017;65(8):1435. Erratum in: Clin Infect Dis. 2017;65(12):2161. [CrossRef]
- Stepanović S, Vuković D, Hola V, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. APMIS. 2007;115(8):891-9. [CrossRef]
- The European Committee on Antimicrobial Susceptibility Testing (EUCAST). EUCAST reading guide for broth microdilution: version 5.0, 2024 [Internet]. Växjö: EUCAST; 2024 [erişim 20 Ekim 2024]. https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/MIC_testing/Reading_guide_BMD_v_5.0_2024.pdf
- Wang M, Wei H, Zhao Y, et al. Analysis of multidrug-resistant bacteria in 3223 patients with hospital-acquired infections (HAI) from a tertiary general hospital in China. Bosn J Basic Med Sci. 2019;19(1):86-93. [CrossRef]
- Gürbüz E, Çelik M, Yıldız A. [Evaluation of infectious agents, species, and resistance profiles of healthcare-associated infections]. Klimik Derg. 2023;36(2):144-50. Turkish. [CrossRef]
- Gürpınar Ö, Ergin A, Zarakolu P, Köseoğlu Eser Ö. [Biofilm production and presence of virulence genes in invasive and non-invasive Acinetobacter baumannii isolates]. Flora. 2021;26(4):720-6. Turkish. [CrossRef]
- Schembri MA, Blom J, Krogfelt KA, Klemm P. Capsule and fimbria interaction in Klebsiella pneumoniae. Infect Immun. 2005;73(8):4626-33. [CrossRef]
- Moolchandani K, Sastry AS, Deepashree R, Sistla S, Harish BN, Mandal J. Antimicrobial resistance surveillance among intensive care units of a tertiary care hospital in Southern India. J Clin Diagn Res. 2017;11(2):DC01-7. [CrossRef]
- Barnsteiner S, Baty F, Albrich WC, et al; Swiss Centre for Antibiotic Resistance (ANRESIS). Antimicrobial resistance and antibiotic consumption in intensive care units, Switzerland, 2009 to 2018. Euro Surveill. 2021;26(46):2001537. [CrossRef]
- Raman G, Avendano EE, Chan J, Merchant S, Puzniak L. Risk factors for hospitalized patients with resistant or multidrug-resistant Pseudomonas aeruginosa infections: a systematic review and meta-analysis. Antimicrob Resist Infect Control. 2018;7:79. [CrossRef]
- Liu P, Li X, Luo M, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection: A meta-analysis. Microb Drug Resist. 2018;24(2):190-8. [CrossRef]
- Percival SL, Suleman L, Vuotto C, Donelli G. Healthcare-associated infections, medical devices and biofilms: risk, tolerance and control. J Med Microbiol. 2015;64(Pt 4):323-34. [CrossRef]
- Ataman M, Çelik BÖ. Investigation of the in vitro antimicrobial activity of eravacycline alone and in combination with various antibiotics against MDR Acinetobacter baumanni strains. BMC Microbiol. 2025;25(1):167. [CrossRef]
- Oyardi O, Hacioglu M, Yilmaz FN, Inan N, Birteksoz Tan AS. Antibiotic susceptibility and biofilm formation of multi-drug resistant Gram-negative bacteria. Istanbul J Pharm 53(1):45-50.
- Hatch RA, Schiller NL. Alginate lyase promotes diffusion of aminoglycosides through the extracellular polysaccharide of mucoid Pseudomonas aeruginosa. Antimicrob Agents Chemother. 1998;42(4):974-7. [CrossRef]
- Aytaç Ö, Öner P, Şenol FF, Aşçı-Toraman Z. [Comparison of colistin resistance results of multiple resistant clinical Acinetobacter baumannii isolates with broth microdilution, sensititre, and two different automated systems]. Klimik Derg. 2022;35(3):159-63. Turkish. [CrossRef]